Статья опубликована на с. 127-131
Введение
Проблема респираторной дисфункции после пластики больших вентральных грыж остается до конца не решенной, несмотря на совершенствование хирургических методик лечения и методик респираторной физиотерапии, направленных на профилактику респираторной дисфункции. Течение раннего послеоперационного периода после пластики больших вентральных грыж часто осложняется развитием послеоперационной гипоксемии (ПГ), дыхательной недостаточности (ДН), что приводит к увеличению сроков госпитализации, повышает стоимость лечения. ДН часто требует интубации трахеи (ИТ) и проведения продленной респираторной поддержки, что повышает риск развития нозокомиальной пневмонии и летальность [1, 2].
Неинвазивная вентиляция легких (НИВЛ) хорошо зарекомендовала себя в интенсивной терапии ДН. Однако остаются невыясненными вопросы эффективности ее профилактических методик и клинические аспекты проведения в послеоперационном периоде. Данные об эффективности послеоперационной НИВЛ в профилактике ДН, снижении заболеваемости пневмонией, сроков госпитализации и летальности противоречивы и мало исследованы [2, 3]. В то же время НИВЛ может быть полезной в профилактике респираторной дисфункции после пластики больших вентральных грыж.
Цель исследования — улучшить результаты лечения пациентов после пластики больших вентральных грыж за счет снижения частоты развития респираторной дисфункции путем использования профилактической НИВЛ.
Материалы и методы исследования
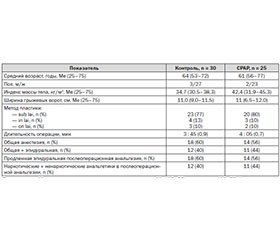
Исследование одобрено локальным этическим комитетом ГУ «Луганский государственный медицинский университет». Исследование проводилось на базе луганской городской многопрофильной больницы № 2, в отделении анестезиологии и интенсивной терапии с января 2013 по май 2014 г. Дизайн исследования — проспективное, одноцентровое, рандомизированное, контролируемое, простое слепое клиническое. В исследование включено 55 пациентов в возрасте 60,6 ± 8,5 года (М ± s), которым были выполнены различные методики ненатяжной герниопластики. В некоторых случаях герниопластика дополнялась реконструктивным вмешательством на передней брюшной стенке.
Критерии включения в исследование: открытая (нелапароскопическая) ненатяжная методика герниопластики вентральных грыж, диаметр грыжевых ворот ≥ 10 см, плановый характер оперативного вмешательства.
Критерии исключения: острый инфаркт миокарда в предшествующие оперативному вмешательству 6 мес., перенесенная в предыдущие 6 мес. пневмония, острый инфаркт миокарда в раннем послеоперационном периоде, обострение ХОЗЛ в предоперационном периоде, нарушения газообмена в предоперационном периоде, неспособность пациента к сотрудничеству с медперсоналом, значительные утечки дыхательной смеси при проведении НИВЛ и невозможность их устранения, нарушение проходимости верхних дыхательных путей, гемодинамическая нестабильность (АДср менее 90 мм рт.ст. на фоне инфузии дофамина со скоростью более 5 мкг/кг/мин).
Из исследования было исключено 2 больных. Пациенты проявили неспособность к сотрудничеству с медперсоналом при проведении НИВЛ, что выражалось в непереносимости процедуры.
В рамках исследования после стратификации по весу и последующей рандомизации было сформировано 2 группы пациентов. Периоперационная групповая характеристика пациентов отражена в табл. 1.
/51.jpg)
1-я группа пациентов получала в раннем послеоперационном периоде традиционный комплекс респираторной физиотерапии, при наличии показаний оксигенотерапию ч/з лицевую маску, лечебную НИВЛ, традиционную ИВЛ. Пациенты 2-й группы получали в раннем послеоперационном периоде профилактическую НИВЛ в режиме постоянного положительного давления в дыхательных путях (СРАР) согласно описанной методике (Патент Украины на полезную модель № 82212). Спустя 30 мин после экстубации трахеи проводили сеансы назального СРАР. Длительность сеанса — 60 мин. FiO2 наименьшее, которое обеспечивало SpO2 ≥ 95 %. Давление СРАР подбирали индивидуально, учитывая его переносимость, показатели АД, ЧСС, SpO2, ЧД. Обычно величина давления СРАР зависела от индекса массы тела (ИМТ). При ИМТ < 30 кг/м2 было достаточно СРАР 7–8 см вод.ст., при ИМТ > 30 кг/м2 — СРАР 9–10 см вод.ст.
Интервалы между сеансами составляли 2–4 ч и зависели от состояния газообмена, дыхательного паттерна пациента. Обычно в течение суток проводили 4–5 профилактических сеансов. В промежутках между сеансами СРАР, если SpO2 ≤ 95 %, проводилась оксигенотерапия ч/з лицевую маску. При дебюте ДН и наличии показаний к лечебной НИВЛ методику профилактического СРАР считали неэффективной и начинали лечебную НИВЛ в режимах BiPAP, PSV. Показания к лечебной НИВЛ — SpO2 ≤ 90 % при FiO2 1,0, ЧД — 30 в 1 мин, EtCO2 ≥ 60 мм рт.ст., PaO2 ≤ 60 мм рт.ст. при FiO2 1,0, PaCO2 ≥ 60 мм рт.ст., Vt ≤ 4 мл/кг.
Ввиду разнообразия клинико-лабораторных критериев ДН в литературных источниках в исследовании пользовались критериями American College of Physician (2013). Критерии, определяющие ДН: РаО2 < 60 мм рт.ст. или SpO2 (пульсоксиметрия) < 91 % при FiO2 0,21; РаСО2 > 50 мм рт.ст. при рН < 7,35; индекс оксигенации (ИО) < 300; уменьшение РаО2 или увеличение РаСО2 на 10 мм рт.ст. по сравнению с исходным уровнем (если определялся).
Перед проведением оперативного вмешательства пациенты всех групп получали стандартную предоперационную подготовку. Выбор методики проведения анестезиологического обеспечения определялся врачом-анестезиологом. Индукция анестезии — пропофол 2–2,5 мг/кг. Поддержание анестезии — пропофол (4–8 мг/кг/ч) или севофлюран (2–3 об.%). Миоплегии — атракурия безилат (индукция 0,5–0,6 мг/кг, поддержание релаксации 0,2–0,3 мг/кг/ч). Анальгезия — фентанил (4–5 мкг/кг/ч) или эпидуральная блокада. Для поддержки эпидурального блока использовали бупивакаин (0,4 мг/кг/ч), ропивакаин (0,4–0,7 мг/кг/ч). Пациенты получали интраоперационную респираторную поддержку с использованием режимов вентиляции (CMV, SIMV) в рамках следующего протокола: FiO2 40–50 %, Vt 7–8 мл/кг, ЧД 12–14/мин, РЕЕР 2–5 см вод.ст. Интенсивная терапия в послеоперационном периоде включала в себя инфузионную терапию, антибиотикотерапию, профилактику тромбоэмболических осложнений, профилактику острых язв ЖКТ, рациональное послеоперационное обезболивание, борьбу с послеоперационным парезом кишечника.
В рамках данного исследования были выделены следующие этапы исследования: Т1 — через 30 мин после экстубации трахеи (перед первым сеансом НИВЛ), Т2 — после сеанса НИВЛ, Т3 — 24 ч после–операционного периода, Т4 — 48 ч послеоперационного периода.
Состояние функции внешнего дыхания (ФВД) изучали при проведении спирографии на этапах исследования (Т1, Т2, Т3, Т4). Исследования проводили спирометром MIR Spirobank. Изучали следующие параметры: дыхательный объем (Vt), форсированная жизненная емкость легких (FVC), форсированный объем выдоха в 1 с (FEV1), FEV1/FVC %.
Изучение газового состава и кислотно-основного состояния артериальной и венозной крови проводили с помощью газового анализатора Easy Blood Gas (Medica Corporation, США). Исследования осуществлялись только у пациентов, которые дали согласие на их проведение после предварительного ознакомления с имеющимися рисками. Анализировали такие показатели на этапах исследования (Т1, Т2, Т3, Т4): РаО2, РаСО2, рН.
Статистический анализ данных был выполнен с использованием программы Statistica 6.0 for Windows (StatSoft Inc., США). Данные представлены как среднее ± стандартное отклонение, при нормальном распределении и медиане (25–75-й перцентили) при распределении, отличном от нормального. Сравнение двух зависимых груп проводили с использованием критерия Вилкоксона, сравнение двух несвязанных групп проводили с использованием критерия Манна — Уитни. При множественных сравнениях рассчитывали поправку Бонферрони. Статистически значимыми считали различия при р < 0,05.
Результаты и обсуждение
После экстубации трахеи и перевода пациентов на спонтанное дыхание у пациентов обеих групп отмечалось статистически значимое по сравнению с дооперационным уровнем уменьшение показателей Vt FVC, FEV1 на фоне неизменных значений FEV1/FVC (табл. 2). При анализе показателей оксигенации (SpO2, PaO2) в обеих группах на этапе после экстубации трахеи обращало на себя внимание их выраженное достоверное снижение в сравнении с дооперационными значениями при рН в пределах нормальных значений. Показатели PaCO2, EtCO2 в обеих группах демонстрировали достоверный прирост на этапе после экстубации трахеи по сравнению с исходными значениями до операции (табл. 3).
Кроме того, особый интерес представляла динамика градиента PaCO2-EtCO2. Значения градиента возрастали после экстубации в сравнении с дооперационными показателями (табл. 3).
Редукция объемных показателей спирограммы на фоне сохранения их соотношения в нормальных пределах свидетельствует о развитии рестриктивных изменений ФВД у пациентов обеих групп в первые часы после пластики вентральных грыж. Выявленные рестриктивные нарушения ФВД, снижение оксигенирующей функции легких на фоне тенденции к гиперкапнии говорят о развитии рестриктивного послеоперационного синдрома, который достаточно часто встречается после обширных абдоминальных операций [3, 4]. Учитывая динамику градиента PaCO2-EtCO2 нельзя исключать, что снижение альвеолярной оксигенации может быть также вызвано и нарушением соотношения вентиляция/перфузия [5].
После проведения сеанса СРАР на этапе Т2 отмечалось улучшение показателей ФВД, оксигенации: показатели SpO2, PaO2, Vt, FVC, FEV1 достоверно возросли в сравнении с этапом Т1 (табл. 2, 3)..SpO2/FiO2 возросло после сеанса СРАР на 59 % в сравнении с этапом перед СРАР (р < 0,05). Кроме того, отмечалась тенденция к снижению PaCO2, EtCO2 (табл. 2). Можно отметить, что профилактическое назначение СРАР после экстубации трахеи и перевода пациента на самостоятельное дыхание способствовало поддержанию адекватной альвеолярной вентиляции, положительно влияло на газообмен. В контрольной группе показатели ФВД и газообмена статистически не отличались от этапа Т2.
В группе контроля через 24–48 ч после герниопластики показатели ФВД и газообмена сохраняли свои критически низкие значения. Также обращал на себя внимание высокий градиент PaCO2-EtCO2. Первые 24–48 ч после пластики больших вентральных грыж у пациентов были критическими в плане риска развития респираторной дисфункции. Высокие значения градиента PaCO2-EtCO2 могут указывать на нарушение соотношения вентиляция/перфузия [5, 6]. Если учесть отсутствие на этот момент нарушений гемодинамики, возможно, это указывает на развитие компрессионных ателектазов после пластики больших вентральных грыж, однако в нашем исследовании было небольшое число наблюдений.
Показатели газообмена, ФВД в группе СРАР на 24 ч послеоперационного периода были достоверно лучше, чем в группе контроля (табл. 2, 3). Кроме того, градиент PaCO2-EtCO2 и EtCO2 в группе СРАР оставался в пределах нормальных значений (табл. 3).
Гипоксемические нарушения газообмена были выявлены в раннем послеоперационном периоде у 66 % пациентов в группе контроля, из них 53 % случаев классифицировались как ДН 1-го типа. В подавляющем большинстве случаев в группе контроля (у 80 % пациентов) респираторная дисфункция хорошо корректировалась дополнительным кислородом. Случаев тяжелой гипоксемии, обострения сопутствующей ХОБЛ не было выявлено. Все случаи резистентной к дополнительному кислороду ПГ (в группе контроля) успешно корректировались терапевтической НИВЛ. Терапевтическая НИВЛ в режиме PSV, BiPAP понадобилась 5 пациентам контрольной группы. При использовании превентивного СРАР эпизодов ПГ, ДН было меньше. Так, ПГ была диагностирована у 40 % пациентов, из них у 16 % данное нарушение газообмена было расценено как ДН 1-го типа. Обращает на себя внимание отсутствие эпизодов ДН, резистентной к дополнительному кислороду и требовавшей проведения лечебной НИВЛ. Использование СРАР с целью профилактики респираторной дисфункции уменьшило число эпизодов ДН и ПГ и, как следствие, позволило сократить сроки пребывания в ОИТ (табл. 4).
/54.jpg)
Заключение
Течение раннего послеоперационного периода после пластики больших вентральных грыж сопровождается развитием типичного для обширных абдоминальных вмешательств рестриктивного синдрома. Включение в комплекс профилактики послеоперационной респираторной дисфункции НИВЛ в режиме СРАР способствовало предупреждению респираторной дисфункции и положительно влияло на результаты лечения путем сокращения числа эпизодов ПГ, ДН.
Список литературы
1. Jaber S. Outcomes of patients with acute respiratory failure after abdominal surgery treated with noninvasive positive-pressure ventilation / S. Jaber, J. Delay, M. Sebbane, G. Chanques, E. Jacquet, B. Souche, P. Perrigault, J. Eledjam // Chest. — 2005. — Vol. 128. — P. 88-95.
2. Zoremba M. Short term non-invasive ventilation post-surgery improves arterial blood-gases in obese subjects compared to supplemental oxygen delivery-a randomized controlled trial / M. Zoremba, G. Kalmus, D. Begemann, L. Eberhart, N. Zoremba, H. Wulf, F. Dette // BMC Anesthesiology. — 2011. — Р. 11-16.
3. Squadrone V. Continuous positive airway pressure for treatment of postoperative hypoxemia: a randomized controlled trial / V. Squadrone, M. Coha, E. Cerutti, M.M. Schellino, P. Biolino, P. Occella, G. Belloni, G. Vilianis, G. Fiore, F. Cavallo, V.M. Ranieri// JAMA. — 2005. — Vol. 293. — P. 589–595.
4. Ferreyra G. Acute respiratory failure after abdominal surgery / G. Ferreyra, V. Squadrone, V. Ranieri // Уear of intensive care and emergency medicine. — 2005. — Vol. 1. — P. 10-11.
5. Tusman G. Monitoring dead space during recruitment and PEEP titration in an experimental model / G. Tusman, F. Suarez-Sipmann, T. Pech, G. Hedenstierna // Intensive Care Med. — 2006. — 32. — 1863-1871 [PMID: 17047925 DOI: 10.1007/s00134-006-0371-7).
6. Hedenstierna G. Mechanisms of atelectasis in the perioperative period / G. Hedenstierna, L. Edmark // Best Pract. Res. Clin. Anaesthesiol. — 2010. — Vol. 24. — P. 157-169.

/51.jpg)
/53.jpg)
/54.jpg)