Статтю опубліковано на с. 66-71
Будь-який нешкідливий засіб, який хоча б одного разу виявився успішним, заслуговує на вивчення.
Broca (1860)
Вступ
Епілепсія — хронічне захворювання головного мозку, що характеризується повторними нападами, які виникають у результаті надмірної нейронної активності, та супроводжується різними клінічними та параклінічними проявами [2, 5]. Цереброваскулярні захворювання — один із найчастіших факторів ризику розвитку симптоматичної епілепсії. Найбільш вагоме дослідження даної теми в Радянському Союзі було проведено Е.С. Прохоровою [11]. Автор проаналізувала великий матеріал (26 000 випадків) і довела, що при ішемічному інсульті епілептичні напади мали місце в 10 712 хворих (41,2 %).
За даними А.Б. Гехт [4], частота розвитку післяінсультної епілепсії становить близько 9,6 %. У 6 % пацієнтів епілептичні напади траплялися протягом першого тижня ішемічного інсульту. У відновлювальному періоді напади відбувалися в 60 % пацієнтів. Середня частота судинної епілепсії становила 4,2 % випадків, що відповідало результатам досліджень, які проводили в Норвегії та Великобританії [13]. Ранні епілептичні напади проявляються протягом перших 7 діб розвитку інсульту, а пізні напади виникають після перших 7 діб із моменту появи симптомів інсульту, у більшості випадків через 2–10 місяців від початку захворювання, а іноді через кілька років [11, 15]. У структурі епілепсії в осіб похилого віку провідними типами нападів є парціальні (прості або складні, з вторинною генералізацією або без неї) [11]. Виникнення різноманітних форм епілептичних нападів у відновлювальному й резидуальному періодах інсульту пов’язане з наявністю постішемічної лікворної кісти або кіркової атрофії, у результаті чого формується епілептичний фокус [7].
Відповідно до даних представників павловської школи, таке епілептогенне вогнище, оточене «валом гальмування», час від часу викликає засвоєння патологічного ритму оточуючими здоровими ділянками мозку, що призводить до генералізації патологічного ритму та розвитку епілептичного нападу — нейронного розряду. Тому в кожного конкретного хворого наявне своє індивідуальне співвідношення між успадкованим рівнем судомної готовності та вираженістю набутих ушкоджень мозку, що призводять до формування епілептогенного вогнища [1, 3].
Імовірно, що ідеальним засобом для припинення епілептичних нападів міг би стати метод лікування, при якому гальмівний вплив на епілептогенне вогнище не супроводжувався би загальним пригніченням головного мозку. Цей метод дозволив би вибірково впливати на вогнище органічного пошкодження. Очевидне й інше; бажаної вибірковості неможливо досягнути, якщо застосовувати тільки медикаментозне лікування. Також відомо, що психотерапевтичний метод дозволяє забезпечити лише вплив на окремі ділянки головного мозку. Наприклад, у процесі гіпносугестивної терапії неважко викликати функціональний параліч руки або анестезію в ній за рахунок вибірково гальмівних впливів на ділянку кори, що відповідає соматотопічному представництву органа. Панують переконання, що психотерапії доступні тільки психогенні функціональні розлади, тоді як епілепсія є органічним захворюванням нервової системи, тому психотерапевтичний вплив на неї не може бути ефективним. Деякими авторами висувалася пропозиція застосовувати психотерапію для лікування невротичних реакцій, для стабілізації емоційного стану й корекції інших вторинних функціональних розладів у хворих на епілепсію [10]. Іркутський вчений-невролог X.Г. Ходос (1970) зазначав, що психотерапія показана хворим на епілепсію не менше, ніж хворим із неврозами. Однак він мав на увазі лікування методами психотерапії вторинних щодо основного захворювання функціональних розладів. R. Dreuer (1960) дійшов висновку, що психотерапія може допомогти безпосередньо запобігти виникненню епілептичних нападів і протягом короткого часу можливо досягти відчутних результатів лише за умови диференційованих гіпнотичних навіювань залежно від особливостей розвитку клінічного перебігу епілепсії [3]. М.Ш. Вольф (1958, 1965) проводив гіпнотерапію хворим на епілепсію під контролем електроенцефалографічних досліджень і відмітив, що під час глибокого гіпнотичного сну у хворих із симптоматичними формами захворювання спостерігалася відсутність деяких патологічних компонентів електроенцефалограм. Але при пробудженні ці порушення, а саме повільнохвильова активність, з’являлися знову.
Лікування епілепсії (епілептичних нападів) методами психотерапії згадується в Новому Заповіті (Лк. 9:38–42):
«38. І ось чоловік з натовпу закричав, гукаючи: «Учителю, благаю тебе зглянутись на мого сина, бо один він у мене!
39. А ото дух хапає його, він раптово кричить, кидається з піною. І вимучивши його, насилу відходить від нього.
40. Благав я учнів Твоїх, щоб вигнали його, але не змогли!»
41. У відповідь Ісус сказав: «О роде невірний і розбещений, доки Я буду з вами й терпітиму вас? Приведи сюди свого сина!»
42. Коли він ще йшов, кинув його і затряс ним біс. Та Ісус пригрозив нечистому духові, оздоровив дитину і віддав батькові».
Лікування хворих похилого віку із перенесеним церебральним інсультом в анамнезі з діагностованою післяінсультною епілепсією є непростим завданням порівняно з лікуванням епілепсії в пацієнтів молодого віку [6, 14]. Це пов’язане зі збільшенням ризику міжлікарської взаємодії, вікової залежності печінкової та ниркової дисфункції, що потребує збільшення інтервалів між прийомом антиконвульсантних препаратів. Дозозалежні побічні ефекти антиконвульсантів, такі як запаморочення або вестибулярні розлади, а також препаратспецифічні побічні дії, такі як гіпонатріємія чи тремор, можуть бути обумовлені вищим рівнем концентрації антиепілептичних препаратів у сироватці крові порівняно з пацієнтами молодого віку [7, 13]. Прийом класичних антидепресантів, транквілізаторів та антиконвульсантів небажаний через ряд ускладнень, побічних явищ з огляду на наявність тяжких набутих супутніх соматичних захворювань у хворих даної категорії. Традиційні антиепілептичні препарати (карбамазепін, фенітоїн, вальпроати) метаболізуються в печінці. Так, карбамазепін і фенітоїн індукують печінковий метаболізм, тим самим значно знижають ефекти багатьох лікарських препаратів, включаючи варфарин. Вальпроати й ламотриджин інгібують печінковий метаболізм та підвищують ризик розвитку печінкової недостатності, особливо на фоні гепатодуоденальної недостатності. Карбамазепін значно підвищує ризик гіпонатріємії, що повинно враховуватися при лікуванні хворих на післяінсультну епілепсію, які отримують лікування з приводу гіпертонічної хвороби та використовують тіазидні діуретики (гіпотіазид, індопрес, арифон). При цьому значно підвищується частота запаморочень, головокружінь, летаргії, сомноленції, що асоціюються з гіпонатріємією [3]. Значно підвищується ризик антиепілептично-асоційованого остеопорозу, остеомаляції на фоні приймання фенобарбіталу, фенітоїну, пермідону [6]. При цьому ризик розвитку остеопенії й остеопорозу значно зростає при політерапії порівняно з монотерапією. Мінімальний профіль міжлікарської взаємодії описаний тільки для нових антиепілептичних препаратів (габапентин, леветирацетам) [5, 9]. Ці препарати ефективні при фокальній епілепсії та виводяться через нирки в незміненому вигляді, однак їх дозування залежить від порушення реальної функції. Отже, серед побічних ефектів антиконвульсантів у похилій віковій групі найбільш часто зустрічаються збільшення маси тіла, загальна седативна дія, шлунково-кишкові ускладнення, порушення пам’яті та мислення, головокружіння, зменшення маси тіла, когнітивні порушення, гіпонатріємія, депресія, гіперхолестеринемія [6].
Окрім того, що антиконвульсивна фармакотерапія має виражені токсичні побічні ефекти, вона може змінювати перебіг захворювання, усунути ті чи інші порушення, але не може змінити поведінку хворого в соціальному середовищі (Карлов В.А., 1996).
Усвідомлення цих фактів спонукало нас розробити методи лікувальної антиконвульсивної сугестії, яка б забезпечувала припинення судомних нападів та одночасно дозволила б зменшити дози класичних антиконвульсантів у терапії в похилих хворих із післяінсультною епілепсією.
Матеріали і методи дослідження
Лікувальна сугестивна психотерапія (СП) проводилася 11 хворим в умовах ангіоневрологічного відділення клініки нейрохірургії та неврології Військово-медичного клінічного центру Західного регіону (м. Львів), які становили основну групу досліджуваних. Середній вік хворих — 65,4 ± 1,5 року. Неврологічний огляд проводився за загальноприйнятою методикою. Окрім цього, усім хворим були проведені стандартні обстеження: психодіагностичне (шкала Mini-Mental State Examination, MMSE, госпітальна шкала тривоги та депресії (Hospital Anxiety and Depression Scale, HADS), шкала депресії Бека (Beck Depression Inventory), лабораторне (загальний та біохімічний аналізи крові, коагулограма), електроенцефалографічне (ЕЕГ) на 16-канальному енцефалографі EEG16S «Medicor», нейровізуалізаційне — комп’ютерно-томографічне (КТ) головного мозку (апарат «Asteion-4 мод.» модель TSX- 021В, Японія).
Обстежені хворі отримували гіпотензивну, антиагрегантну, нейрометаболічну, протисудомну, при потребі — інфузійну терапію. Для лікування судомних проявів епілепсії, супутніх невротичних, тривожно-депресивних та когнітивних розладів застосовували методику сугестивної психотерапії в кількості від 8 до 15 сеансів, до 40 хвилин кожний за методикою професора А.Є. Архангельського [1]. Оцінку навіюваності досліджували за допомогою ульнарного феномену В.М. Бехтерева. Навіювання в гіпнотичний стан відбувалося методом релаксації (техніка М.І. Платонова). Стадію глибини гіпнотичного сну визначали згідно з класифікацією Є.С. Каткова (1941). Зміст сеансів мав індивідуальний характер і входив до складу наступних послідовних навіювань, що не повторювалися [9, 10, 12].
1. Психотерапевтична розмова з метою встановлення гіпнорапорту. Занурення в гіпнотичний сон із метою дезактуалізації психотравмуючих переживань.
2. Проведення сугестивної гіпногіпермнезії щодо перенесених нападів, блокування негативних сновидінь, які сформували в пацієнта судомний стереотип, для запобігання психогеніям та їх рецидивам.
3. Використання гіпногіпермнезії з лікувальною метою.
4. Застосування антиконвульсивної сугестії.
5. Активація підвищення психічного й вітального тонусу.
6. Завершальний сеанс курсу сугестивної психотерапії з метою тривалої пролонгації закріплених попередніх навіювань.
На всіх етапах курсу проводився гіпнотичний сон-відпочинок для формування нормальної біоелектричної активності мозку. За даними ЕЕГ-дослідження в усіх хворих до проведення антиконвульсивної сугестивної психотерапії спостерігалися різні відхилення біоелектричної активності головного мозку від нормальних показників, а саме: дезорганізована та низькоамплітудна редукція альфа-ритму, зсув спектра амплітуди до дельта- і тета-хвиль, наявність пароксизмальної активності. У більшості хворих відзначали повільнохвильову високоамплітудну активність, порушення зональних відмінностей, пароксизмальні компоненти поліформних комплексів, що складалися з піків, гострої та повільної хвиль.
Повної відміни антиконвульсантів не було. Залишався прийом попередніх препаратів притиепілептичної дії (частіше карбамазепіну 200 мг/добу). Їх призначення супроводжувалося сугестивною підтримкою. Отримуючи меньші дози антиконвульсантів, пацієнт тим самим підтримував напруженість і тривалість сугестії. Додатковим посилювачем ефективності лікування було призначення плацебо-препарату (похідного гамма-аміномасляної кислоти — гопантенової кислоти 500 мг/добу) та створення сугестивної складової самої медикаментозної терапії.
Хворі контрольної групи (n = 7) отримували лише стандартне (базове) лікування.
Отримані результати обробляли статистично з використанням пакетів прикладних програм Statistica 5.5 для Windows, Microsoft Office Excel 2010. Статистичну значимість відмінностей між середніми значеннями показників у групах оцінювали за допомогою t-критерію Стьюдента.
Результати дослідження і їх обговорення
У досліджуваних хворих складні парціальні напади спостерігалися в 11 (61,1 %) хворих, прості — у 5 (27,8 %) осіб, напади з вторинною генералізацією були у 2 (11,1 %) пацієнтів.
У всіх хворих епілептичні напади були пізніми. Упродовж 1-го року після інсульту перший епілептичний напад виник у 10 (55,6 %) хворих, упродовж наступного року — у 5 (27,8 %) осіб та у 2 (11,1 %) пацієнтів — на 3-й і 4-й роки. У всіх хворих в анамнезі були церебральні інсульти. Вісім (44,4 %) хворих перенесли інфаркт мозку в басейні правої середньої мозкової артерії (СМА), 6 (33,3 %) — у басейні лівої СМА, у басейні передніх мозкових артерії (ПМА) — 2 (11,1 %) пацієнти, ще 2 (11,1 %) — у басейні правої та лівої внутрішніх сонних артерій (ВСА). У 5 хворих церебральний ішемічний інсульт був повторним: у 3 випадках у тому ж басейні, у 2 випадках — в інших басейнах. Спонтанний субарахноїдальний крововилив в анамнезі мав місце в 1 хворого. У 2 хворих встановлений діагноз ішемічного інсульту та складного парціального припадку з вторинною генералізацією. Початок виникнення епілептичних нападів відбувався після 60 років.
У всіх досліджуваних хворих епілептичні напади були повторними та виникали на фоні прийому класичних антиконвульсантів. В 11 (61,1 %) хворих епілептичні напади виникли вдруге, у 4 (22,2 %) — утретє. У 3 (16,7 %) осіб епілептичні напади спостерігалися понад 3 разів. Карбамазепін приймали 14 хворих, ламотриджин — 3, топірамат — 1 пацієнт. Зазначеним вище хворим дані препарати призначали у вигляді монотерапії. Випадки трьох і більше епілептичних припадків спостерігалися в одного хворого, який приймав топірамат, і в 6 пацієнтів, які приймали карбамазепін. При детальному зборі анамнезу встановлено, що зазначені хворі не дотримувалися суворого режиму сну, не обмежували себе в перегляді телепрограм, роботі з комп’ютером, порушували дієту — вживали одночасно велику кількість рідини, часник; окремі хворі вживали алкоголь та нерегулярно приймали призначені антиконвульсанти.
Клінічні прояви післяінсультної епілепсії відповідають певному патологічному вогнищу в головному мозку. Проведений аналіз локалізації й розмірів післяінсультних ішемічних змін, що виявлені при КТ (табл. 1).
Із наведених даних встановлено, що найчастіше у хворих із післяінсультною епілепсією мали місце невеликі та середні післяінсультні лікворні кісти, переважала локалізація кірково-підкіркова та кіркова.
Післяінсультні лікворні кісти найчастіше локалізувалися в скроневих і скронево-тім’яних ділянках (80 %) та корелювали з розвитком складних парціальних нападів (72,2 %). Локалізація післяінсультних лікворних кіст у кіркових відділах головного мозку корелювала з простими парціальними припадками. При локалізації післяінсультних лікворних кіст у ділянках моторних відділів кори головного мозку напади відбувалися за типом джексонівських та супроводжувалися післяіктальним моторним дефіцитом.
Результати оцінки когнітивних порушень у хворих на післяінсультну епілепсію за шкалою MMSE наведені у табл. 3.
Слід відзначити, що в більшості обстежених хворих на післяінсультну епілепсію до початку лікування за даними шкали MMSE відмічалися когнітивні порушення. В обстежених хворих після проведення лікування спостерігали зростання чисельного значення балів у більшості субтестів шкали MMSE: у більшості хворих (65 %) когнітивні порушення нівелювалися, а в 35 % пацієнтів були охарактеризовані як незначні. Отримані результати свідчать про позитивний вплив лікувальної СП на когнітивні показники за шкалою MMSE у хворих на післяінсультну епілепсію.
Як видно з табл. 4 і 5, на фоні лікувальної СП значно зменшилися прояви тривоги та депресії.
Фармакотерапія післяінсультної епілепсії з використанням класичних антиконвульсантів у поєднанні з лікувальною СП у більшості випадків дозволила досягнути повної ремісії нападів упродовж року (n = 8; 72,7 %). У 3 (27,3 %) хворих частота нападів зменшилася більше як на 50 %. Ураховуючи, що післяінсультна епілепсія є локально обумовленою, симптоматичною з парціальним компонентом припадків, перевага як препарату першого вибору була за карбамазепіном. Використовувалася пролонгована (ретардована) форма препарату 200 мг/добу.
За даними ЕЕГ-дослідження в усіх хворих до застосування лікувальної СП спостерігалися різні відхилення біоелектричної активності головного мозку від нормальних показників, а саме: дезорганізована та низькоамплітудна редукція альфа-ритму, зсув спектра амплітуди до дельта- і тета-хвиль, наявність пароксизмальної активності. У більшості хворих спостерігали повільнохвильову високоамплітудну активність, порушення зональних відмінностей, пароксизмальні компоненти поліформних комплексів, що складалися з піків, гострої та повільної хвиль.
Клінічна ефективність застосування комплексного лікування поєднувалася з позитивними змінами на ЕЕГ: значне зменшення вираженості епілептиформної активності та зменшення індексу гострих і повільних хвиль.
Клінічний приклад. Хворий Р., 1955 р.н., у травні 2006 р. переніс спонтанний субарахноїдальний крововилив; у травні 2008 р. — ішемічний інсульт у басейні правої СМА. Виписаний з покращанням: руховий стереотип відновився до самостійного обслуговування. За шкалою інсульту NIHSS при надходженні 12 балів, при виписці — 6. Епілептичний напад відбувся через 4 роки після ішемічного інсульту та повторювався з періодичністю до 4 разів на рік. Постійно приймав карбамазепін, магнікор, престаріум.
Надійшов у плановому порядку для обстеження та лікування в ангіоневрологічне відділення клініки нейрохірургії та неврології зі скаргами на погіршення пам’яті, порушення нічного сну, болі голови, втому та внутрішнє напруження, тривогу, періодичні епілептичні напади (до 4 разів на рік).
При надходженні хворий у свідомості, звернене мовлення розуміє, мовний контакт вільний, інструкції виконує. Емоційно лабільний, фіксований на болісних відчуттях. Зіниці однакові, фотореакції мляві, конвергенція з акомодацією ослаблені. Ністагм відсутній, двоїння заперечує. Згладжена права носогубна складка. Девіація язика вправо. Дистанс-оральний рефлекс Карчикяна. Сухожилкові та періостальні рефлекси переважають зліва. Лівобічний геміпарез, гемігіпестезія. М’язова сила в паретичних кінцівках — 4 бали. Патологічні ступневі рефлекси та менінгеальні симптоми не викликаються. Координаторні проби виконує правильно. Функція тазових органів контрольована.
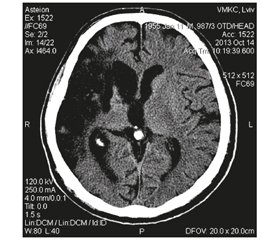
При КТ-дослідженні головного мозку в правій скронево-тім’яній ділянці відмічається значна ішемічна зона з чітким контуром щільності від +3 до +12 ОД з розширенням правого бокового шлуночка до 2,5 см. Ширина тіла лівого бокового шлуночка до 1,6 см. Серединні структури не зміщені, борозни та щілини розширені (рис. 1).
Висновок: КТ-картина лікворної кісти правої скронево-тім’яної ділянки.
Лабораторні дослідження крові в межах норми.
ЕЕГ до проведення сугестивної психотерапії: групи не зовсім регулярного альфа-ритму амплітудою (А) до 30–35 мкВ чергуються з тета-комплексами А до 30–35 мкВ. D = S. При розплющуванні очей, дії світлових та звукових подразників альфа-ритм добре пригнічується в усіх відведеннях. У підкіркових відділах епізодично реєструються бета-групи А до 20 мкВ, зрідка пароксизмальні спайки. Окремі пароксизмальні спайки зрідка реєструються й у лобній ділянці лівої півкулі. Наприкінці гіпервентиляції в підкіркових відділах епізодично реєструються досить високоамплітудні тета-розряди А до 50 мкВ, зрідка 65 мкВ. Висновок: виявляються незначні дифузні зміни. У підкіркових відділах виявляються помітні ознаки подразнення, зрідка окремі пароксизмальні спайки. Рідко пароксизмальні спайки реєструються й у лобній ділянці лівої півкулі. Наприкінці гіпервентиляції у підкіркових відділах епізодично реєструються високоамплітудні тета-комплекси: виявляється помірне підвищення збудливості потенціалів у підкіркових відділах.
Шкала MMSE: 28 балів (порушення когнітивної функції не виявлено). Госпітальна шкала тривоги та депресії при надходженні — 10/11 балів (субклінічно виражена тривога, клінічно виражена депресія). Шкала Бека — 17 балів (помірна депресія).
Клінічний діагноз. Симптоматична вогнищева постінсультна епілепсія з нечастими (до 4 разів на рік) вторинно-генералізованими нападами. Цереброваскулярна хвороба: дисциркуляторна енцефалопатія ІІІ стадії. Наслідки перенесеного спонтанного субарахноїдального крововиливу (30.05.2006 р.), ішемічного інсульту в басейні правої середньої мозкової артерії (01.05.2008 р.) з формуванням післяінсультної лікворної кісти правої скронево-тім’яної ділянки. Лівобічний геміпарез.
З антиконвульсивною метою та для корекції тривожно-депресивного розладу проводилася сугестивна психотерапія. Проведено 8 сеансів по 40 хвилин кожний. Досягнута друга стадія глибини гіпнотичного сну. Після закінчення курсу СП відмічено помітне покращання самопочуття: відсутність внутрішнього напруження, повний регрес постійного болю голови, втомлюваності, підвищення настрою, життєвого тонусу, впевненості в собі, відновлення нічного сну.
ЕЕГ після проведення СП: групи не зовсім регулярного альфа-ритму амплітудою (А) до 30–40 мкВ епізодично чергуються з тета-комплексами А до 30–35 мкВ. D = S. При розплющуванні очей, дії світлових та звукових подразників альфа-ритм добре пригнічується в усіх відведеннях. У підкіркових відділах епізодично реєструються бета-групи А до 15–16 мкВ, під час гіпервентиляції зрідка А до 20 мкВ. Висновок: виявляються незначні дифузні зміни. У підкіркових відділах виявляються ознаки подразнення, які помітно зростають під час гіпервентиляції. Спостерігається явна позитивна динаміка порівняно з попередньою ЕЕГ.
Результати контрольного тестування при виписці хворого за госпітальною шкалою тривоги та депресії: тривоги та депресії не виявлено; за шкалою Бека 9 балів.
Хворий виписаний зі значним покращанням. В амбулаторних умовах рекомендовано продовжувати пероральну антиконвульсивну терапію вдвічі зменшеною дозою (200 мг/добу) з одночасним прийомом гопантенової кислоти (500–1000 мг/добу).
Висновки
1. Розуміння потенційних ускладнень, пов’язаних із використанням класичних антиконвульсантів, особливо важливе для неврологів та епілептологів, оскільки побічні дії розвиваються поступово й через кілька років стають необоротними.
2. Розроблений метод лікувальної психотерапевтичної сугестії спрямований на запобігання істинним нейронним розрядам, що супроводжуються парціальними конвульсіями. Із метою значного зменшення медикаментозного навантаження на організм пацієнта похилого віку в лікуванні післяінсультної епілепсії за допомогою певної послідовності навіювальних образів можна досягнути вибіркового гальмування епілептогенного вогнища в мозку хворих, які страждають від післяінсультної епілепсії.
3. Основними факторами ризику для розвитку післяінсультної епілепсії у хворих похилого віку є кіркова й кірково-підкіркова локалізація післяінсультних кіст середнього та малого розмірів, які локалізуються переважно в скронево-тім’яних ділянках головного мозку.
4. Післяінсультні зміни, що виявлені при КТ-дослідженні головного мозку, формують епілептогенні вогнища, які обумовлюють формування й розвиток епілептичних нападів. У клінічній картині післяінсультної епілепсії переважають складні парціальні напади.
5. Клінічна ефективність застосування антиконвульсивної сугестивної психотерапії поєднується з позитивними змінами на ЕЕГ у вигляді значного зменшення вираженості епілептиформної активності та зменшення індексу гострих та повільних хвиль.
6. Лікувальна сугестивна психотерапія впливає на когнітивну дисфункцію, депресивні й тривожні розлади та сприяє нівелюванню або значною мірою зменшенню їх проявів.
/70.jpg)

/69.jpg)