Статтю опубліковано на с. 101-104
Вступ
Судинні захворювання головного мозку залишаються однією з найгостріших медико-соціальних проблем, що завдають величезних економічних збитків суспільству. Особливе місце серед них посідає церебральний інсульт у зв’язку з високим рівнем летальності, значною інвалідизацією та соціальною дезадаптацією пацієнтів. В Україні щорічно реєструється 100–110 тис. інсультів, з них близько 35 % — у людей працездатного віку. При цьому виживає близько 70 % пацієнтів. Але у зв’язку з наявністю у них після виписки різного ступеня вираженості неврологічного дефіциту і/або, як наслідок, психоневрологічних розладів різного ступеня тільки 40–45 % здатні повернутися до колишнього способу життя, а понад 20 % відсотків потребують сторонньої допомоги [2–5].
Численні дослідження доводять, що корекція основних факторів ризику серцево-судинних захворювань, таких як артеріальна гіпертензія (АГ), гіперліпідемія, куріння, зловживання алкоголем, цукровий діабет, ожиріння, гіподинамія, дозволяє значно знизити частоту серцево-судинних ускладнень, зокрема ішемічного інсульту. Артеріальна гіпертензія є найважливішим незалежним модифікованим фактором ризику розвитку інсульту. У дослідженні HOT (The Hypertension Optimal Treatment Study, 1998 р.) продемонстрована важливість контролю артеріального тиску: так, зниження діастолічного артеріального тиску від вихідного рівня 105 мм рт.ст. до оптимального 83 мм рт.ст. супроводжувалося 30% зниженням частоти всіх серцево-судинних ускладнень [8,10].
Ще одним істотним фактором ризику інсульту є фібриляція передсердь (миготлива аритмія — МА), що супроводжується тромбоемболією мозкових артерій фрагментами тромбу з порожнин лівого передсердя або шлуночка серця. За даними 4 епідеміологічних досліджень, організованих у США, Японії, Ісландії та Англії (Framingham, Shibata, Reykjavik, Whitehall), відносний ризик ішемічного інсульту за наявності неклапанної МА зростає в середньому в 6 разів [6–8].
Виявлення і контроль факторів ризику розвитку інсульту, що коригуються, є найбільш реальною можливістю для зниження частоти розвитку ішемічного інсульту та інших судинних подій. За даними ВООЗ, існує понад 300 факторів ризику, пов’язаних з ішемічною хворобою серця та інсультом, проте для того, щоб фактор ризику був визнаний як значущий, він повинен з високою частотою зустрічатися в різних популяціях, незалежно впливати на етіологію та перебіг захворювання і, найважливіше, забезпечувати зменшення ризику розвитку захворювання при його усуненні [11].
З огляду на вищенаведені цифри й факти нагально необхідним постає патофізіологічно та патогенетично обґрунтований підхід до діагностики та корекції проявів цереброваскулярної патології з урахуванням коморбідності в кожному конкретному випадку. Розробка оптимальних варіантів комплексної діагностики стану судинного русла, динамічне спостереження за групами ризику, безумовно, у кінцевому результаті повинні сприяти суттєвому зниженню рівня даної патології серед населення й зменшенню рівня інвалідизації та смертності за рахунок підвищення ефективності лікування.
Методи і матеріали
Нами проведено обстеження 130 хворих з ішемічним інсультом півкульної локалізації. Першу групу становили 56 хворих, яким була проведена тромболітична терапія препаратом актилізе, другу — 74 хворі у гострому періоді ішемічного інсульту, які отримали звичайну інфузійну терапію. Для дослідження пацієнтів у гострому періоді ішемічного інсульту відбирали хворих з атеротромботичним (АТ) і кардіоемболічним (КЕ) варіантом, які надходили до стаціонару в перші 4,5 години з моменту розвитку захворювання. Хворі з іншою або невстановленою етіологією ішемічного інсульту були виключені з дослідження (табл. 1). Усього в групу спостереження потрапили 57 жінок та 73 чоловіки віком від 38 до 79 років (середній вік 64,0 ± 8,3 року).
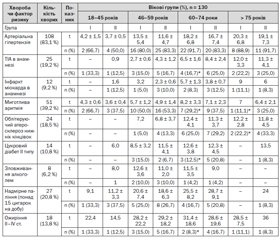
В основу поділу пацієнтів за віком лягли рекомендації ВООЗ, згідно з якими до молодих належать пацієнти віком від 18 до 45 років, середнього віку — 46–59 років, похилого віку — 60–74 роки, і старечого — 75 років і більше (табл. 1).
Переважна більшість обстежених хворих (75,4 %) були середнього (38,5 %) і похилого (36,9 %) віку. З них відповідно 30,6 % чоловіків і 23,5 % жінок перенесли АТ-варіант ішемічного інсульту, а 24,5 % чоловіків і 21,4 % жінок — кардіоемболічний.
Результати та їх обговорення
У 14 (25,0 %) пацієнтів І групи з АТ-генезом порушення мозкового кровообігу осередок ішемії локалізувався в басейні правої середньої мозкової артерії (СМА) і у 17 (30,3 %) випадках — у басейні лівої СМА. У пацієнтів ІІ групи — у 22 (29,7 %) і 19 (25,7 %) відповідно.
У 9 (16,1 %) хворих І групи з КЕ-варіантом ішемічного інсульту вогнище ішемії реєстрували в басейні правої СМА і у 16 (28,6 %) — у басейні лівої СМА. У пацієнтів ІІ групи — в 11 (14,9 %) і 18 (24,3 %) відповідно. У пацієнтів ІІ групи з КЕ-підтипом ішемічного інсульту в 4 (5,4 %) випадках реєструвались множинні інфаркти мозку.
Отже, у випадку АТ-підтипу інфаркту мозку статистично вірогідної різниці між групами в ураженні півкуль головного мозку виявлено не було, а у випадку КЕ підтипу більш часто спостерігалось ураження лівої півкулі головного мозку в обох групах.
Iз вогнищевих симптомів переважали рухові розлади (79 %) різного ступеня вираженості у вигляді значного геміпарезу (18 %), помірного геміпарезу (37 %), легкого гемі- або монопарезу (24 %). Розлади чутливості спостерігались у 66 % хворих. Координаторні порушення спостерігались у 12 % пацієнтів. Рідше виявлялись альтернуючі синдроми: Вебера — 4 хворі, Міяра — Гублера — 2 хворі.
Більшість хворих, за якими проводилося спостереження, мали різні терміни преморбідного стану чи фактори ризику (зловживання алкоголем, паління тощо) (табл. 2).
Тривалий час перед виникненням ішемічного інсульту пацієнти хворіли на різні варіанти серцево-судинних захворювань (АГ, інфаркт міокарда, порушення серцевого ритму, облітеруючий атеросклероз нижніх кінцівок), а, отже, власне інсульт був обумовлений попереднім станом організму. При цьому анамнестично визначено, що у 25 (19,2 %) хворих розвитку інсульту передували минущі порушення мозкового кровообігу (табл. 2).
У процесі дослідження в 130 хворих виявлена різна кардіальна патологія. Хвороби серця, діагностовані у хворих, були представлені нозологічними формами що наведені в табл. 3.
У структурі кардіальної патології превалювала ІХС — 79,2 % пацієнтів. Запальні й інфекційні захворювання були діагностовані в 3,1 % пацієнтів, штучний клапан серця був в 1,5 %. Уроджені вади серця спостерігалися у 2,3 % випадків, а пухлина серця — лише в 1 випадку (0,8 %).
Отже, АГ є провідним фактором ризику розвитку гострого порушення мозкового кровообігу за типом ішемії в пацієнтів обох груп, а її наявність не була протипоказанням до проведення тромболітичної терапії. Поєднання АГ з одним із додаткових факторів ризику (ішемічною хворобою серця, ТІА в анамнезі, цукровим діабетом, ожирінням, атеросклерозом тощо) значно підвищувало вірогідність розвитку гострого порушення мозкового кровообігу.
Отже, під час лікування АГ важливо контролювати не лише рівень артеріального тиску, але й деякі біохімічні показники — рівень глюкози, холестерину, коагулограму.
Емболія із серця в мозок, як і в інші органи, є незаперечним фактом, та не всі кардіогенні джерела емболії однаково небезпечні. Миготлива аритмія була найчастішою причиною кардіоемболічного інсульту: у 20 (80,0 %) пацієнтів І групи і 31 (93,9 %) пацієнта ІІ групи. Отримані дані підтверджують підвищений ризик розвитку ішемічного інсульту у хворих із постійним чи пароксизмальним порушеннями ритму серця та іншими кардіологічними захворюваннями. Однак питома вага пацієнтів похилого й старечого віку з миготливою аритмією в І групі (29,2 і 11,2 % відповідно) була нижчою порівняно з ІІ групою (37,5 і 25,0 %), що можна пояснити більш тяжким ураженням мозку в старших вікових групах. Це було обумовлено більш частою комбінацією кількох факторів ризику й тривалістю спостереження коморбідної патології в пацієнтів. Зловживання алкоголем, гіпертонія, патологія клапанного апарату серця, інфаркти серця й мозку в анамнезі були прогностичними чинниками більш тяжкого інсульту й повторної емболії судин мозку у пацієнтів з кардіоемболічним підтипом ішемічного інсульту.
При атеротромботичному підтипі інфаркту мозку особливого значення набувають фактори, що задіяні в механізмі формування атерогенної бляшки. Провідну роль тут відіграють рівень холестерину крові, ліпопротеїдів низької щільності, рівень артеріального тиску, генетична схильність тощо. У цілому ж якщо атероматозний процес торкнувся однієї судини, то має місце тенденція втягнення й багатьох інших артерій субклінічно та клінічно. Відповідно в таких хворих з ішемією мозку часто вже є або розвиваються стенокардія, інфаркт міокарда і переміжна кульгавість. Ці дані підтвердились отриманими нами результатами (табл. 2, 3). Розвиток атеротромботичного підтипу вірогідно корелював з частотою таких факторів, як артеріальна гіпертензія, облітеруючий атеросклероз нижніх кінцівок, ожиріння, і тривалістю преморбідного стану. Також у даних підгрупах з атеротромботичним підтипом реєструвалася висока кількість курців та осіб, які зловживають алкоголем.
Водночас ТІА в анамнезі, цукровий діабет ІІ типу, ожиріння ІІ–ІV cт. у пацієнтів похилого віку й облітеруючий атеросклероз нижніх кінцівок у пацієнтів старечого віку асоціювалися із збільшенням ускладнень при проведенні тромболітичної терапії, що привело до статистично вірогідного зменшення питомої ваги пацієнтів з окресленою коморбідністю в даних вікових групах у І групі порівняно з ІІ групою.
Отже, наведені дані дають підставу вважати, що своєчасна корекція факторів ризику дозволить значно зменшити частоту даної патології в популяції, а вибір методу лікування ішемічного інсульту повинен не тільки базуватись на лабораторно-інструментальних показниках і вивченні клінічної картини пацієнта, а й максимально враховувати коморбідні стани, вік пацієнта й основну природу захворювання.
Висновки
Результати досліджень підтверджують, що у виникненні інсульту велику роль відіграють фактори ризику. З урахуванням швидкого розвитку інсультної служби у світі й в Україні постає питання необхідності стандартизації надання невідкладної допомоги й вибору адекватної тактики лікування з урахуванням етіопатогенетичних механізмів розвитку інсульту. Рівень ускладнень при проведенні тромболітичної терапії на сьогодні залишається високим (ризик симптомних внутрішньомозкових крововиливів, за даними плацебо-контрольованого дослідження NINDS, становить близько 6,4 %), бажають кращого й такі показники, як рівень інвалідизації та смертності порівняно з традиційною терапією ішемічного інсульту [1, 10]. У сучасних протоколах проведення тромболітичної терапії основний акцент при відборі хворих роблять на клініко-нейровізуалізаційних показниках, однак, як бачимо, певний ресурс для покращення відбору хворих закладено також в уточненні коморбідної патології й тривалості її перебігу в різних вікових групах. Окрім цього, вчасне виявлення й корекція модифікованих факторів ризику розвитку ішемічного інсульту вкрай необхідні й повинні стати прерогативою сучасної ангіоневрології.
Список литературы
1. Скворцова В.И., Шамалов Н.А. Тромболитическая терапия при ишемическом инсульте // Consilium medicum. — 2010. — Т. 12, № 9. — С. 2-9.
2. Хобзей Н.К., Міщенко Т.С., Голик В.А., Ипатов А.В. Судинні захворювання головного мозку. — 2010. — № 4. — С. 2-6.
3. AHA/ASA Scientific Statement Guidelines for the Early Management of Patients With Ischemic Stroke 2005 Guidelines Update // Stroke. — 2005. — 36. — 916.
4. EROS Investigators. Incidence of stroke in Europe at the beginning of the 21st century // Stroke. — 2009. — 40. — 1557-1563.
5. Johnston S.C., Mendis S., Mathers C.D. Global variation in stroke burden and mortality: estimates from monitoring, surveillance, and modelling // Lancet Neurol. — 2009. — 8. — 345-354.
6. Lloyd-Jones D., Adams R.J., Brown T.M. et al. AHA Heart Disease and Stroke Statistics — 2010 update: a report from the American Heart Association // Circulation. — 2010. — 121. — e46-e215.
7. Ferri C.P., Sсhoenborn C., Kaira L. et al. Prevalence of stroke and related burden among older people living in Latin America, India and China // J. Neurol. Neurosurg. Psychiatry — 2011. — 82. — 1074-1082.
8. Roger et al. AHA Heart Disease and Stroke Statistics 2011 update: a report from the American Heart Association // Circulation. — 2011. — 123. — e18-e209.
9. Kolominsky-Rabas P.L., Weber M., Gefeller О., Neundoerfer В., Heuschmann P.U. Epidemiology of Ischemic Stroke Subtypes According to TOAST Criteria // Stroke. — 2001. — 12.
10. http://www.ecass.3.com
11. http://www.acutestroke.org

/102.jpg)
/103.jpg)
/104.jpg)