Статтю опубліковано на с. 98-102
Септичні стани залишаються однією з актуальних проблем сучасної медицини. Повідомляється про частоту захворюваності на тяжкий сепсис (ТС) серед немовлят у США 5,2 на 1000 [13]. В Україні в структурі дитячої смертності сепсис становить 12–15 % [3]. Імовірність летального кінця зростає відповідно до збільшення кількості уражених органів та категорії септичного стану (сепсис — ТС — септичний шок (СШ)), а летальність за різними оцінками коливається від 10 до 50,8 % [5, 6, 8, 13].
Одним з компонентів органних розладів при септичних станах є синдром гострого ушкодження легенів (СГУЛ) та гострий респіраторний дистрес-синдром (ГРДС), що супроводжуються ураженням легеневої гемодинаміки через дисбаланс між вазоконстрикторами та вазодилататорами (NO). Унаслідок цього відбувається збільшення індексу легеневого судинного опору (ІЛСО) [1, 2]. У дорослих встановлено залежність між фракцією викиду (ФВ) правого шлуночка й ІЛСО та результатом при септичних станах [9, 12]. Через бівентрикулярний механізм легенева гіпертензія (ЛГ) може зменшувати викид лівого шлуночка, підсилювати циркуляторну гіпоксію та бути важливим фактором пато- та танатогенезу при септичних станах [2, 12].
Для лікування ЛГ запропоновано використання вазодилататорів (нітрогліцерин, нітропрусид натрію, антагоністи кальцію, простагландини), що мають значну кількість несприятливих впливів, адже в терапевтичних дозах викликають тахікардію, гіпотонію, утворення метгемоглобіну, збільшують внутрішньолегеневе шунтування й підсилюють гіпоксію [1, 2, 4, 7, 10]. Інгаляція NO потребує дорогого устаткування та може бути використана лише у хворих на ШВЛ, тому вона не набула значного поширення [1, 2, 4, 7, 10]. Отже, проблема лікування ЛГ при септичних станах не має адекватного розв’язання. У зв’язку з цим викликає інтерес препарат аргініну для парентерального застосування, що є донатором NO. Проте дані щодо його застосування при лікуванні ЛГ на тлі сепсису в дітей дотепер відсутні.
Отже, метою дослідження стало вивчення легеневої гемодинаміки та окремих регуляторів судинного тонусу в дітей із сепсисом та визначення впливу розчину аргініну гідрохлориду на вміст вазоактивних медіаторів у сироватці та стан центральної й легеневої гемодинаміки в дітей із ЛГ при СГУЛ/ГРДС на тлі сепсису.
Матеріали та методи
Дизайн дослідження — одноцентрове проспективне рандомізоване порівняльне дослідження. Критерії включення: наявність сепсису, ТС, СШ, перебіг яких ускладнився розвитком ЛГ (середній артеріальний тиск у легеневій артерії (САТ ЛА) понад 25 мм рт.ст.). Критерії виключення: вроджені захворювання серця, легень та ідіопатична ЛГ. Дослідження проведено протягом 5 років у 26 дітей віком від 1 міс. до 16 років, які знаходились на лікуванні у відділенні анестезіології та інтенсивної терапії КЗОЗ «Харківська обласна дитяча інфекційна клінічна лікарня» із септичними станами (13 пацієнтів із сепсисом, 7 пацієнтів із ТС та 6 — із СШ), діагноз яких встановлювався відповідно до критеріїв консенсусу SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference (2001). Досліджувана група хворих (група А) додатково до етіотропної й патогенетичної терапії (інотропи, дезагреганти, гепарин, респіраторна терапія) отримувала внутрішньовенну інфузію 4,2% розчину аргініну гідрохлориду в дозі 5 мл/кг/добу за допомогою інфузомату протягом 1–2 діб. Контрольна група хворих (група К) отримувала аналогічну етіотропну та патогенетичну терапію за винятком аргініну гідрохлориду.
Тяжкість стану оцінювалась за допомогою шкал SOFA та PRISM, тяжкість СГУЛ/ГРДС — за шкалою Murrey, ураження центральної нервової системи — за шкалою Glasgow. Моніторне спостереження за пацієнтами включало реєстрацію частоти серцевих скорочень (ЧСС), пульсоксиметрію, вимірювання середнього артеріального тиску (САТ) (монітори UM-300). До початку лікування та за 24–48 год всім хворим проводилась ехокардіоскопія у М-режимі та імпульсно-хвильове допплерівське сканування кровотоку в легеневій артерії за допомогою ультразвукового сканера Ultima PA. Вимірювались кінцево-діастолічний (КДР) та кінцево-систолічний (КСР) розміри лівого шлуночка. На підставі отриманих даних за формулою L. Teichholz et al. (1976) проводився розрахунок індексів кінцево-систолічного (ІКСО) та кінцево-діастолічного об’ємів (ІКДО) лівого шлуночка, ударного індексу (УІ), фракції викиду (ФВ), серцевого індексу (СІ). САТ ЛА вимірювався за А. Kitabatake et al. (1983). Центральний венозний тиск (ЦВТ) вимірювався у верхній порожнистій вені за методом Вальдмана. ІЛСО визначався за формулою: ІЛСО = 80 • (САТ ЛА, мм рт.ст. – ЦВТ, мм рт.ст.)/СІ. Також до й після інфузії проводилось визначення електролітів плазми (Na+, K+, Cl– i Ca++) аналізатором AVL-998-4. Показники кислотно-основного стану (КОС) і газів артеріальної та центральної венозної крові (рО2, рСО2, SaO2, СаО2, рН, НСО3–, ВЕ, ВВ) визначались за допомогою аналізаторів AVL-995 та Gastat-mini. Рівень гемоглобіну (Нb) визначався колориметричним методом. Доставка кисню (DO2) визначалась за формулою DO2 = СІ × СaO2; споживання кисню (VO2) — за формулою VO2 = СІ • (СaO2 – СvO2); індекс тканинної екстракції кисню (ITО2) — за формулою ITО2 = DO2/VO2. Креатинін крові оцінювався за методом Яффе. Рівень глікемії визначався аналізатором «Ексан-Г». Концентрація альдостерону в плазмі визначалась за формулою: альдостерон (пг/мл) = 1407,53 – 20,55 • Na+ + 0,08 • Na+2 (Корячкин В.А. и співавт., 2001). Концентрацію С-реактивного протеїну визначали імуноферментним методом (ELISA-test, СRP EIA KIT, США). Концентрацію МВ-ізоформи креатинфосфокінази (КФК-МВ), лактатдегідрогенази (ЛДГ) визначали біохімічним методом наборами CK MB та LDH 30 Liquick Cor (Cormay, Польща). Уміст лактату крові визначали ензиматичним методом — «Ольвекс диагностикум» (Росія). Уміст NO сироватки оцінювався за кінцевими метаболітами (нітрити/нітрати) колориметричним методом за допомогою реактиву Гриса у центральній науково-дослідній лабораторії Харківського національного медичного університету. Для аналізу результатів створено базу даних у програмі Statistica 6. Вірогідність відмінностей між групами визначалась за допомогою критерію t (Стьюдента). Вірогідність відмінностей між показниками до і після початку лікування визначалась за допомогою непараметричного критерію W (Вілкоксона).
Результати та їх обговорення
Досліджувані групи пацієнтів за віком, антропометричними характеристиками не мали вірогідних відмінностей (p > 0,05) (табл. 1).
Хворі досліджуваних груп характеризувалися наявністю клініко-лабораторних ознак системної запальної відповіді у вигляді лейкоцитозу, омолодження лейкоцитарної формули, підвищення температури тіла та збільшення рівня С-реактивного протеїну плазми, що в нормі не повинен перевищувати 6 мг/л. Вірогідних відмінностей за цими показниками між хворими групи А та групи К не було (табл. 2).
Як свідчать дані, наведені в табл. 3, у хворих груп А та К були ознаки поліорганних розладів, збільшення рівня лактату, ферментів лактатдегідрогенази та КФК-МВ, рівня сумарних метаболітів оксиду азоту NO2/NO3 та альдостерону.
Отже, мали місце тканинна гіпоксія, ушкодження міокарда, розлади регуляції судинного тонусу та гіперальдостеронізм, що міг бути зумовлений як гіповолемією, так і безпосереднім ушкодженням легень. Також відзначалось збільшення рівня азотистих шлаків, що свідчило про погіршення ниркової функції. Тахіпное та оцінка за шкалою Murrey дали змогу характеризувати дихальні розлади як помірний ГРДС. Розлади центральної нервової системи відповідали сопору. За цими показниками, а також за рівнем органних розладів, що було оцінено за шкалами PRISM та SOFA, групи між собою вірогідно не відрізнялись (p > 0,05) (табл. 3).
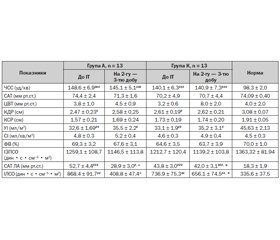
До початку лікування пацієнти досліджуваної та контрольної груп характеризувались гіповолемією, зниженим УІ лівого шлуночка та нормальним СІ за рахунок значної тахікардії. За цими показниками вони вірогідно відрізнялись від норми (табл. 4). Ці розлади поєднувались із вірогідним підвищення САТ у легеневій артерії та ІЛСО. За показниками гемодинаміки досліджувана та контрольна групи до початку лікування між собою вірогідно не відрізнялися. При повторному дослідженні показників гемодинаміки, що здійснювалося після завершення інфузії аргініну на 2-гу — 3-тю добу інтенсивної терапії, у групі А відбувалось вірогідне зниження рівня САТ ЛА з 52,7 ± 4,4 мм рт.ст. до 28,9 ± 3,0 мм рт.ст. (W = 79, p = 0,022) та ІЛСО з 868,4 ± 91,7 дин • с • см–5 • м2 до 408,8 ± 47,4 дин • с • см–5 • м2 (W = 79, p = 0,022). Інші показники центральної та периферичної гемодинаміки у досліджуваних групах не зазнавали вірогідних змін та не відрізнялись між групами (p > 0,05) (табл. 4).
До початку лікування рівні сумарних метаболітів та нітритів/нітратів окремо, так само як і рівень альдостерону, між досліджуваними групами не мали вірогідних відмінностей (p > 0,05) (табл. 5). На 2-гу — 3-тю добу лікування у групі А відбувалось вірогідне зростання рівня сумарних метаболітів NO, переважно за рахунок нітратів (W = 32, p = 0,024). Натомість у групі К вірогідних змін рівня сумарних метаболітів NO та нітритів/нітратів не спостерігалось (W = 12, p > 0,05). Також у групі К на 2-гу — 3-тю добу рівень альдостерону вірогідно перевищував рівень альдостерону у групі А (p < 0,05) (табл. 5).
/101.jpg)
Рівень Na+ у групі А був вірогідно нижчим, ніж у групі К (p < 0,05). Під впливом лікування показники електролітів сироватки у групі А не зазнавали суттєвих змін, за винятком рівня калію, що вірогідно знижувався (p < 0,05), але залишався у межах норми. У групі К у динаміці тривало вірогідне зростання натрію до 156,5 ± 2,68 ммоль/л (W = 79, p = 0,022) та хлоридів до 113,7 ± 0,3 ммоль/л, що ставали вірогідно більшими за показники у групі А (р < 0,05) та (р < 0,001) відповідно (табл. 6).
Незважаючи на здатність аргініну усувати алкалоз та сприяти розвитку метаболічного ацидозу в зазначених дозах, ми не спостерігали подібного ефекту. Навпаки, під впливом лікування в групі А відмічалось зменшення вираженості метаболічного ацидозу, що, імовірно, можна пояснити зменшенням гіпоксії та покращенням тканинної перфузії завдяки вазодилатуючому впливу. Натомість у групі К існувала протилежна тенденція до розвитку метаболічного ацидозу (табл. 6). Також важливо підкреслити, що у групі А відбувалось збільшення показника SaO2 з 93,46 ± 1,10 % до 98,15 ± 0,32 % (W = 65, p = 0,022), а у групі К, навпаки, зменшення до вірогідно нижчого показника, ніж у групі А, — 93,75 ± 2,07 % (p < 0,05). Уміст кисню у артеріальній крові у групі А протягом лікування не змінювався, а у групі К на 2-гу — 3-тю добу ставав вірогідно нижчим, ніж у групі А, — 113,58 ± 7,42 мл (p < 0,05). Хотілось би також звернути увагу на вірогідно менший показник DO2 у групі К (534,6 ± 40,34 мл/хв/м2)
порівняно із групою А (699,2 ± 49,1 мл/хв/м2) на 2-гу — 3-тю добу лікування (p < 0,05) (табл. 6).
У групі А рівень глюкози знизився з 5,36 ± 0,36 ммоль/л до 4,61 ± 0,30 ммоль/л (p < 0,05), що є позитивним зрушенням для хворих у септичному стані. Епізодів гіпоглікемії ми не спостерігали. У групі А летальних випадків не було, у групі К померло 3 хворих (23,1 %).
Висновки
1. Незважаючи на збільшення рівня NO, у дітей при септичних станах розвивається виражена ЛГ.
2. ЛГ поєднується із розладами гемодинаміки у великому колі кровообігу та, незважаючи на збереження високого СІ, супроводжується ознаками тканинної гіпоксії, про що свідчить підвищення рівнів лактату та ЛДГ сироватки.
3. Інфузія аргініну гідрохлориду дозою 5 мл/кг/добу у дітей із сепсисом здатна ефективно усувати ЛГ.
4. У зазначених дозах аргініну гідрохлорид сприяє нормалізації показників кисневого транспорту та КОС, нормалізує гіперглікемію.
5. У дітей із сепсисом інфузія аргініну гідрохлориду дозою 5 мл/кг/добу, незважаючи на збільшення рівня сумарних метаболітів NO, не чинить несприятливого впливу на системну гемодинаміку.
Список литературы
1. Pulmonary vascular dysfunction in ARDS / D. Ryan, S. Frohlich, Paul McLoughlin [et al.] // Annals of Intensive Care — 2014. — Vol. 4. — 28. — http://www.annalsofintensivecare.com/content/4/1/28
2. Pulmonary vascular and right ventricular dysfunction in adult critical care: current and emerging options for management: a systematic literature review / L. Price1, S. Wort, S. Finney [et al.] // Critical Care. — 2010. — Vol. 14. — R169.
3. Крамарєв С.О., Євтушенко В.В., Волошина О.О., Закордонець Л.В. Оцінка емпіричної антибіотикотерапії гнійних менінгітів у дітей: Мат-ли науково-практичної конференції і пленуму Асоціації інфекціоністів України «Нейроінфекції. Інші інфекційні хвороби». — Харків, 2001. — C. 87-89.
4 Beghetti M. Pediatric pulmonary hypertension: monitoring progress and identifying unmet needs // European Respiratory Review. — 2009. — Vol. 18. — P. 18-23.
5. Cumulative influence of organ dysfunction and septic state on mortality of critically ill children / Leclerc F., Leteurtre S., Duhamel A. // Am. J. of Resp. and Crit. Care Med. — 2005. — Vol. 171. — P. 348-353.
6. Emergency management of children with severe sepsis in the United Kingdom — the results of Paediatric Intensive Care Society sepsis audit / Inwald D.P., Tasker R., Peters M.J. et al. // Arch. Dis. Child. — 2009. — № 1. — P. 168-176.
7. Galiè N., Manes A., Branzi A. The new clinical trials on pharmacological treatment in pulmonary hypertension // Eur. Respir. J. — 2002. — Vol. 20. — P. 1037-1049.
8. Folafoluwa O. Patient and hospital correlates of clinical outcomes and resource utilization in severe pediatric sepsis // Pediatrics. — 2007. — Vol. 119. — P. 487-494.
9. Hemodynamic instability in sepsis. Bedside assessment by doppler echocardiography / A. Vieillard-Baron, S. Prin, K. Chergui [et al.] // Am. J. of Respiratory and Crit. Care Med. — 2003. — Vol. 168. — P. 1270-1276.
10. Moloney E.D., Evans T.W. Pathophysiology and pharmacological treatment of pulmonary respiratory distress syndrome // Eur. Respir. J. — 2003. — Vol. 21. — P. 720-727.
11. Mortality rates in pediatric septic shock with and without multiple organ system failure / Kutko M.C., Calarco M.P., Flaherty M.B. et al. // Pediatric Crit. Care Med. — 2003. — № 4. — P. 333-337.
12. Right ventricular function of patients with septic shock: clinical significance / D. Liu, B. Du, Y. Long [et al.] // Zhonghua Wai Ke Za Zhi. — 2000. — № 7. — P. 488-492.
13. The Epidemiology of Severe Sepsis in Children in the United States / Watson R.S., Carcillo J.A., Linde-Zwirble W.T. et al. // Am. J. of Resp. and Critical. Care Med. — 2003. — Vol. 167. — P. 695-701.

/100.jpg)
/101.jpg)