Статья опубликована на с. 64-73
Определение
Спинальная анестезия (СА) — вид местной центральной нейроаксиальной анестезии, при котором анестетик в процессе люмбальной пункции вводится в субарахноидальное пространство, а блокирование передачи импульса происходит на уровне корешков спинномозговых нервов [40, 43].
Нередко применяемое определение «спинномозговая анестезия», на наш взгляд, может быть употреблено только в том смысле, что анестетик вводится в спинномозговое пространство, и, таким образом, некорректно, поскольку дезориентирует в сути метода.
Из истории
Спинальная анестезия в том виде, в котором она используется сейчас, была впервые выполнена Августом Биром 16 августа 1897 года при операции резекции голеностопного сустава по поводу его туберкулезного поражения. Анестетиком стал широко применявшийся тогда кокаин. А. Бир и его ученик А. Гильдебрандт лично на себе испытали действие нового метода анестезии. В дальнейшем новый метод обезболивания привлек к себе внимание хирургов, и очень многие стали его широко применять в своей практике. Здесь следует упомянуть Т. Тюффье, Я.Б. Зельдовича, С.С. Юдина. В акушерской практике спинальную анестезию с целью обезболивания родов впервые применил О. Крайс в 1900 году [40, 41]. В 1900 году Я.В. Зильберберг в Одессе первым применяет СА [37]. В 1915 году в Петрограде В.Ф. Войно-Ясенецким издана одна из первых в Российской империи монография «Регионарная анестезия» (типография Collins), удостоенная премии Варшавского университета [38]. Широкому внедрению спинальной анестезии на территории СССР способствовал основатель и первый заведующий отделом анестезиологии и ИТ Харьковского института травматологии и ортопедии (ныне ГУ «Институт патологии позвоночника и суставов НАМН Украины») А.Ю. Пащук: его монография «Регионарное обезболивание» [3] по праву считалась одним из лучших руководств своего времени и во многих аспектах не потеряла актуальности до сих пор.
В 1970-х годах осознание того, что дети чувствуют боль, привело к возобновлению интереса к педиатрической регионарной анестезии (РА) с пониманием, что РА может быть дополнением к общей анестезии. Но спинальная анестезия набрала популярность после 1984 года, когда она была введена в качестве альтернативы общей анестезии высокого риска у недоношенных новорожденных для снижения частоты послеоперационных апноэ и брадикардии [6]. С тех пор спинальная анестезия стала проверенным стандартом для новорожденных с высоким риском летальности [23, 58, 86, 87]. Безопасность СА была продемонстрирована в 1,5 тыс. наблюдений у младенцев, в том числе недоношенных, и мотивировала использование этой анестезии у всех младенцев при вмешательствах на нижнем этаже брюшной полости или нижних конечностях [87]. Ее эффективность и безопасность также установлены у более старших детей [2, 44, 47, 48, 67].
Несколько экспериментальных исследований на животных вызвали опасения относительно восприимчивости развивающегося мозга к некоторым общим анестетикам, ведущей к функциональным и поведенческим нарушениям [63]. Возможность повреждения анестетиками клеток мозга человека до сих пор не доказана. Но такие вопросы могут склонить детского анестезиолога к выбору регионарных методов анестезии, особенно у детей младшей возрастной группы, так как у них происходит быстрое развитие мозга.
Отметим, что в более 30 % приведенных ниже зарубежных источников в той или иной форме указывали на получение информированного согласия на выполнение СА, а в случае педиатрической анестезиологии — более чем в 50 %, и в настоящее время оно считается абсолютно необходимым.
Анатомия
По наблюдению van Schoor и соавт., у новорожденных и младенцев спинной мозг заканчивается на уровне L2–L3, у детей — на уровне T12–L1 и нижней трети L1, у подростков — на уровне средней трети L1 и L1–L2, а у молодых взрослых спинной мозг заканчивается на уровне L1–L2. Спинной мозг не располагался каудальнее тела позвонка L3 [2, 4, 77]. Тем не менее у новорожденных или младенцев авторы рекомендуют определить точный уровень края спинного мозга до выполнения манипуляций. Такая рекомендация, на наш взгляд, не бесспорна, так как для выполнения магнитно-резонансной томографии (МРТ) у этой категории пациентов требуется существенная медикаментозная седация, как уже упоминалось, часто рискованная у пациентов с соматической патологией.
Испанские исследователи, пытаясь соотнести объем спинномозговой жидкости и объем, занимаемый корешками спинного мозга, с частотой травм корешков при выполнении спинальной пункции и анестезии, провели МРТ у 7 пациентов. Упомянутые объемы рассчитывались в полуавтоматическом режиме в сочетании с ручным редактированием каждого слоя. Объем корешков по отношению ко всему объему дурального мешка на уровне Th12 составил 30–43 %, на уровне L4 — около 25 %, а на уровне L5 — от 7 до 14 % [66].
Ожирение, как правило, осложняет выполнение СА. В г. Мюнстере, Германия, Wenk и соавт., пронаблюдав 154 взрослых пациента, пришли к выводу, что индекс массы тела ≥ 32 связан с большей длительностью выполнения спинальной пункции и, при выполнении стажерами, почти 50 % случаев с получением крови при пункции, а в 41,3 % случаев — с неудачной пункцией [83]. Логично предположить, что у детей будет наблюдаться подобная закономерность, но подобных исследований в отношении детей нами не найдено.
Существенным подспорьем в выполнении СА в настоящее время признается ультразвуковая локация. У ортопедических больных выполнение люмбальной пункции затруднено из-за хронических ортопедических заболеваний, хронической боли, избыточного веса или трудностей с размещением из-за внешних опор фиксирующих конструкций. При предоперационном обследовании 122 пациентов у 78 из них (64 %) было обнаружено несоответствие между традиционным методом определения межпозвонковых пространств по анатомическим ориентирам и с помощью ультразвукового исследования (УЗИ). Между «правильной» и «ошибочной» группами не было статистически значимых различий по демографическим данным (пол, возраст, рост, вес или индекс массы тела), размещению пациента или выбранному для пункции уровню. Единственное статистически значимое различие заключалось в годах опыта анестезиолога, осуществляющего клиническую оценку и манипуляцию [22]. На отличные результаты применения УЗ-локации при выполнении СА у детей также указывает Н. Tirmizi (2015) [74].
Для оказания помощи в обучении использования ультразвука в региональной анестезии в поясничном отделе позвоночника разработана интерактивная образовательная модель [39, 42].
Анатомические и физиологические различия между взрослыми и новорожденными
1. Дуральный мешок у новорожденных оканчивается на уровне S3, а спинной мозг — на уровне L3 и не достигают «взрослых» S2 и L1 соответственно до 2-го года жизни. Таким образом, целесообразно использовать низкий доступ (L4–L5 или L5–S1) для предупреждения травмирования спинного мозга [4, 29]. Межоститстая линия (линия Тюффье) служит надежным ориентиром у детей так же, как и у новорожденных, проходя через L4–L5/L5–S1. Субарахноидальное пространство у новорожденных ýже (6–8 мм), а давление спинномозговой жидкости ниже, что требует более аккуратного исполнения и избегания латерального отклонения иглы.
2. Детям требуется более высокая доза местного анестетика, во-первых, из-за более высокого соотношения спинномозговой жидкости и массы тела: 10 мл/кг у новорожденных, 4 мл/кг у детей, 2 мл/кг у взрослых, и, во-вторых, бóльших объемов вертебральной спинномозговой жидкости: 50 % у детей и 33 % у взрослых [36, 56].
3. Более выраженная васкуляризация мягкой мозговой оболочки и бóльший сердечный выброс приводят к ускоренной абсорбции местного анестетика и меньшей продолжительности блока у детей и объясняют продление анестезии на 30 % добавлением адреналина, чего не наблюдается у взрослых [6].
4. У детей более рыхлый эндоневрий, и диффузия анестетика проходит легче, что объясняет быстрое начало и окончание блока [29].
5. Связки мягче, и ощущение утраты сопротивления слабее. Грудной кифоз менее выражен из-за бóльшей гибкости позвоночника, что облегчает краниальное распространение анестетика и бóльшую выраженность сенсорного блока [1, 20]. Парамедианный доступ не рекомендован из-за меньшего окостенения позвоночных отростков.
6. Депрессия гемодинамики у детей менее выражена из-за меньшего объема периферической крови, незрелости симпатической вегетативной системы и меньшей эфферентной активности блуждающего нерва [20]. Таким образом, преднагрузка не требуется. У детей младше 5 лет способность к вазодилатации меньше, чем у детей старшего возраста и взрослых, а на высокий уровень анестезии они реагируют выключением парасимпатического воздействия n.vagus на сердце [1].
7. Высокие уровни блока (T2–Т4) снижают движение нижней части грудной клетки, межреберные мышцы снижают активность, что может привести к парадоксальным дыхательным движениям у детей. Однако в большинстве случаев эти проявления компенсирует диафрагма [64].
Субарахноидальный блок у детей
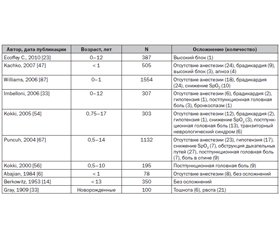
Некоторые из показаний к применению СА у детей обобщены в табл. 1. Противопоказания к выполнению спинальной анестезии у детей аналогичны таковым у взрослых.
Спинальные иглы, препараты, дозировки
Мы нашли описания различных типов спинальных игл. Отличия были в длине, калибре (gauge), типе острия (Квинке/карандашные (pencil point)), длине среза (длинный/короткий), наличии/отсутствии стилета. Длина педиатрических спинальных игл варьируется от 25 до 50 мм (25–30 мм для новорожденных и 50 мм для детей) [56]. Также нередко применяются «взрослые» иглы длиной 90 мм [34, 49, 51, 67]. Укороченная «педиатрическая» игла дает бóльшую точность в движениях, изгинается, не ломаясь, в случае движений пациента, обладает меньшим «мертвым пространством». Короткий срез у игл Квинке и конус у игл pencil point позволяют лучше оценить сопротивления тканей и уменьшают шанс неполной инъекции препарата. Ранние попытки применять для спинальной пункции стилеты внутривенных катетеров или иглы для подкожных инъекций признаны неприемлемыми, так как их применение вело к заносу клеток кожи и формированию субдуральной эпидермоидной опухоли [71]. Kokki с соавт. сравнили иглы G25 и G29 и пришли к выводу предпочтительного применения игл малого диаметра [51]. Для введения малых объемов лучше использовать шприцы объемом 1 мл. Тип иглы не влиял на качество анестезии [49, 54].
Во многих странах изобарические и гипербарические бупивакаин и тетракаин (0,5%) остаются наиболее популярными препаратами. Хорошую безопасность и эффективность также показали L-бупивакаин и ропивакаин. Последний в концентрации 0,5% был применен у детей 1–17 лет в дозе 0,5 мг/кг. Длительность моторного блока была значительно ниже, чем у эквипотентных доз других препаратов. Левобупивакаин 0,5% в дозе 0,3 мг/кг показал свою эффективность в исследовании у детей 1–14 лет [55]. Frawley с соавт. обнаружили, что у новорожденных 1 мг/кг изобарического 0,5% бупивакаина и ропивакаина эквипотентны 1,02 мг/кг левобупивакаина. Однако столь высокие дозы могут быть нейротоксичными [27].
У детей до 1 года для восстановления двигательной активности требуется всего 20 % времени, необходимого взрослым [1]. Дозы местных анестетиков обратно коррелируют с массой тела (табл. 2). Лидокаин перестали применять из-за невысокой продолжительности действия и сообщений о неврологических осложнениях у взрослых. Баричность местного анестетика в работе H. Kokki и соавт. сочтена не столь важной, поскольку не влияла на характеристики блока [53].
Поскольку СА у детей короче, чем у взрослых, многими авторами исследовались адъювантные препараты, такие как адреналин, морфин, фентанил, клонидин, неостигмин (табл. 3). Добавление адреналина к местному анестетику снижает общую дозу, увеличивает безопасность и пролонгирует анестезию (до 30 %), но и увеличивает риск ишемических повреждений нервной ткани [32]. Дексмедетомидин (дексдор), высокоселективный агонист α2-адренорецепторов, применялся у детей как адъювант в эпидуральной анестезии, но не интратекально.
/67.jpg)
В сравнительном исследовании влияния вводимых интратекально клонидина и дексмедетомидина у взрослых 150 пациентов были разделены на 3 равные группы [70]. Добавление к бупивакаину небольшой дозы дексмедетомидина (5 мкг) или клонидина (50 мкг) сокращает начало моторного и сенсорного блока и значительно пролонгирует их. Средняя продолжительность анестезии с бупивакаином составила 204,80 ± 16,81 мин, с клонидином — 309,60 ± 50,99 мин, с дексмедетомидином — 336,80 ± 55,38 мин. Распространенность, длительность и выраженность моторного и сенсорного блоков коррелировали с побочными эффектами. Несмотря на впечатляющие результаты, высокая стоимость декcмедетомидина, по-видимому, станет одним из сдерживающих факторов его широкого использования.
Не исключается потенциальная токсичность для спинного мозга на ранних этапах субдурального распространения многих препаратов, несмотря на их потенциальную безопасность. Кроме того, младшие дети не способны сообщить о своих ощущениях, что грозит запаздыванием в диагностике возможных осложнений. Поэтому следует использовать препараты с хорошо документированным профилем безопасности с широким терапевтическим диапазоном [81].
Предоперационная подготовка и премедикация
Дети боятся разлуки с родителями, боли, иголок. Очень важно четко объяснить родителям и старшим детям преимущества СА [29]. Им нужно детально рассказать методику анестезии. Следует получить информированное согласие от родителей и прямое согласие от старших детей [54].
Местноанестезирующий крем (EMLA) наносится на зоны люмбальной пункции и катетеризации вен не менее чем за 1 час до прибытия в операционную. Крем не разрешен недоношенным новорожденным (< 37 недель) [54]. Хорошая анестезия кожи позволяет обойтись у некоторых детей без седации. В связи с риском апноэ не рекомендуется седация у недоношенных новорожденных. У младших детей непонимание происходящего до некоторой степени защищает от страха, тогда как детям постарше премедикация необходима для облегчения расставания с родителями, катетеризации периферической вены и выполнения спинальной анестезии. Для седации и устранения страха чаще всего применяются сибазон или мидазолам, промедол, кетамин в сочетании с атропином per os, ректально или внутримышечно. Прекрасную седацию дает ректальное введение атропина (0,02 мг/кг) и мидазолама (0,6 мг/кг) за 15 мин до начала манипуляций [67].
Седация
Попытка выполнить спинальную пункцию испуганному, сопротивляющемуся ребенку может закончиться травмированием нежных сосудистых и нервных образований. В большинстве случаев для дополнительной седации применяют кетамин, сибазон, мидазолам, тиопентал, пропофол, севофлюран или закись азота [48, 72]. Младенца можно успокоить пустышкой, смоченной в сладкой воде [56]. Доказательств высокого риска неврологических осложнений при СА у седированных детей не имеется. Наоборот, многие национальные анестезиологические общества приняли стандартом выполнение регионарных блоков в условиях общей анестезии [23]. Это исследование подтвердило малое количество осложнений регионарной анестезии: 96 % блоков выполнялись под общей анестезией или глубокой седацией. Интраоперационная седация при успешной регионарной анестезии требуется не всегда, поскольку деафферентация сама по себе вызывает седацию, что было доказано исследованием биспектрального индекса у младенцев под СА [35]. Для предотвращения нарушения стерильности хирургической зоны можно использовать мягкие свободные ремни для запястий. В некоторых случаях старшие дети предпочитают оставаться в сознании, слушая музыку или глядя мультфильмы.
Техника
Обычно СА выполняется в положении пациента лежа на боку с согнутой спиной, с головой, приведенной к груди, и ногами, приведенными к животу. У новорожденных и младенцев сгибание должно быть осторожным: возможны обструкция дыхательных путей и развитие гипоксии [31]. Приемлемы как положение лежа на боку, так и положение сидя. Для увеличения давления ликвора у новорожденных рекомендуется поднять головной край стола на 45° [60]. Деформация позвоночника осложняет выполнение спинальной пункции. В зависимости от возраста изменяется глубина введения иглы: 10–15 мм — у новорожденных, 15–25 мм — у детей до 5 лет, 30–40 мм — у детей 5–8 лет. Расстояние от кожи до субарахноидального пространства может быть рассчитано по формуле: рост × 0,03 или 2 × вес + 7 [10].
Все чаще при выполнении нейроаксиальных блокад используется ультразвуковая локация. В педиатрической анестезиологии она в основном применяется для выполнения эпидуральной анестезии. Слабое окостенение элементов позвоночника у младенцев до 6 месяцев улучшает возможности ультразвуковой визуализации [10]. Значительное улучшение результатов СА при выполнении ее под контролем УЗИ также подтверждает Tirmizi [74]. Поступление спинномозговой жидкости в иглу определяет правильность выполнения пункции. Местный анестетик рекомендуется вводить не менее 20 секунд [90]. Поскольку объем вводимого анестетика невелик, следует учитывать также и объем «мертвого пространства» иглы и носик шприца. При использовании гипербарического раствора важно не поднять нижние конечности для предупреждения развития тотального спинального блока. Неврологические осложнения могут быть предупреждены использованием соответственного объема препарата, уровня пункции, контролем свободного тока ликвора в игле перед введением анестетика и исключением применения микрокатетеров.
Некоторые анестезиологи ратуют за катетеризацию вен нижних конечностей после выполнения спинальной анестезии, поскольку у детей отсутствует снижение артериального давления после спинальной анестезии. Однако катетеризация вены до выполнения анестезии повышает безопасность пациента. Для уменьшения беспокойства ребенка во время операции можно наложить датчик пульсоксиметра и манжету тонометра на нижние конечности [54].
Оценка качества анестезии у детей
У старших детей вне седации можно использовать те же методы оценки качества блока, что и у взрослых: укол иглой, щипок пальцами или инструментом, касание льдом [69]. У детей под общей анестезией или в седации отсутствие движений конечности свидетельствует о надежной анестезии.
Примечательным следует считать то, что по сравнению с общей анестезией СА гарантированно защищает пациентов от боли, что подтверждается результатами монитора ноцицепции и аналгезии, analgesia nociception index (ANI) [5].
Преимущества спинальной анестезии
1. СА является дешевой альтернативой в странах с ограниченными ресурсами в связи с быстрым восстановлением и снижением пребывания в больнице. Imbelloni и соавт. зафиксировали снижение стоимости на 54 % (49 долл. по сравнению с общей анестезией — 105 долл.) [44]. Кокки с соавт. продемонстрировали более высокую скорость оборота пациента в операционной, что также снижает расходы [50]. Здесь следует обратить внимание на то, что в большинстве зарубежных клиник начало анестезии происходит вне операционной.
2. СА демонстрирует все компоненты сбалансированной анестезии с минимумом случаев кардиореспираторных нарушений и послеоперационной тошноты и рвоты, быстрым восстановлением аппетита и возможностью ранней активизации пациентов.
3. СА позволяет избежать интубации трахеи и негативных респираторных явлений, связанных с общей анестезией и внутривенным введением опиоидов у пациентов высокого риска (с подсвязочным стенозом, ларинготрахеомаляцией, проблемами дыхательных путей, мышечной дистрофией, гиперреактивностью дыхательных путей, буллезным эпидермолизом) [9, 19, 56, 61, 88].
4. СА эффективнее общей и эпидуральной анестезии в снижении нейроэндокринного стресса и побочных явлений, связанных с хирургической агрессией [89]. В ходе больших оперативных вмешательств в условиях СА у новорожденных и младенцев концентрация в плазме адреналина, норадреналина, лактата и интерлейкина-6 была меньше, чем при общей анестезии.
5. У пациентов с высоким риском развития злокачественной гипертермии предпочтение следует отдать аминоамидным местным анестетикам, к которым относится и бупивакаин [56]. Эта же методика является альтернативой для больных с высоким риском общей анестезии и респираторной патологией.
6. Исследования на животных поставили вопрос о безопасности общей анестезии для формирующихся структур мозга, что особенно важно у новорожденных и младенцев [63]. Однако на ранних стадиях развития нейроаксиальные препараты также могут негативно влиять на спинной мозг. Литературных данных об этом пока крайне мало [81].
Спинальная анестезия при недоношенности
СА была названа золотым стандартом у недоношенных новорожденных при вмешательствах на гипогастральной области и нижних конечностях при длительности до 90 мин (< 60 недель постконцептуального возраста) [69, 87]. Вероятность развития у них апноэ увеличена (45 % до 48 недель постконцептуального возраста), которая дополнительно увеличивается сопутствующей бронхолегочной дисплазией, внутричерепным кровоизлиянием, анемией. СА снижает вероятность апноэ, брадикардии, гиповентиляции и потребность в послеоперационной искусственной вентиляции легких у этой группы пациентов [6, 23, 58, 86]. Krane с соавт. доказали низкую частоту апноэ при СА, используя пред- и послеоперационные пневмограммы [58]. Кокрановский метаанализ подтвердил снижение частоты апноэ при СА без седации и показал необходимость дальнейших крупных мультицентровых исследований для доказательства эффекта [18]. Однако снижение вероятности апноэ не исключает мониторинг этих детей в течение 24 часов в отделении интенсивной терапии.
Пробуждение и перевод
При переводе пациента в палату пробуждения должны быть стабильными дыхание, гемодинамика, глотание и кашель. Перевод из палаты пробуждения возможен при восстановлении сознания (ориентация во времени, пространстве, собственной личности соответственно возрасту), возможности перорального приема жидкостей, отсутствии тошноты и рвоты. Мочеиспускание, не будучи обязательным, помогает определить водный баланс и степень остаточного блока [29]. Если анестезия сохраняется, нужно предупредить родителей о необходимости сохранять осторожность в отношении очень горячих, очень холодных или острых предметов.
Побочные эффекты и осложнения
Осложнения спинальной анестезии у детей редки и не выражены (табл. 4). В проспективном исследовании у 506 детей в возрасте от недоношенности до подросткового имелось только одно осложнение [23]. Университетская клиника Вермонта также отмечает малое количество осложнений у новорожденных [87]. Также не встретилось упоминаний о фатальных осложнениях или тяжелых неврологических последствиях вследствие СА.
Легочно-сердечная недостаточность. У детей редко встречаются гипотензия и снижение SpO2. Однако эти явления возможны при развитии высокого блока или использовании седации. L. Imbelloni с соавт. описали бронхоспазм, развившийся при высокой анестезии [44].
Постпункционная головная боль. Считалась редко встречающейся у детей младше 10 лет, так как давление спинномозговой жидкости у них невелико, а твердая мозговая оболочка имеет хорошую эластичность. В 1999 году H. Kokki с соавт. пришли к выводу о независимости этого осложнения от возраста [52]. В других исследованиях у пациентов от 2 до 15 лет постпункционная головная боль встречалась так же часто, как и у взрослых [54, 56]. Симптомы в целом не столь остры, а значительная выраженность их составляет 0,1 %. Лечение назначается консервативное, эпидуральное пломбирование кровью (0,2–0,3 мл/кг) выполняется при наличии длительной, более 1 недели, головной боли [56]. Исследования, сравнивавшие влияние типа заточки используемых игл на частоту возникновения головной боли после СА, противоречивы. Ранние исследования сочли частоту развития постпункционной головной боли не зависящей от типа острия спинальной иглы [49], тогда как более поздние исследования — менее опасными иглы pencil point (0,4 % против 5 % у игл Квинке) [7].
Боль в спине. Частое осложнение (5–10 %), однако его причины не установлены [56].
Высокая или тотальная анестезия. Встречается в 0,6 % наблюдений и может быть обусловлена поднятием ног пациента после инъекции анестетика или выполнением барботажа при применении высоких доз анестетика [35, 87]. Слабая выраженность грудного кифоза облегчает краниальное распространение анестетика и приводит к апноэ, что требует вентиляции [20].
Транзиторные неврологические нарушения. Развиваются у 3–4 % пациентов и описываются как вновь возникшая боль и дизэстезия в ягодичной области с иррадиацией в нижние конечности [56]. В большинстве случаев симптоматика умеренная, неврологическое обследование, визуализация (УЗИ, МРТ, компьютерная томография), электрофизиологические исследования обычно не способны выявить нарушения.
Инфекционные осложнения. Зарегистрированы единичные случаи возникновения менингитов (септических и асептических) после выполнения СА у детей, также не доказана обусловленность осложнений выполнением СА [59].
Нейротоксичность адъювантов
Большинство ныне используемых адъювантов не исследовались систематически в отношении нейротоксичности до их внедрения в клиническую практику [82]. T.L. Yaksh с соавт. провели доклиническое исследование безопасности препаратов, вводимых животным периневрально, но данных о раннем постнатальном периоде крайне мало [91]. Нейроаксиально вводимые препараты, возможно, могут усилить апоптоз в развивающемся спинном мозге в период бурного развития, подобно такому же (возможному) влиянию общих анестетиков [63]. Интратекально вводимые препараты могут вызвать специфические токсические явления, изменяя нейронную активность в спинном мозге [82]. Послеродовое развитие А- и С-волокон спинного мозга зависит от активности и может быть изменено в критические фазы развития [76]. Доказано изменение ветвления дендритов ГАМКергических нейронов in vitro, но оценка in vivo не проводилась [92]. Имеется много наблюдений, свидетельствующих о безопасности применения адъювантов местных анестетиков в педиатрической анестезиологии. Однако важно понимать, что многие из них отражают ретроспективные данные с ограниченным периодом наблюдения и невозможностью подтвердить наличие или отсутствие морфологических изменений. Также у младших детей, не способных сообщить о нарушениях чувствительности и не умеющих ходить, сложно (а часто и невозможно) оценить тонкую моторную и сенсорную симптоматику. Кроме того, занижению частоты осложнений может способствовать страх юридических расследований.
Следовательно, представляется резонным определение терапевтических доз некоторых препаратов для одинаковых исходных условий и обоснование их выбора [82]. Так, например, терапевтические дозировки в раннем возрасте у морфина и клонидина увеличены в 300 раз, а у кетамина уменьшены, что обусловлено усилением апоптоза при эквипотентных анальгетических дозах [79, 80, 84]. Следует оценить новые и существующие адъюванты для СА с точки зрения безопасности и эффективности до начала их применения в клинической практике.
Вопреки некоторым специфическим показаниям и преимуществам, СА имеет некоторые ограничения.
— Однократное субдуральное введение анестетика обеспечивает хирургическую анестезию лишь на 70–80 мин и короткую послеоперационную аналгезию. Ситуация улучшается при использовании адъювантов (табл. 3). Это ограничение также требует должного отношения со стороны хирургов, так как окончание действия СА у седированного пациента затруднено, и пациент может остаться спящим, но не обезболенным [5].
— Необходимость в седации, а иногда и общей анестезии для выполнения регионарной анестезии (и, в частности, СА) у детей младшего возраста не должна влиять на решение о проведении регионарного обезболивания, так как оно вполне безопасно и надежно [23]. Вообще риск травмирования структур в области пункции ниже у спящего ребенка, чем у бодрствующего и сопротивляющегося. Седации, насколько это возможно, следует избегать у недоношенных новорожденных по причинам, описанным ранее.
— Отсутствие взаимодействия с пациентом и особенности анатомии делают СА у детей сложной задачей. Затрудненная аспирация и/или получение крови при люмбальной пункции обусловливают неудачную СА [6, 44, 60]. Ранее сообщалось о 5–15 % неудачных анестезий, однако имеется множество новых обширных исследований с лучшим соотношением успешных анестезий [44, 47, 54, 67]. Технические сложности и неудачи скорее зависят от индивидуального опыта.
— Педиатрические спинальные иглы дороже обычных и менее доступны. Стандартные («взрослые») иглы могут быть использованы начиная с возраста 6–7 лет, а при аккуратном выполнении — и у младших детей (вплоть до 6 мес. — 1 года) [51, 67].
Заключение
Основываясь на обширных литературных данных и нашем собственном опыте, мы можем с уверенностью сказать, что СА у детей безопасна, технически проста и дешева при должном опыте анестезиолога, правильном выборе метода анестезии, анестетика и адъювантов. К сожалению, возможность выбора адъювантов в Украине отсутствует в связи с административными причинами, и эта проблема никак не решается. Данные зарубежной литературы свидетельствуют, что в умелых руках опытного специалиста спинальная анестезия сама по себе или в составе сбалансированного многокомпонентного обезболивания может стать отличным выбором для многих пациентов, в том числе и с высоким риском анестезии.
Список литературы
1. Грегори Дж.А. Анестезия в педиатрии / Дж.А. Грегори. — М.: Медицина, 2003. — 1178 c.
2. Оксфордский справочник по анестезиологии: Пер. с англ. под ред. проф. Евдокимова Е.А. / Олман К., Уилсон А. — М.: Бином, 2009. — 768 с.
3. Пащук А.Ю. Регионарное обезболивание. — М.: Медицина, 1987. — 155 с.
4. Регионарная анестезия: Пер. с англ. под ред. Зильбера А.П., Мальцева В.В. / Рамфел Д.П., Нил Д.М., Вискоуми К.М. — М.: МЕДпресс-информ, 2008. — 272 с.
5. Чумаченко Е.Д. Объективная оценка и мониторинг боли. Analgesia Nociception Index: на пути к золотому стандарту обезболивания? Стендовый доклад // Материалы VI Национального конгресса Ассоциации анестезиологов Украины, 18–21 сентября 2013, Львов.
6. Abajian J.C., Mellish R.W., Browne A.F., Perkins F.M., Lambert D.H., Mazuzan J.E. Jr. Spinal anesthesia for surgery in the high-risk infant // Anesth. Analg. — 1984. — № 6. — Р. 359-362.
7. Apiliogullari S., Duman A., Gok F., Akillioglu I. Spinal needle design and size affect the incidence of postdural puncture headache in children // Paediatr. Anaesth. — 2010. — № 20. — Р. 177-182.
8. Aronsson D.D., Gemery J.M., Abajian J.C. Spinal anesthesia for spine and lower extremity surgery in infants // J. Pediatr. Orthop. — 1996. — № 16. — Р. 259-263.
9. Arora M.K., Nagaraja G., Lakhe S.T. Combined spinal-epidural anesthetic for a child with Freeman-Sheldon syndrome with difficult airway // Anesth. Analg. — 2006. — № 103. — Р. 1624.
10. Arthrus O.J., Murray M., Zubier M., Tooley J., Kelsall W. Ultrasongraphic determination of neonatal spinal canal depth // Arch. Dis. Child Fetal. Neonatal. Ed. — 2008. — № 93. — Р. 451-454.
11. Batra Y.K., Lokesh V.C., Panda N.B., Rajeev S., Rao K.L. Dose-response study of intrathecal fentanyl added to bupivacaine in infants undergoing lower abdominal and urologic surgery // Paediatr. Anaesth. — 2008. — № 18. — Р. 613-619.
12. Batra Y.K., Rajeev S., Panda N.B., Lokesh V.C., Rao K.L. Intrathecal neostigmine with bupivacaine for infants undergoing lower abdominal and urogenital procedures: Dose response // Acta Anesthesiol. Scand. — 2009. — № 53. — Р. 470-475.
13. Berde C., Sethna N.F., Conrad L.S., Hershenson M.B., Shillito J. Jr. Subarachanoid bupivacaine analgesia for seven months for a patient with a spinal cord tumor // Anesthesiology. — 1990. — № 72. — Р. 1094-1096.
14. Berkowitz S., Greene B.A. Spinal anaesthesia in children: Report based on 350 patients under 13 years // Anesthesiology. — 1951. — № 12. — Р. 376-387.
15. Bier A. Experiment regarding the cocainization of the spinal cord // Zentralbl. Chir. — 1899. — № 51. — Р. 361-369.
16. Calvert D.G. Direct spinal anesthesia for repair of myelomeningocele // Br. Med. J. — 1996. — № 2. — Р. 86-87.
17. Cao J.P., Miao X.Y., Liu J., Shi X.Y. An evaluation of intrathecal bupivacaine combined with intrathecal or intravenous clonidine in children undergoing orthopedic surgery: A randomized double-blinded study // Paediatr. Anaesth. — 2011. — № 21. — Р. 399-405.
18. Craven P.D., Badawi N., Henderson-Smart D.J., O’Brien M. Regional (spinal, epidural, caudal) versus general anaesthesia in preterm infants undergoing inguinal herniorrhaphy in early infancy // Cochrane Database Syst. Rev. — 2003. — № 3. — CD003669.
19. Dallens B.J., Khandwala R.S., Tanguy A. Staged segmental scoliosis surgery during regional anesthesia in high risk patients: A report of six cases // Anesth. Analg. — 1993. — № 76. — Р. 434-439.
20. Dohi S., Seino H. Spinal anesthesia in premature infants: Dosage and effects of sympathectomy // Anesthesiology. — 1986. — № 65. — Р. 559-561.
21. Duman A., Apiliogullari S., Duman I. Effects of intrathecal fentanyl on quality of spinal anesthesia in children undergoing inguinal hernia repair // Paediatr. Anaesth. — 2010. — № 20. — Р. 530-536.
22. Duniec L., Nowakowski P., Kosson D., Łazowski T. Anatomical landmarks based assessment of intravertebral space level for lumbar puncture is misleading in more than 30% // Anaesthesiol. Intensive Ther. — 2013 Jan-Mar. — № 45(1). — Р. 1-6.
23. Ecoffey C., Lacroix F., Giaufré E., Orliaguet G., Courrèges P. Association des Anesthésistes Réanimateurs Pédiatriques d’Expression Française (ADARPEF) Epidemilogy and morbidity of regional anesthesia in children: A follow-up one-year prospective survey of the French-Language Society of Pediatric Anesthesiologists (ADARPEF) // Paediatr. Anaesth. — 2010. — № 20. — Р. 1061-1069.
24. Eschertzhuber S., Hohlrieder M., Keller C., Oswald E., Kuehbacher G., Innerhofer P. Comparison of high- and low-dose intrathecal morphine for spinal fusion in children // Br. J. Anaesth. — 2008. — № 100. — Р. 538-543.
25. Finkel J.C., Doyle J.M., Conran A.M. A comparison of three intrathecal morphine doses during SA in children having open heart surgery // Anesthesiology. — 1997. — № 87. — A1052.
26. Fösel T., Wilhelm W., Grüness V., Molter G. Spinal anesthesia in infancy using 0.5% bupivacaine: The effect of adrenaline addition on duration and haemodynamics // Anaesthesist. — 1994. — № 43. — Р. 26-29.
27. Frawley G., Smith K.R., Ingelmo P. Relative potencies of bupivacaine, levobupivacaine, and ropivacaine for neonatal spinal anaesthesia // Br. J. Anaesth. — 2009. — № 103. — Р. 731-738.
28. Ganesh A., Kim A., Casale P., Cucchiaro G. Low dose intrathecal morphine for postoperative analgesia in children // Anesth. Analg. — 2007. — № 104. — Р. 271-276.
29. Geiduschek J.M. Pediatrics / Ed. by Brown D.L. // Regional anaesthesia and analgesia. — 1st ed. — Philadelphia: WB Saunders Company, 1996. — Р. 559-562.
30. Gingrich Bk. Spinal anesthesia for a former preterm infant undergoing upper abdominal surgery // Anesthesiology. — 1993. — № 79. — Р. 189-190.
31. Gleason C.A., Martin R.J., Anderson J.V., Carlo W.A., Sanniti K.J., Fanaroff A.A. Optimal position for a spinal tap in preterm infants // Pediatrics. — 1983. — № 71. — Р. 31-35.
32. Goldman L.J. Complications in regional anaesthesia // Paediatr. Anaesth. — 1995. — № 5. — Р. 3-9.
33. Gray H.T. A study of subarachnoid block in children and infants // Lancet. — 1909. — № 2. — Р. 913-917.
34. Gupta A., Saha U., Sinha S.K., Gupta N. Subarachanoid block (SAB) versus general anaesthesia (GA) in children undergoing surgeries below umbilicus // J. Anaesthesiol. Clin. Pharmacol. — 2008. — № 24. — Р. 425-428.
35. Hermanns H., Stevens M.F., Werdehausen R., Braun S., Lipfert P., Jetzek-Zader M. Sedation during spinal anaesthesia in infants // Br. J. Anaesth. — 2006. — № 97. — Р. 308-304.
36. Hirabayashi Y., Shimizu R., Saitoh K., Fukuda H. Spread of subarachnoid hyperbaric amethocaine in adolescents // Br. J. Anaesth. — 1995. — № 74. — Р. 41-45.
37. http://english.migdal.ru/times/54/4971/
38. http://foma.ru/sviatitel-luka-professor-vrach-arhiepiskop.html
39. http://pie.med.utoronto.ca/vspine
40. http://rsra.rusanesth.com/shkola/nejroaksialnyie-blokadyi/spinalnaya-anesteziya.html
41. http://www.nkj.ru/archive/articles/22608/
42. http://www.usra.ca/vspine.php
43. https://ru.wikipedia.org/wiki/Спинальная_анестезия
44. Imbelloni L.E., Vieira E.M., Sperni F., Guizellini R.H., Tolentino A.P. Spinal anesthesia in children with isobaric local –anesthetics: Report on 307 patients under 13 years of age // Pediatr. Anaesth. — 2006. — № 16. — Р. 43-48.
45. Junkin C.I. Spinal anaesthesia in children // Can. Med. Assoc. J. — 1933. — № 28. — Р. 51-53.
46. Kaabachi O., Zarghouni A., Ouezini R., Abdelaziz A.B., Chattaoui O., Kokki H. Clonidine 1 microgram/kg is a safe and effective adjuvant to plain bupivacaine in spinal anesthesia in adolescents // Anesth. Analg. — 2007. — № 105. — Р. 516-519.
47. Kachko L., Simhi E., Tzeitlin E., Efrat R., Tarabikin E., Peled E. et al. Spinal anesthesia in neonates and infants — a single-center experience of 505 cases // Paediatr. Anaesth. — 2007. — № 17. — Р. 647-653.
48. Kokki H., Heikkinen M., Ahonen R. Recovery after paediatric day case herniotomy performed under spinal anaesthesia // Pediatr. Anesth. — 2000. — № 10. — Р. 413-417.
49. Kokki H., Heikkinen M., Turunen M., Vanamo K., Hendolin H. Needle design does not affect the success rate of spinal anaestheisa or the incidence of postpuncture complications in children // Acta Anaesthesiol. Scand. — 2000. — № 44. — Р. 210-213.
50. Kokki H., Hendolin H., Vainis J. Operation im Vorschlater: Vergleich Von spinal anaesthesia ind allegemein anaesthestics // –Anaesthesist. — 1992. — № 41. — Р. 765-768.
51. Kokki H., Hendolin H. Comparison of 25G and 29G Quincke spinal needles in pediatrics day care surgery. A prospective randomized study of puncture characteristics, success rate and postoperative complaints // Paed. Anesth. — 1996. — № 6. — Р. 115-119.
52. Kokki H., Sakonvaara M., Herrgård E., Onen P. Postdural puncture headache is not an age-related symptom in children: A prospective, open-randomised, parallel group study comparing a 22-gauge Quincke with a 22-gauge Whitacre needle // Paediatr. Anaesth. — 1999. — № 9. — Р. 429-434.
53. Kokki H., Tuovinen K., Hendolin H. Spinal anaesthesia for pediatric day-case surgery: A double blind, randomized, parallel group, prospective comparison of isobaric and hyperbaric bupivacaine // Br. J. Anaesth. — 1998. — № 81. — Р. 502-506.
54. Kokki H., Turunen M., Heikkinen M., Reinikainen M., Laisalmi M. High success rate and low incidence of headache and neurological symptoms with two spinal needle designs in children // Acta Anaesthesiol. Scand. — 2005. — № 49. — Р. 1367-1372.
55. Kokki H., Ylönen P., Laisalmi M., Heikkinen M., Reinikainen M. Isobaric ropivacaine 5 mg/ml for spinal anaesthesia in children // Anesth. Analg. — 2005. — № 100. — Р. 66-70.
56. Kokki H. Spinal blocks // Paediatr. Anaesth. — 2012. — № 22. — Р. 56-64.
57. Kowalewski R., MacAdams C., Frelich J., Neil S., Maitland A. Anaesthesia supplement with subarachnoid bupivacaine and morphine for coronary artery bypass surgery in a child with Kawasaki disease // J. Cardiothorac. Vasc. Anesth. — 1996. — № 10. — Р. 243-246.
58. Krane E.J., Harberkern C.M., Jacobson L.E. Postoperative apnea, bradycardia and oxygen desaturation in formerly premature infants: Prospective comparison of spinal and general anesthesia // Anesth. Analg. — 1995. — № 80. — Р. 7-13.
59. Lauriala J.J., Lostamovaara P.A., Alahuhta S. Streptococcus Salivarius meningitis after spinal anaesthesia in an infant // Anesthesiology. — 1998. — № 19. — Р. 1579-1580.
60. López T., Sánchez F.J., Garzón J.C., Muriel C. Spinal anesthesia in pediatric patients // Minerva Anestesiol. — 2012. — № 78. — Р. 78-87.
61. Nickel U.S., Meyer R.R., Brambrink A.M. Spinal anesthesia in an extremely low birth weight infant // Paediatr. Anaesth. — 2005. — № 15. — Р. 58-62.
62. O’Higashi T., Shirakami G., Sasai S., Shinomura T., Kato S., Tomoda K. Spinal anesthesia for patients with progressive muscular dystrophy // Masui. — 1995. — № 44. — Р. 723-728.
63. Olney J.W., Young C., Wozniak D.F., Ikonomidou C., Jevtovic-Todorovic V. Anesthesia induced developmental neuroapoptosis: Does it happen in humans? // Anesthesiology. — 2004. — № 101. — Р. 273-275.
64. Pascucci R.C., Hershenson M.B., Sethna N.F., Loring S.H., Stark A.R. Chest wall motion of infants during spinal anaesthesia // J. Appl. Physiol. (1985). — 1990. — № 68. — Р. 2087-2091.
65. Piral A., Akpek E., Arslam G. Intrathecal versus 4 fentanyl in pediatric cardiac anaesthesia // Anesth. Analg. — 2002. — № 95. — Р. 1207-1214.
66. Prats-Galino A., Reina M.A., Puigdellívol-Sánchez A., Juanes Méndez J.A., de Andrés J.A., Collier C.B. Cerebrospinal fluid volume and nerve root vulnerability during lumbar puncture or spinal anaesthesia at different vertebral levels // Anaesth. Intensive Care. — 2012 Jul. — № 40(4). — Р. 643-647.
67. Puncuh F., Lampugnani E., Kokki H. Use of spinal anesthesia in pediatric patients: A single centre experience with 1132 cases // Pediatr. Anesth. — 2004. — № 14. — Р. 564-567.
68. Rice L.J., DeMars P.D., Whalen T.V., Crooms J.C., Parkinson S.K. Duration of spinal anesthesia in infants less than one year of age. Comparison of three hyperbaric techniques // Reg. Anesth. — 1994. — № 19. — Р. 325-329.
69. Rochette A., Raux O., Troncin R., Dadure C., Verdier R., Capdevila X. Clonidine prolongs spinal anesthesia in newborns: A prospective dose ranging study // Anesth. Analg. — 2004. — № 98. — Р. 56-59.
70. Sarma J., Narayana P.S., Ganapathi P., Shivakumar M.C. A comparative study of intrathecal clonidine and dexmedetomidine on characteristics of bupivacaine spinal block for lower limb surgeries // Anesth. Essays Res. — 2015 May-Aug. — № 9(2). — Р. 195-207.
71. Shaywitz B.A. Epidermoid spinal cord tumors and previous lumbar punctures // J. Pediatr. — 1972. — № 80. — Р. 638-640.
72. Singh R., Batra Y.K., Bharti N., Panda N.B. Comparison of propofol versus propofol-ketamine combination for sedation during spinal anesthesia in children: Randomized clinical trial of efficacy and safety // Paediatr. Anaesth. — 2010. — № 20. — Р. 439-444.
73. Spencer H.T., Barnes P.J. Spinal anesthesia for pediatric radiotherapy // Anaesth. Intensive Care. — 1980. — № 8. — Р. 214-216.
74. Tirmizi H. Spinal anesthesia in infants: recent developments // Curr. Opin Anaesthesiol. — 2015 Jun. — № 28(3). — Р. 333-338.
75. Tobias J.D. Anesthetic care for the child of Morquio Syndrome: General versus regional anesthesia // J. Clin. Anesth. — 1999. — № 11. — Р. 242-6.
76. Torsney C., Meredith-Middleton J., Fitzgerald M. Neonatal capsaicin treatment prevents the normal postnatal withdrawal of A fibres from lamina II without affecting fos responses to innocuous peripheral stimulation // Brain Res. Dev. Brain Res. — 2000. — № 121. — Р. 55-65.
77. Van Schoor A.N., Bosman M.C., Bosenberg A.T. Descriptive study of the differences in the level of the conus medullaris in four different age groups // Clin. Anat. — 2015 Feb 2. — Doi: 10.1002/ca.22505.
78. Viscomi C.M., Abajian J.C., Wald S.L., Rathmell J.P., Wilson J.T. Spinal anesthesia for repair of meningomyelocele in neonates // Anesth. Analg. — 1995. — № 81. — Р. 492-495.
79. Walker S.M., Grafe M., Yaksh T.L. Intrathecal clonidine in the neonatal rat: Dose-dependent analgesia and evaluation of spinal apoptosis and toxicity // Anesth. Analg. — 2012. — № 115. — Р. 450-460.
80. Walker S.M., Westin B.D., Deumens R., Grafe M., Yaksh T.L. Effects of intrathecal ketamine in the neonatal rat: Evaluation of apoptosis and long-term functional outcome // Anesthesiology. — 2010. — № 113. — Р. 147-159.
81. Walker S.M., Yaksh T.L. Neuraxial analgesia in neonates and infants: A review of clinical and preclinical strategies for the development of safety and efficacy data // Anesth. Analg. — 2012. — № 115. — Р. 638-662.
82. Walker S.M., Yaksh T.L. Neuraxial analgesia in neonates and infants: A review of clinical and preclinical strategies for the development of safety and efficacy data // Anesth. Analg. — 2012. — № 115. — Р. 638-662.
83. Wenk M., Weiss C., Möllmann M., Pöpping D.M. Procedural complications of spinal anaesthesia in the obese patient // –Anesthesiol. Res. Pract. — 2012. — № 2012. — Р. 165-267. — Doi: 10.1155/2012/165267.
84. Westin B.D., Walker S.M., Deumens R., Grafe M., Yaksh T.L. Validation of a preclinical spinal safety model: Effects of intrathecal morphine in the neonatal rat // Anesthesiology. — 2010. — № 113. — Р. 183-199.
85. William R.K., Abajian J.C. High spinal anaesthesia for repair of patient ductus arterious in neonates // Paediatr. Anaesth. — 1997. — № 7. — Р. 205-209.
86. Williams J.M., Stoddart P.A., Williams S.A., Wolf A.R. Postoperative recovery after inguinal herniotomy in ex-premature infants: Comparison between sevoflurane and spinal anesthesia // Br. J. Anaesth. — 2001. — № 86. — Р. 366-371.
87. Williams R.K., Adams D.C., Aladjem E.V., Kreutz J.M., Sartorelli K.H., Vane D.W. et al. The safety and efficacy of spinal anesthesia for surgery in infants: The Vermont Infant Spinal Registry // Anesth. Analg. — 2006. — № 102. — Р. 67-71.
88. Williams R.K., McBride W.J., Abajian J.C. Combined spinal and epidural anesthesia for major abdominal surgery in infants // Can. J. Anaesth. — 1997. — № 44. — Р. 511-514.
89. Wolf A.R., Doyle E., Thomas E. Modifying infants stress responses to major surgery: Spinal vs extradural vs opioid analgesia // Paediatr. Anaesth. — 1998. — № 8. — Р. 305-311.
90. Wright T.E., Orr R.J., Haberkern C.M., Walbergh E.J. Complications during spinal anesthesia in infants: High spinal blockade // Anesthesiology. — 1990. — № 73. — Р. 1290-1292.
91. Yaksh T.L., Rathbun M.L., Provencher J.C. Preclinical safety evaluation for spinal drugs / Yaksh T.L. // Spinal. Drug. Delivery. — Amsterdam: Elsevier Science BV, 1999. — Р. 417-437.
92. Zhang H., Zhou F., Li C., Kong M., Liu H., Zhang P. et al. Molecular mechanisms underlying the analgesic property of intrathecal dexmedetomidine and its neurotoxicity evaluation: An in vivo and in vitroexperimental study // PLoS One. — 2013. — № 8. — e55556.

/66.jpg)
/67.jpg)
/70.jpg)