Статтю опубліковано на с. 35-40
Життя — це боротьба, але не з гріхом
та владою грошей... а з іонами водню.
Г.Л. Менкен (1880–1956)
Глибокі та різнобічні порушення метаболічних процесів, що властиві цукровому діабету (ЦД), можуть за певних умов призводити до надтяжких ускладнень, які становлять безпосередню загрозу життю хворого та вимагають невідкладної допомоги. До числа таких критичних (невідкладних) станів при ЦД відносять кетоацидоз та різні види коматозних станів. На сьогодні при ЦД виокремлюють чотири види діабетичних невідкладних станів:
— кетоацидоз та його найтяжчий варіант — гіперкетонемічна (кетоацидотична, власне діабетична) кома;
— гіперосмолярна (некетонемічна, неацидотична кома, діабетична кома без кетозу);
— гіпоглікемічний синдром та гіпоглікемічна кома;
— лактацидемічна (молочнокисла) кома [4].
Двом останнім ускладненням з цього списку приділяється невиправдано мало уваги при підготовці лікарів загального профілю та спеціалістів з інтенсивної терапії. Такий підхід пояснюється розхожим уявленням про те, що одне діагностується просто, а лікується ще простіше (гіпоглікемічна кома), інше ж (лактатацидоз (ЛА)) зустрічається вкрай рідко. Нижче ми спробуємо показати, що такий підхід не може розглядатися як раціональний, а лактатацидоз (стан, якому присвячена ця стаття) потребує своєчасної, точної та адекватної терапії.
Молочна кислота — α-оксипропіонова одноосновна оксикарбонова кислота з хімічною формулою СН3-СН(ОН)-СООН — була відкрита шведським хіміком Карлом Шеєле в 1780 році. З того часу вона відома як важливий проміжний продукт нормального метаболізму. Уперше пов’язали розвиток метаболічного ацидозу з накопиченням молочної кислоти D. Barr, H. Himwich та R. Green у 1924 році. Ці дослідники встановили наявність метаболічного ацидозу після інтенсивних фізичних вправ і пов’язали його появу з накопиченням у крові молочної кислоти [19]. Вони назвали цей стан молочнокислим ацидозом, або лактатацидозом (lactic acid acidosis).
Лактатацидоз (лактоацидоз, лактатацидотична кома, лактатацидемічна кома, молочнокисла кома, гіперлактатацидемія) — неспецифічний синдром, що розвивається при ряді тяжких захворювань (у тому числі при цукровому діабеті), коли створюються передумови для підвищеного утворення та накопичення в крові та периферичних тканинах молочної кислоти. Патологічне підвищення концентрації лактату в крові може виникнути внаслідок підвищеної продукції або зниженого виведення, а також у разі поєднання обох згаданих причин.
Тяжкий лактатацидоз визначається як метаболічний ацидоз (рН крові < 7,2) з великим аніонним проміжком (аніонна різниця > 12 ммоль/л) та збільшенням концентрації лактату в крові понад 5,0 ммоль/л (норма 0,5–1,5 ммоль/л).
Лактатацидемічна кома асоціюється з найбільшою частотою летальних наслідків — смертність може перевищувати 80 % [15]. Лактатацидемічна кома є неспецифічним гострим ускладненням цукрового діабету, вона може розвиватися при ряді станів, при яких відзначаються прояви аноксії та шоку, отже, створюються передумови для підвищеного утворення та накопичення в крові та тканинах молочної кислоти. Серед таких станів варто відзначити інфаркт міокарда, захворювання нирок, лейкемію, отруєння чадним газом тощо. Провокувати розвиток лактатацидозу можуть серцева, легенева, ниркова недостатність, захворювання печінки з порушенням її функції, шок, крововтрата, хронічний алкоголізм тощо. Лактатацидоз може розвинутися при отруєннях саліцилатами, метиловим спиртом, після парентерального введення фруктози.
Патогенез лактатацидозу
У процесі анаеробного гліколізу утворюється лактат та іони водню, що в нормальних аеробних умовах використовуються печінкою, нирками та серцем і в подальшому окислюються повністю до діоксиду вуглецю і води або вступають на шлях глюконеогенезу.
Типи лактатацидозу прийнято розрізняти залежно від наявності або відсутності гіпоксії (табл. 1).
Тип A лактатацидозу (анаеробно-гіпоксичний) розвивається у випадках глибокої тканинної гіпоксії при таких станах, як інфаркт міокарда, кардіогенний шок або тяжкий сепсис. У таких ситуаціях внаслідок активізації анаеробного метаболізму виробляється надлишок лактату.
У здорових людей співвідношення молочної та піровиноградної кислот у сироватці крові становить приблизно 10 : 1. У разі виникнення гіпоксії активується анаеробний гліколіз, утворюється надлишок молочної кислоти. До того ж за нестачі інсуліну зменшується активність піруватдегідрогенази, внаслідок чого піруват не трансформується в ацетил-КоА, а перетворюється на лактат. Крім того, гіпоксія гальмує ресинтез лактату в глікоген у печінці. Отже, співвідношення лактат/піруват зсувається в бік лактату й формується надлишок лактату. При цьому можливості організму щодо виведення й знешкодження лактату можуть також бути зменшені.
Ця ситуація не властива діабету, але люди з діабетом (особливо з ЦД 2-го типу) мають підвищений ризик гіпоксичних серцево-судинних ускладнень.
Тип B лактатацидозу (аеробний) зустрічається рідше й пов’язаний з розвитком системних захворювань (у тому числі цукрового діабету), застосуванням деяких препаратів, дією токсинів і проявами вроджених порушень метаболізму. Зокрема, це має місце при вродженому дефіциті піруватдегідрогенази або її каталізаторів. Активність зазначеного ферменту знижується в разі дефіциту гідроксіетилтіаміну, природнім джерелом якого є тіамін (вітамін В1). Нестача тіаміну виникає в алкоголіків з порушеним режимом харчування; при швидкому введенні глюкози в таких пацієнтів може відбуватися швидке накопичення пірувату й лактату, що призводить до тяжкого лактатацидозу, нерідко з летальним наслідком [5].
Особливо небезпечними описані порушення метаболізму є у хворих, які приймають бігуаніди. Раніше відзначалися випадки лактатацидозу у хворих, які отримували терапію фенформіном або, меншою мірою, буформіном. На фоні прийому фенформіну часто розвивалася блокада утилізації лактату печінкою та м’язами, що вело до розвитку гіперлактатацидемії та тяжкого метаболічного ацидозу [6].
Крім того, до розвитку лактатацидозу у хворих, що приймають бігуаніди, може призвести виражена гіпоксія тканин, пов’язана з серцевою недостатністю, ураженням печінки, хронічними запальними процесами легень тощо. Можливо, саме цим пояснюється та обставина, що половина випадків тяжкого лактатацидозу припадає на хворих із ЦД [3].
Через можливість розвитку лактатацидозу (переважно типу В) фенформін був знятий з ринку лікарських препаратів. У разі застосування сучасного препарату з групи бігуанідів — метформіну — лактатацидоз спостерігається значно рідше: реєструється близько 3 випадків на 100 000 пацієнтів [12].
Метформін-асоційований лактатацидоз може бути:
— типу А, коли ацидоз є результатом супутнього ускладненого тяжкого захворювання з гіпоксією та без накопичення метформіну;
— типу В, коли спостерігається кумуляція метформіну без супутніх гіпоксичних факторів;
— змішаним, коли спостерігається поєднання обох патогенетичних механізмів.
Відомо, що 90 % абсорбованого метформіну екскретується в незмінному вигляді нирками. Отже, саме функція нирок визначає виведення метформіну [13]. Тому основним протипоказанням до застосування метформіну є ниркова недостатність. Зокрема, Американська діабетична асоціація рекомендує уникати використання метформіну у випадках, коли рівень креатиніну сироватки перевищує 125 мкмоль/л [11].
Через накопичення лактату в разі гіпоксії метформін також протипоказаний у разі неконтрольованої серцевої недостатності.
Особливий тип лактатацидозу описаний у хворих із пухлинами. У ракових клітинах, що швидко ростуть, гліколіз іде зі швидкістю, що значно перевищує можливості циклу лимонної кислоти. Унаслідок цього утворення пірувату перевищує його утилізацію. Це, у свою чергу, призводить до розвитку лактатацидозу [5].
Клініка лактатацидозу та лактатацидемічної коми
Гіперлактатацидемічна кома зустрічається переважно в осіб похилого віку, які страждають від тяжких захворювань серця, легень, печінки, нирок [3].
Кома розвивається швидко, протягом кількох годин. Передвісники, як правило, відсутні або нехарактерні. Хворі скаржаться на біль у м’язах, біль за грудниною, диспептичні явища, прискорення дихання, апатію, сонливість чи, навпаки, безсоння. Часто на фоні тяжкого загального стану цих хворих, обумовленого наявною в них супутньою патологією, вказані симптоми залишаються непоміченими.
Услід за цими «малими» ознаками швидко наростають прояви серцево-судинної недостатності, обумовленої тяжким ацидозом, на фоні якого відбуваються зміни скоротливої здатності міокарда. Стан хворих прогресивно погіршується. Розвиваються брадикардія та брадіаритмія (рідше — тахікардія), гіпотензія, колапс. Виникають ознаки гіпоксії мозку, що веде до порушення свідомості. У багатьох хворих спостерігається поліморфна неврологічна симптоматика від арефлексії до спастичних парезів та гіперкінезів [6].
Гіпотензія, гіпотермія, порушення серцевого ритму та дихальна недостатність можуть також виникати й у хворих із метформін-асоційованим лактатацидозом [15].
У зв’язку з тим, що ЛА розвивається швидко, протягом кількох годин, зовнішні ознаки дегідратації (сухість шкіри, слизових оболонок, язика) можуть бути не виражені, вони не такі характерні, як у разі діабетичного кетоацидозу. Незважаючи на відсутність запаху ацетону в повітрі, що видихається (кетонемії зазвичай немає), у хворого з молочнокислим ацидозом спостерігається дихання Куссмауля. По мірі наростання ацидозу може з’являтися біль у животі, посилюються нудота та блювання. Унаслідок гіпотензії часто розвивається олігурія, а в тяжких випадках і анурія. На фоні такої тяжкої та різноманітної клінічної картини виникає та прогресує ДВЗ-синдром. Часто зустрічаються внутрішньосудинні тромбози з геморагічними некрозами пальців рук та ніг. Рівень глікемії може значно варіювати, а в деяких пацієнтів відзначається гіпоглікемія.
Діагностика
Оскільки симптоми лактатацидозу неспецифічні, діагноз лактатацидемічної коми слід запідозрити у хворого на ЦД з гіпотензією або в стані шоку у випадку, коли вираженість ацидозу не відповідає ступеню кетозу. Кінцевий діагноз виставляють на підставі визначення вмісту молочної кислоти в крові, що при нормі 0,5–1,5 ммоль/л часто досягає рівня понад 5 ммоль/л при зменшенні рН артеріальної крові нижче від 7,2. Рівень глікемії нерізко підвищений або нормальний. При цьому співвідношення лактат/піруват різко зсувається в бік лактату. При дослідженні сечі виявляють глюкозурію за відсутності ацетону.
Гіперлактатацидемічну кому слід диференціювати з іншими формами метаболічного ацидозу, що можуть бути наслідком гіперхлоремії, отруєння оцтовою кислотою, саліцилатами, метанолом, етиленгліколем. У діагностиці допомагають анамнез, опитування рідних, вирішальне значення має визначення підвищеного рівня молочної кислоти в крові.
Лікування
На даний момент не існує ефективних методів терапії лактатацидемічної коми. Першочергове значення в терапії лактатацидозу мають заходи з усунення ацидозу. Паралельно проводиться корекція інших метаболічних розладів, усунення гіпотензії, корекція порушень мікроциркуляції, анемії, гіпоксії [15].
Інсулінотерапія не є основним методом лікування лактатацидозу. Її проводять дуже малими дозами інсуліну (1–2 ОД/год) в/в крапельно в поєднанні з інфузією 5% глюкози у зв’язку з невисокими рівнями глікемії. Корекцію дози проводять за загальними правилами лікування хворих в коматозних станах із щогодинним визначенням рівня глікемії.
Провідне місце в терапії ЛА посідає парціальна корекція ацидозу за допомогою внутрішньовенного крапельного введення бікарбонату натрію. Розрахункова доза останнього для корекції може перевищувати 1000 ммоль (2 літри 4% розчину!) [1]. Такі надвисокі дози соди можуть, у свою чергу, мати низку небажаних ефектів.
Так, у процесі швидкого залуження в плазмі крові утворюється значна кількість вугільної кислоти і, відповідно, вуглекислого газу, елімінація якого вимагає підвищення об’ємів легеневої вентиляції. Тому бікарбонат натрію протипоказаний при дихальній недостатності.
Вуглекислота, що утворюється, легко проникає через клітинні мембрани, що знижує рівень цитоплазматичного рН (внутрішньоклітинний ацидоз).
Інші несприятливі ефекти натрію бікарбонату:
— зменшення коронарного тиску нижче від критичних значень;
— підвищення внутрішньочерепного тиску;
— зниження вмісту кисню в мозку;
— зниження внутрішньоклітинного рН у мозку;
— проникнення вуглекислоти в спинномозкову рідину з розвитком лікворного ацидозу;
— зміщення кривої дисоціації оксигемоглобіну вправо та зменшення віддачі кисню тканинам;
— гіпернатріємія, збільшення цитоплазматичного вмісту натрію в міокарді;
— гіпокаліємія, гіпофосфатемія та інше [2].
Застосування розчинів звичайного натрію гідрокарбонату пов’язане з комплексом небажаних ефектів. Зокрема, можливий розвиток гіпернатріємії, гіперосмолярності, посилення внутрішньоклітинного ацидозу, особливо в нейронах головного мозку (за рахунок швидкого надходження CO2 в спинномозкову рідину та всередину клітини) [7, 8]. При передозуванні бікарбонату натрію може розвинутись метаболічний алкалоз, що значно небезпечніший за ацидоз через відсутність ефективних методів його компенсації.
Запобігти ускладненням, що були описані вище, можна, якщо врахувати, що бікарбонат є не просто джерелом лужних еквівалентів, а й невід’ємною частиною потужної буферної системи організму. Крім бікарбонату, її складовою частиною є вуглекислий газ. Співвідношення цих двох компонентів описане рівнянням Гендерсона — Гессельбаха (рН = 6,11 + log HCO3/рСО2), воно визначає рівень рН. Перспективним, на нашу думку, виглядає використання буферованих розчинів натрію гідрокарбонату, таких як вітчизняний препарат сода-буфер. Він містить основні складові бікарбонатного буфера, а саме: гідрокарбонат натрію (NaHCO3) та вуглекислоту (CO2) у фізіологічному співвідношенні (20 : 1), що забезпечує підтримання показника pH на рівні 7,4. Унаслідок цього препарат являє собою не просто розчин соди, а фізіологічний бікарбонатний буфер, тобто розчин, що дозволяє підтримувати постійний рівень рН середовища, уникаючи при цьому різких його коливань [10].
Розчин сода-буфер призначають для корекції метаболічного ацидозу (лактатацидозу) дорослим і дітям, старшим від 1 року, внутрішньовенно крапельно зі швидкістю 1,5 ммоль/кг на годину (3 мл 4,2% соди-буфер/кг за годину), під контролем рН крові й показників кислотно-лужного та водно-електролітного балансу.
Доза вираховується залежно від показників газів крові за формулою:
Об’єм р-ну сода-буфер = дефіцит основ (–ВЕ) • МТ • 0,3 • 2,
де МТ — маса тіла, фактор 0,3 відповідає частці позаклітинної рідини порівняно із загальною рідиною.
Максимальна доза препарату: для дорослих — 300 мл (при підвищеній масі тіла — 400 мл) на добу, для дітей — від 100 до 200 мл на добу залежно від маси тіла.
У разі тяжких випадків лактатацидозу показаний перитонеальний діаліз або гемодіаліз.
Метформін є «діалізабельним» препаратом, і застосування бікарбонату натрію в комбінації з гемодіалізом може бути успішним в лікуванні метформін-асоційованого лактатацидозу [13]. Ефективність застосування інших терапевтичних засобів, таких як дихлорацетат (активатор піруватдегідрогенази) чи метиленовий синій, залишається недоведеною.
Проблема лактатацидозу та використання ліків, що містять лактат
Як зазначалося вище, застосування розчинів натрію гідрокарбонату пов’язане з комплексом небажаних ефектів, що значно обмежують його вживання. Зазначені недоліки розчинів бікарбонату натрію були виявлені досить давно, тому ще в 30-ті рр. ХХ століття для усунення ацидозу було запропоновано (A. Hartman) використовувати органічні аніони. На той час стало відомо, що органічні аніони, такі як лактат і ацетат, в організмі є проміжними продуктами метаболізму, далі вони трансформуються у відповідні кислоти (молочну й оцтову). Для цього необхідний іон водню, джерелом якого служить вугільна кислота. Приєднуючи протон, аніони стають кислотами, при цьому утворюється бікарбонатний іон. Указані процеси є проміжними в ході перетворення глюкози (через ацетат і лактат) в ацетил-КоА.
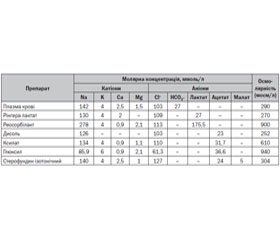
Отже, при метаболізмі одного органічного аніона утвориться один іон бікарбонату, що потім може брати участь у буферних реакціях кислотно-лужної рівноваги. Наведені реакції перебігають у цитоплазмі будь-яких клітин, але в основному це відбувається в клітинах печінки, міокарда й скелетної мускулатури. Гідрокарбонат легко дифундує з внутрішньоклітинного простору в міжклітинний матрикс, а звідти — у кров. У зв’язку із цим виникла оригінальна ідея — використати природні біохімічні процеси для підвищення ємності гідрокарбонатного буфера. Для цього було запропоновано вводити в кров лактат або ацетат у вигляді відповідних солей. Перевагу цього способу вбачали в тому, що ендогенний гідрокарбонат, який утвориться в тканинах, повинен діяти більш плавно й більш тривало. Перші досліди підтвердили це припущення, що послужило поштовхом до створення різноманітних інфузійних розчинів, які містять той чи інший органічний аніон. Склад основних з них порівняно з плазмою наведено в табл. 2.
/39.jpg)
Перераховані в табл. 2 розчини мають подібну фармакодинаміку — вони регулюють кислотно-лужну рівновагу, нормалізують водно-електролітний баланс, мають дезінтоксикаційну дію, збільшують діурез. Спектр їх застосування є досить широким: ацидоз, відновлення об’єму позаклітинної рідини в разі крововтрати й шоку; при травмах, блюванні та поносах; опіках і перитоніті, тяжких формах інфекційних захворювань з наявними мікроциркуляторними розладами.
Протягом десятиліть лактат залишався одним з найбільш популярних органічних аніонів. Він входить до складу багатьох інфузійних препаратів, зокрема до розчину Рінгера лактат (розчину Хартмана). Однак сьогодні сформувалося критичне ставлення до використання лактату, особливо в тяжкохворих пацієнтів з підвищеною концентрацією лактату в плазмі крові.
Доцільно розглянути метаболізм лактату.
У процесі основного обміну міокард, м’язи, еритроцити та слизова оболонка кишечника продукують приблизно 1 ммоль лактату на 1 кг маси тіла за годину, і понад половину цієї кількості метаболізується в печінці (неушкодженій) [17].
CH3–CHOH–COOH + 3O2 ↔ 2CO2 + 2H2O + NaHCO3.
На метаболізм кожного моля лактату використовується 3 моля О2. В експериментальних тварин після введення лактату різко збільшувалася потреба в кисні. Є дані, що швидкість метаболізму лактату становить близько 450 ммоль/год. Приблизно 20 % виробленого лактату (ендогенного) використовується в процесі глюконеогенезу, а 80 % окислюється. Коли лактат вводити ззовні (екзогенний лактат), то до 70 % його може використовуватись як субстрат для глюконеогенезу [18]. Рівень глікемії після введення лактату може збільшуватись досить суттєво. Так, наприклад, введений інтраопераційно розчин Рінгера лактат може спричинити двократне збільшення концентрації глюкози в діабетиків. Внутрішньопечінковий глюконеогенез зупиняється падінням рН нижче від 7,1 або збільшенням дефіциту основ (ВЕ до –15 ммоль/л). Наявна або виникаюча печінкова дисфункція швидко веде до збільшення лактатемії (до 8 ммоль/л), що асоціюється з високим рівнем смертності. Вихідна концентрація лактату в плазмі має високе прогностичне значення відносно рівня смертності пацієнтів з різними типами шоку, включаючи кардіогенний та септичний шок.
Швидкість метаболізму лактату (переважно в печінці) є важливим критерієм оцінки тактики лікування хворих відділень інтенсивної терапії. Тобто введення інфузійних розчинів, що містять лактат, фальсифікує одержані дані й виключає використання показника рівня лактату в плазмі як маркера гіпоксії.
У той же час, на думку деяких дослідників, небезпеки, пов’язані з уведенням розчинів лактату, є дещо перебільшеними. По-перше, слід пам’ятати, що у зразках крові, отриманих з катетера, який використовували для вливань розчину Рінгера лактат, часто визначали спотворені та артефактні (часто завищені) показники рівня лактату [16]. Тому для більш точного визначення цього показника як важливого маркера стану пацієнта кров у таких хворих потрібно забирати з іншої вени.
По-друге, відомо, що у здорових людей переливання 1 л розчину Рінгера лактат протягом 1 год не підвищує рівня сироваткового лактату [14]. У хворих, які перебувають у критичному стані та мають знижений кліренс лактату через гіповолемічний шок або печінкову недостатність, ефект інфузії розчину Рінгера лактат невідомий. Проте при нульовому кліренсі лактату, якщо до 5 л об’єму циркулюючої крові додати 1 л Рінгера лактат (для чого потрібно внутрішньовенно перелити близько 4 л розчину), рівень сироваткового лактату збільшиться на 4,6 ммоль/л [14]. Отже, з огляду на те, що лише 25 % кристалоїдного розчину залишається в судинному руслі, введення помірних доз розчинів, що містять лактат, не може значно змінити вміст лактату в сироватці навіть у хворих із порушеним кліренсом лактату.
Отже, можна констатувати, що на сьогодні існують різні погляди на застосування препаратів, які містять лактат. На нашу думку, у разі виникнення у хворого стану, небезпечного щодо розвитку лактатацидозу, особливо лактатацидозу типу А (інфаркт міокарда, дихальна недостатність, шок, сепсис), необхідно обмежити застосування препаратів, що містять лактат. У разі необхідності корекції ацидозу в таких пацієнтів доцільно використовувати препарати, що містять інші органічні аніони — ацетат або малат.
Так, відомо, що для метаболізму ацетату споживається 2 моля О2 на кожний моль ацетату, що вигідно його відрізняє від лактату. Усі тканини мають ферменти, що необхідні для метаболізму ацетату, насамперед м’язи, міокард, печінка й нирки. Наприклад, серце (масою 300 г) окисляє приблизно 3 ммоля ацетату за хвилину.
Метаболізм ацетату не змінюється в пацієнтів з діабетом, при цьому не виникає змін концентрації глюкози та інсуліну. Ацетат є джерелом енергії, постачаючи 209 ккал/моль. Наведені факти дають підставу стверджувати, що ацетат у цілому має значні переваги порівняно з іншими органічними аніонами [10].
Метаболізм малату (аніона яблучної кислоти) менше висвітлений у літературі порівняно з ацетатом. При значенні рН 7,4 у пацієнта весь малат присутній у вигляді бівалентного аніона (малат2–), тому на кожний моль окислюваного малата виходить 2 моля бікарбоната (НСО3–). В результаті його залужнююча дія значно повільніша, ніж в ацетату, що може бути цілком бажаним у разі використання малату разом з ацетатом.
Прикладом сучасного збалансованого електролітного розчину є стерофундин ізотонічний. На відміну від розчинів Рінгера або Рінгера лактат стерофундин ізотонічний містить аніони ацетату й малату, що в ролі бікарбонатних попередників протистоять розвитку гіперхлоремічного ацидозу й підтримують метаболічні витрати, зокрема кисню, на низькому рівні. При цьому вказаний процес не залежить від функціонального стану печінки, тому що метаболізм ацетату й малату відбувається переважно в м’язовій тканині.
Заради справедливості слід відзначити, що концентрація малату в стерофундині майже в 5 разів менша, ніж концентрація ацетату (5 проти 24 ммоль/л). Тому як донор органічних аніонів малат відіграє в цьому препараті дуже незначну роль, а основний внесок у створення «резервної лужності» робить інший органічний аніон — ацетат, що вже давно й добре працює в цій ролі як складова частина вітчизняного препарату ксилат.

/36.jpg)
/39.jpg)