Статтю опубліковано на с. 51-57
Проблема інтенсивної терапії пацієнтів із черепно-мозковою травмою (ЧМТ) лишається вкрай актуальним питанням сучасної медицини. Перш за все це пояснюється тим, що, згідно з даними Всесвітньої організації охорони здоров’я, ЧМТ як причина смерті населення у світі посідає третє місце, поступаючись лише серцево-судинним та онкологічним захворюванням. У загальній структурі травм травматичні ушкодження головного мозку (ГМ) становлять близько 30–40 % і займають перше місце за показниками летальності та інвалідизації пацієнтів працездатного віку [1].
Кількість випадків ЧМТ щороку становить 2–7 на кожні 1000 осіб. За тяжкістю ушкоджень 85–90 % травмованих мають ЧМТ легкого ступеня, 5–10 % — среднього ступеня тяжкості, а близько 5 % становлять пацієнти з тяжкою ЧМТ. Летальність серед даної категорії хворих коливається в значних межах і залежить від рівня соціально-економічного розвитку країни (від 1,3–4,9 до 50 % і більше у хворих із тяжкими ушкодженнями ГМ). У середньому 5 % пацієнтів, які вижили після ЧМТ, лишаються інвалідами, що проявляється руховими порушеннями, загальмованістю, поганою пам’яттю, порушенням концентрації уваги, емоційною лабільністю, підвищеною збудливістю, дратівливістю, агресивністю поведінки та депресією [2–4]. Згідно з даними американської статистики, тяжка травма є провідною причиною смерті серед молодого населення чоловічої статі (до 45 років), щорічно в США реєструють близько 1,6 млн випадків ЧМТ, з яких майже у 260 тис. випадків постраждалі госпіталізуються, близько 60 тис. помирають ще до надання стаціонарної допомоги, а у 85 тис. травмованих встановлюється тривала інвалідність [5].
Смертність від травми серед пацієнтів молодого та молодшого середнього віку перевищує смертність внаслідок серцево-судинних захворювань в 10 разів, а від раку — у 20 разів. При цьому майже у половині випадків із летальним кінцем причиною смерті внаслідок травматичного ураження є ушкодження ГМ. Причинами тяжкої ЧМТ найчастіше є автомобільні аварії, побутовий і виробничий травматизм, а також для нашої країни на сьогодні — це травматизм, пов’язаний із проведенням військових дій на Сході.
Протягом перших хвилин і годин після тяжкої ЧМТ допомогу постраждалим у більшості випадків надають лікарі бригад швидкої допомоги, а в приймальних відділеннях стаціонарів — хірурги (часто загального профілю), травматологи та анестезіологи [6–8]. І лише в невеликій кількості спеціалізованих центрів травми та лікувальних закладах ІІІ рівня (обласні лікарні) пацієнтам із тяжкою ЧМТ надається спеціалізована медична допомога за участю нейрохірурга [9].
Щороку в Україні внаслідок ЧМТ гине майже 11 тис. осіб, що становить у середньому 2,4 особи на 10 тис. населення, з них близько 55 % помирають на догоспітальному етапі, 41 % — на госпітальному [4, 9, 10].
Обсяг і характер лікувальних заходів визначаються тяжкістю ЧМТ, ступенем вираженості набряку ГМ і внутрішньочерепної гіпертензії, порушень мозкового кровообігу, ліквороциркуляції, метаболізму мозку та його функціональної активності, а також супутніми ускладненнями вегетовісцеральних реакцій, віком постраждалого й іншими факторами.
Незважаючи на те, що в провідних клініках світу накопичений колосальний досвід лікування хворих із ЧМТ, включаючи використання сучасних засобів і методів клінічної медицини, показники летальності та інвалідизації серед даної категорії пацієнтів дотепер все ще лишаються високими і не мають стійкої тенденції до суттєвого зниження. Це свідчить про те, що окремі повідомлення щодо досягнутого прогресу в поліпшенні статистичних показників результатів лікування хворих із нейротравмою, як правило, не виходять за рамки природних імовірних коливань результатів [11].
Крім того, весь арсенал сучасної медицини не дає чіткого та певного стандартизованого підходу до лікування та ведення хворих із тяжкою ЧМТ. Розширення можливостей в обстеженні та поява нових препаратів призводять до постійної зміни підходів до лікування пацієнтів із ЧМТ і пошуку нових засобів інтенсивної терапії, що базувались би на основах доказової медицини. Тому такі міжнародні організації, як National Institute for Clinical Excellence (NICE) та Brain Trauma Foundation (BTF), регулярно публікують протоколи та рекомендації щодо надання невідкладної допомоги при травматичних ушкодженнях, у тому числі при ЧМТ. Ці протоколи та рекомендації базуються на багатоцентрових проспективних рандомізованих дослідженнях, що містять чіткі положення, показники та цілі інтенсивної терапії [10, 12–14]. Узагальнені ключові аспекти інтенсивної терапії пацієнтів із ЧМТ наведені нижче.
1. Артеріальний тиск і оксигенація
Артеріальний тиск (АТ) необхідно постійно моніторувати, не допускаючи артеріальної гіпотензії (САТ не менше 90 мм рт.ст.), систолічний АТ не менше 120 мм рт.ст. Не допускається гіпоксемія (PaO2 < 60 мм рт.ст. або насичення гемоглобіну артеріальної крові киснем SpO2 < 90 %).
2. Гіперосмолярна терапія
Манітол ефективний для контролю підвищеного внутрішньочерепного тиску (ВЧТ) і застосовується в дозі від 0,25 г/кг до 1 г/кг маси тіла. Використання манітолу для контролю рівня ВЧТ повинно бути обмежене випадками наявності у пацієнта ознак транстенторіального вклинення або прогресуючого неврологічного погіршення, не пов’язаного з екстракраніальними причинами.
3. Профілактична гіпотермія
Підсумовані дані свідчать про те, що профілактична гіпотермія асоціюється з незначним зниженням смертності порівняно з нормотермічним контролем. Попередні дані свідчать про те, що більш значуще зниження смертності відзначається, якщо цільова температура підтримується протягом понад 48 годин. Профілактична гіпотермія асоціюється з більш високими показниками за шкалою коми Глазго (ШКГ) порівняно з нормотермічним контролем.
4. Профілактика інфекцій
При інтубації трахеї повинні призначатись антибактеріальні препарати для того, щоб знизити ризик розвитку пневмонії. Однак це не зменшує тривалості госпіталізації або смертності.
За умови необхідності проведення тривалої штучної вентиляції легенів (ШВЛ) слід виконувати ранню трахеостомію, що дозволяє знизити тривалість штучної вентиляції та зменшити рівень анальгоседації пацієнтів із ЧМТ і ризик розвитку нозокоміальної пневмонії. Однак цей захід не впливає на смертність.
Рутинна переустановка вентрикулярних катетерів або профілактичне призначення антибіотиків з метою зниження ризику інфекції при накладанні вентрикулярного катетера не рекомендується.
5. Профілактика тромбозу глибоких вен
Рекомендується використовувати панчохи з градуйованою компресією або чобітки з переміжною пневматичною компресією якщо для цього немає протипоказань (перелом кісток гомілки). Використання має починатись з перших годин від часу отримання травми та продовжуватись до виписки пацієнта зі стаціонару.
Низькомолекулярні гепарини або низькі дози нефракціонованого гепарину можуть використовуватись разом із механічною профілактикою за умови надійного контролю за кровотечею.
6. Внутрішньочерепний тиск
6.1. Показання для моніторингу внутрішньочерепного тиску
Моніторинг ВЧТ повинен проводитися в усіх пацієнтів (крім інкурабельних випадків) із тяжким травматичним ушкодженням ГМ (оцінка за ШКГ від 3 до 8 балів після початкової рідинної ресусцитації).
Моніторинг ВЧТ показаний пацієнтам із ЧМТ, у яких не було виявлено суттєвих змін на комп’ютерній томографії (КТ) у випадках, якщо пацієнт відповідає двом або більше з таких ознак: вік понад 40 років, одно- або двосторонній руховий дефіцит або САТ менше 90 мм рт.ст.
6.2. Технології моніторингу внутрішньочерепного тиску
При існуючій у наш час технології вентрикулярний катетер, приєднаний до зовнішнього монітора прямого вимірювання, є найбільш зручним і доступним методом моніторингу ВЧТ. Вимірювання рівня ВЧТ за допомогою фіброоптичних пристроїв або пристроїв із датчиком мікродеформації, встановлених у вентрикулярний катетер, може мати ті ж переваги, але ці пристрої мають більш високу вартість.
Паренхіматозні датчики ВЧТ не можуть бути рекалібровані в процесі моніторингу. Паренхіматозні датчики, в яких використовується датчик мікродеформації, мають незначний дрейф даних, що не залежить від тривалості моніторингу.
Субарахноїдальні, субдуральні та епідуральні датчики (з гідравлічним з’єднанням або пневматичні) менш точні.
6.3. Пороги внутрішньочерепного тиску
Невідкладні заходи інтенсивної терапії повинні розпочинатись при стійкому (понад 10–15 хв) наростанні ВЧТ понад 20 мм рт.ст. Необхідність початку та заходів інтенсивної терапії повинна визначатися за рівнем ВЧТ, клінічною картиною і даними КТ. Згідно з нашим власним досвідом, що включає понад 150 пацієнтів із тяжкою ЧМТ, запровадження моніторингу ВЧТ і його адекватна своєчасна корекція дозволили досягти зменшення летальності хворих із тяжкою ЧМТ протягом останніх 8 років на 7 %.
6.4. Алгоритм заходів щодо зниження ВЧТ:
— проведення ШВЛ із піднятим головним кінцем ліжка на 30–45°;
— підбір адекватного та комфортного для пацієнта режиму ШВЛ;
— анальгоседація з використанням препаратів короткої дії (фентаніл, пропофол);
— застосування осмотичних діуретиків (маніт у дозі 0,25–1 г/кг);
— широка декомпресійна трепанація черепа.
7. Пороги церебральної перфузії
Використання агресивних заходів для підтримки церебрального перфузійного тиску (ЦПТ) вище 70 мм рт.ст. за допомогою інфузійної терапії та вазопресорів слід уникати. Цільові показники ЦПТ знаходяться в межах 65–75 мм рт.ст.
8. Моніторинг оксигенації головного мозку та порогові значення
Сатурація гемоглобіну в яремній вені або моніторинг оксигенації тканини мозку є показниками церебральної оксигенації. Насичення гемоглобіну венозної крові киснем (в яремній вені) < 50 % або напруження кисню тканин мозку менше 15 мм рт.ст. є критичними пороговими значеннями.
9. Анестезуючі, аналгетичні та седативні засоби
Високі дози барбітуратів рекомендуються для контролю підвищеного ВЧТ, рефрактерного до максимального стандартного медикаментозного та хірургічного лікування. До і під час лікування барбітуратами необхідна стабільність гемодинаміки. Профілактичне призначення барбітуратів до рівня ізолінії (burst suppression) ЕЕГ не рекомендується.
Пропофол застосовується для контролю ВЧТ, але не призводить до зниження летальності або поліпшення показників результатів лікування до 6 місяців. Високі дози та тривале введення пропофолу можуть призвести до серйозних ускладнень (синдром тривалої інфузії пропофолу).
10. Нутритивна підтримка
Розпочинати проведення нутритивної підтримки слід із перших 24–48 годин від часу госпіталізації. Пацієнти з тяжкою ЧМТ повинні отримувати харчування, що забезпечує повний калораж до сьомого дня від моменту травми. Орієнтовна потреба в нутрієнтах становить 25–30 ккал/кг/добу. Перевагу слід надавати ентеральному шляху введення нутрієнтів, за умови неможливості повністю забезпечити нутритивні потреби хворого за рахунок ентерального харчування (менше 60 % розрахункової потреби) слід застосовувати допоміжне парентеральне харчування.
11. Профілактика судом
Профілактичне використання фенітоїну або вальпроату не рекомендоване для запобігання вторинним посттравматичним судомам. Антиконвульсанти показані для зменшення частоти ранніх посттравматичних судом (протягом 7 днів після травми). Однак ранні посттравматичні судоми не пов’язані з погіршенням результату.
12. Гіпервентиляція
Профілактична гіпервентиляція (PаCO2 менше 30 мм рт.ст.), не рекомендується. Нетривала гіпервентиляція допустима як тимчасовий захід для зниження підвищеного ВЧТ. Слід уникати гіпервентиляції в перші 24 години після травми, оскільки церебральний кровотік у цей період часто буває критично знижений.
При використанні гіпервентиляції рекомендується контролювати доставку кисню, визначаючи кисневу сатурацію крові в яремній вені (SjO2) або напруження кисню в тканинах мозку (PbrO2).
13. Застосування стероїдів
Використання стероїдів не рекомендується для поліпшення результату або зниження ВЧТ у хворих із тяжкою ЧМТ. У хворих із помірним або тяжким травматичним ушкодженням мозку використання високих доз метилпреднізолону пов’язано зі збільшенням рівня смертності та протипоказано.
При проведенні аналізу прийнятих стандартів, методик, досліджень і публікацій щодо лікування пацієнтів із ЧМТ можна зробити висновки, що саме лікарі практичної ланки найчастіше приймають рішення про розширення загального переліку застосування фармацевтичних препаратів із метою пошуку оптимальної схеми інтенсивної терапії та покращення результатів лікування даної категорії пацієнтів. Часто це є особистим вибором лікаря, що ґрунтується на його власній думці та досвіді, а також бажанні порівняння ефективності тієї або іншої групи препаратів.
Поява в арсеналі лікаря інтенсивної терапії нових препаратів, що не входять у загальноприйняті в країнах Західної Європі та Америки стандарти, дозволила впливати на тривалість терапії пацієнта в умовах відділення реанімації й інтенсивної терапії (ВРІТ) у бік зменшення кількості ліжко-днів, знизити смертність і відсоток інвалідизації. Це було досягнуто завдяки еволюції препаратів, що належать до так званої групи нейропротекторів. Це формулювання прийняте в країнах пострадянського простору і, можливо, має право на існування. Хоча в АТС-класифікації лікарських засобів такої групи немає, і всі вони входять до групи препаратів, що діють на нервову систему.
Також немає ґрунтовної міжнародної доказової бази ефективності лікарських засобів, які лікарі зараховують до нейропротекторів.
За останні 20–25 років отримано великий клінічний досвід застосування різних препаратів, які належать до групи нейропротекторів, що дозволило порівняти їх ефективність, а також оцінити можливість застосування на різних стадіях інтенсивної терапії ЧМТ, їх вплив на динаміку реабілітації пацієнтів із травматичними ушкодженнями ГМ.
У практиці лікаря інтенсивної терапії зустрічаються пацієнти, які не входять за своїм станом у певний стандарт перебігу патології. Таким прикладом може бути так званий «вегетативний стан», при якому свідомість або розуміння навколишнього відсутні, в той час як триває автономна діяльність стовбура мозку і може зберігатися цикл «сон/пильнування».
Застосування всього арсеналу препаратів, які впливають на метаболізм мозку, не дає відчутного ефекту, що клінічно визначається відсутністю неврологічного відновлення. Пацієнти, незважаючи на весь використаний арсенал препаратів, не «хочуть» самостійно дихати та потребують ШВЛ більший період часу, ніж очікує лікар інтенсивної терапії. Пояснення проблеми відсутності позитивної неврологічної динаміки виявилось пов’язаним із виникненням нейромедіаторної недостатності, що може розвиватися у пацієнтів із тяжкими ушкодженнями ГМ.
Пригнічення свідомості відбувається в декілька етапів і діагностується практичними лікарями в першу чергу за допомогою ШКГ. Також у практичній та науковій діяльності використовуються й інші оцінки рівня тяжкості стану хворого з ЧМТ.
Вихід хворого зі стану пригнічення свідомості різного рівня тяжкості має певну стадійність і супроводжується різноманітними синдромами відновлення психічної діяльності, що залежать від об’єму та локалізації ушкодження мозку, супроводжуються специфічними синдромами порушення нервової діяльності.
На етапі відновлення можливий розвиток різних видів нейромедіаторної недостатності. Варіант розвитку дисбалансу нейромедіаторів неможливо прогнозувати. Він пов’язаний із патологічним процесом, що виникає в результаті «нейромедіаторної бурі». Дослідження показали, що на фоні церебральної катастрофи спостерігається збільшена продукція нейромедіаторів, що корелює з погіршенням прогнозу виживання хворого із ЧМТ. Найбільш виражений ушкоджуюючий ефект властивий глутамату. Це призводить до розвитку ексайтотоксичності — патологічного процесу, що веде до ушкодження та загибелі нервових клітин під впливом нейромедіаторів, здатних гіперактивувати NMDA- та AMPA-рецептори. При цьому надмірне надходження іонів кальцію в клітину активує ряд ферментів (фосфоліпази, ендонуклеази, протеази), що руйнують цитозольні структури і призводять до запуску апоптозу клітини. Тому медикаментозне пригнічення NMDA-рецепторів (один із напрямків метаболічного захисту мозку) вважається однією з основних ланок нейропротекторної терапії [16].
При зменшенні рівня гостроти патологічного процесу «нейротрансмітерна буря» змінюється на «медіаторне виснаження», що має різні клінічні прояви, які необхідно не тільки правильно диференціювати, але і використовувати відповідні препарати для корекції цих станів. Основними проявами медіаторного виснаження є недостатність дофамінергічної та холінергічної систем. У пацієнтів із ЧМТ прогнозувати розвиток того чи іншого виду нейромедіаторної недостатності неможливо, діагностика нейромедіаторної недостатності проводиться клінічно.
Ознаками дофаминергічної недостатності є збільшений м’язовий тонус, спастичний гемі-/тетрапарез, тризм, ан-/дизартрія, блокада довільної активності, гіперсалівація, сальність шкіри [17].
Ознаками холінергічної недостатності є зниження м’язового тонусу, дифузне зниження чутливості, сухість шкіри та слизових оболонок, послаблення моторики шлунково-кишкового тракту [17].
Правильна діагностика нейромедіаторної недостатності дозволить ефективно визначити та проводити адекватні лікувальні заходи з урахуванням можливості впливу на глутаматний каскад розвитку ексайтотоксічності, подальшої корекції нейромедіаторної недостатності в гострому періоді ЧМТ і впливати на динаміку регресу неврологічної симптоматики.
Одним із перспективних напрямків постішемічної корекції церебрального гомеостазу може бути застосування препаратів, дія яких спрямована на переривання швидких реакцій глутамат-кальцієвого каскаду. До препаратів із глутамат-блокуючою дією належить оригінальний амантадину сульфат (ПК-Мерц®), зареєстрований як протипаркінсонічний засіб. Амантадин — неконкуруючий антагоніст дофамінових і NMDA-рецепторів, що збільшує вміст дофаміну в смугастому тілі, застосовується поряд з іншими препаратами для покращення когнітивних функцій при вегетативному статусі та синдромі «малої свідомості» [8].
На фоні коматозного стану виснажуються резерви ендогенного дофаміну, що клінічно проявляється брадикінезією та низьким когнітивним рівнем. Подальше відновлення свідомості та рухової активності залежить від темпу відновлення концентрації дофаміну. Амантадин не тільки здатний активно стимулювати виділення дофаміну з нейрональних депо, підвищувати чутливість дофамінергічних рецепторів до дофаміну, але і нормалізувати нейрофізіологічні інтрацеребральні процеси, разом із тим має стабілізуючу дію на специфічні глутаматергічні рецептори, перериваючи наростання глутаматного викиду та пригнічуючи глутаматну ексайтотоксичність, яка запускає патобіохімічні механізми постішемічного каскаду [8].
У численних дослідженнях для лікування хворих із тяжкими ураженнями мозку, які перебувають у вегетативному стані або в стані «малої свідомості», теоретично обґрунтована доцільність застосування антагоністу глутаматних NMDA-рецепторів [4, 16, 18, 19].
У практиці лікаря інтенсивної терапії інколи виникає необхідність приймати рішення про використання препаратів, що не входять до світових стандартів, однак їх застосування в комплексному лікуванні обґрунтовано досвідом, що представлений у світовій фаховій літературі, та не має прямих протипоказань для використання.
Враховуючи широкий досвід використання препарату ПК-Мерц® у хворих на ЧМТ, нами було прийнято рішення про застосування оригінального амантадину сульфату у вигляді інфузійного розчину у хворих із тяжкою ЧМТ, які перебували на лікуванні у ВРІТ Київської міської клінічної лікарні (КМКЛ) № 17.
Клінічний випадок 1
Пацієнт Л., 42 роки, госпіталізований 01.08.2015 р. із діагнозом: «Поєднана травма. ЗЧМТ. Удар головного мозку середнього ступеня тяжкості. Удар скронево-тім’яної ділянки головного мозку праворуч. Перелом скроневої і тім’яної кістки зліва з переходом на піраміду скроневої кістки. Перелом луски скроневої кістки справа, стінки основної пазухи. Удар нижніх часток обох легень».
Висновок: СКТ-картина епідуральної гематоми лівої гемісфери мозку; вогнища удару скроневої частки справа; САК; компресійно-дислокаційний синдром; перелом луски скроневої кістки справа, перелом тім’яної кістки і піраміди скроневої кістки справа.
За невідкладних показань проведено оперативне втручання: кістково-пластична трепанація черепа зліва. Видалення гострої епідуральної гематоми зліва обсягом близько 200 мл.
Після переведення до ВРІТ було призначено таке лікування:
1. Респіраторна терапія у вигляді ШВЛ через оротрахеальну інтубаційну трубку апаратом Drager Carina в режимі РС АС.
2. Постійна аналгезія фентанілом зі швидкістю 100–150 мкг/год.
3. Додаткова седація (Na оксибутират, сибазон за необхідності).
4. Антибіотикопрофілактика (цефтріаксон 1 г двічі на добу, метронідазол 100 мл тричі на добу).
5. Блокатори протонної помпи (пантопразол 40 мг/добу).
6. Зондове ентеральне харчування збалансованими ізокалоричними сумішами в обсязі близько 2000–2500 мл.
7. Інфузія ПК-Мерц® в обсязі 200 мг/добу протягом 5 діб.
Враховуючи рівень свідомості пацієнта — 6 балів за ШКГ, об’єм епідуральної гематоми, необхідність впливу на глутаматну активність у межах ушкодження та забезпечення відновлення свідомості, використання інфузії ПК-Мерц® було обґрунтованим. Препарати, що впливають на метаболізм ГМ (похідні холіну, церебролізин, актовегін) не призначали.
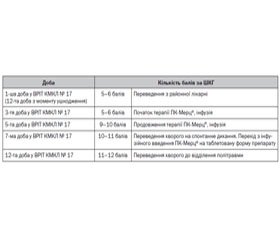
Зважаючи на рівень свідомості пацієнта на 6-ту добу з моменту травми (10–11 балів за ШКГ), інфузійне введення ПК-Мерц® було припинено. Необхідності переведення на таблетовану форму не було через позитивну динаміку відновлення свідомості з мінімальним рівнем неврологічної недостатності (табл. 1).
Виписаний зі стаціонару на 14-ту добу. Рівень свідомості за ШКГ — 15 балів.
Клінічний випадок 2
Пацієнт О., 44 роки, переведений з районної лікарні 13.08.2015 р. із діагнозом: «ВЧМТ. Перелом склепіння та основи черепа. Забій головного мозку тяжкого ступеня. Масивний САК. ЗТГ. Перелом 4–5-го ребер зліва. Забій лівої легені. Лівобічний гідропневмоторакс. Перелом кісток носа. Травма отримана 01.08.2015 р. У районній лікарні отримував терапію (за даними виписки): антибіотикотерапія (левофлоксацин, меропенем), судино- та церебропротекторна терапія (цитофлавін, холіну альфосцерат, цитиколін, актовегін). На час переведення до КМКЛ № 17 (12 діб із часу отримання травми) позитивна неврологічна динаміка відсутня, рівень свідомості за ШКГ становив 5–6 балів.
Після переведення до ВРІТ була призначена така терапія:
1. Респіраторна терапія у вигляді ШВЛ через оротрахеальну інтубаційну трубку апаратом Drager Carina в режимі РС АС/РС ВiPAP.
2. Знеболювання (декскетопрофен).
3. Профілактика тромбоемболічних ускладнень (беміпарин 3500 Од/добу).
4. Антибіотикотерапія (цефоперазон/сульбактам 2 г двічі на добу).
5. Блокатори протонної помпи (пантопразол 40 мг/добу).
6. Зондове ентеральне харчування збалансованими ізокалоричними сумішами в обсязі близько 2000–2500 мл.
Маючи на увазі термін часу від отримання травми та недостатню ефективність препаратів, що впливають на неврологічний статус, у хворого припустили можливість розвитку нейромедіаторної недостатності. На користь дофамінергічної недостатності свідчили: відсутність позитивної неврологічної динаміки при попередньому використанні препаратів, що належать до групи холіноміметиків; наявність верхнього геміпарезу, збільшеного м’язового тонусу; блокада довільної активності.
До схеми лікування додавали інфузію ПК-Мерц® внутрішньовенно в обсязі 200 мг протягом 5 діб із подальшим призначенням таблетованої форми препарату по 200 мг на добу протягом 15 днів. Препарати, що впливають на метаболізм ГМ (похідні холіну, церебролізин, актовегін), не призначали. На 5-ту добу рівень свідомості становив 9–10 балів за ШКГ; переведення на спонтанне дихання на 7-му добу (10–11 балів за ШКГ); на 12-ту добу хворого переведено до відділення політравми (табл. 2).
Пацієнта виписано зі стаціонару на 21-шу добу з рівнем свідомості 15 балів за ШКГ.
Висновки
1. Високий рівень смертності при тяжких ушкодженнях ГМ, кількість післятравматичних ускладнень і тривалість реабілітації потребують високого рівня підготовки лікарів інтенсивної терапії та обґрунтованого використання всіх лікарських засобів. Ефективна терапія з моменту ушкодження ГМ дає можливість впливати на тривалість перебування хворого у ВРІТ і швидкість відновлення фізичного стану та когнітивних здатностей пацієнтів.
2. Беручи до уваги особливості перебігу ЧМТ, лікар має можливість використовувати препарати, що впливають на швидкість відновлення свідомості та фізичного стану пацієнта. Призначення таких препаратів повинно бути обґрунтованим і доцільним з урахуванням рівня ушкодження ГМ.
3. Варіанти розвитку нейромедіаторної недостатності необхідно прогнозувати та диференціювати, що дає можливість впливати на різні стани неврологічного дефіциту. З урахуванням патогенетичних етапів ушкодження ГМ при ЧМТ корекція глутаматної активності є обґрунтованою та повинна проводитись від моменту госпіталізації до стаціонару. Дофамінергічна недостатність потребує використання як інфузійної, так і таблетованої форми оригінального амантадину сульфату.
4. Власний досвід використання оригінального амантадину сульфату (ПК-Мерц®) в інфузійній і таблетованій формах доводить доцільність його використання у пацієнтів з ушкодженнями центральної нервової системи. ПК-Мерц® забезпечує можливість захисту клітин ГМ в умовах розвитку процесів ексайтотоксичності з моменту надходження хворого до стаціонару, а також при подальшому лікуванні впливає на дофамінергічну недостатність, що розвивається внаслідок нейромедіаторного дисбалансу у хворих із ЧМТ.
Список литературы
1. Черепно-мозговая травма: современные принципы неотложной помощи / Е.Г. Педаченко, И.П. Шлапак, А.П. Гук, М.М. Пилипенко. — К.: ВІПОЛ, 2009. — 215 с.
2. Педаченко Є.Г. Сучасні принципи та стан надання невідкладної допомоги при черепно-мозковій травмі в Україні // Український нейрохірургічний журнал. — 2005. — № 3. — С. 4-6.
3. Овсянников Д.М., Чехонацкий А.А., Колесов В.Н., Бубашвили А.И. Социальные и эпидемиологические аспекты черепно-мозговой травмы (обзор) // Саратовский научно-медицинский журнал. — 2012. — Т. 8, № 3. — С. 777-785.
4. Дзяк Л.А., Кобеляцкий Ю.Ю., Йовенко И.А., Царев А.В. Интенсивная терапия повреждений мозга и ранняя нейрореабилитация при политравме с превалированием тяжелой черепно-мозговой травмы. Опыт применения оригинального амантадина сульфата // Медицина невідкладних станів. — 2015. — № 8. — С. 57-65.
5. Langlois J.A. Traumatic brain injury in the United States: Emergency department visits, hospitalizations and deaths / J.A. Langlois, W. Rutland-Brown, K.E. Tomas. — Atlanta (GA): Centers for Disease Control and Prevention, National Center of Injury Prevention and Control, 2004.
6. Кардаш А.М., Черний В.И., Городник Г.А., Ботев В.С. Мониторинг и лечение тяжелой черепно-мозговой травмы // Український нейрохірургічний журнал. — 2014. — № 2. — С. 8-19.
7. Patel H.C., Menon D.K., Tebbs S., Hawker R., Hutchinson P.J., Kirkpatrick P.J. Specialist neurocritical care and outcome from head injury // Intensive Care Med. — 2002. — Vol. 28, № 5. — P. 547-553
8. Patel H.C., Bouamra O., Woodford M., King A.T., Yates D.W., Lecky F.E. Trends in head injury outcome from 1989 to 2003 and the effect of neurosurgical care: an observational study // Lancet. — 2005. — Vol. 366. — P. 1538-1544.
9. Дубров С.О. Організація надання невідкладної медичної допомоги постраждалим в дорожньо-транспортних пригодах та шляхи її оптимізації в Україні / Матеріали VI Національного конгресу анестезіологів України. — Україна, Львів, 18–21 вересня, 2013 р. // Біль, знеболювання і інтенсивна терапія. — 2013. — № 2-Д. — С. 150-155.
10. Зозуля І.С., Зозуля А.І. Невідкладна допомога при черепно-мозковій травмі відповідно до міжнародних стандартів // Острые и неотложные состояния в практике врача. — 2014. — № 5(49). — С. 6-7.
11. Курсов С.В., Лизогуб Н.В., Скороплет С.Н. Интенсивная терапия у больных с тяжелой черепно-мозговой травмой // Медицина неотложных состояний. — 2008. — № 2(15). — С. 44-49.
12. Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons; Joint Section on Neurotrauma and Critical Care, AANS/CNS. Guidelines for the management of severe head injury // J. Neurotrauma. — 2007. — 24(Suppl.). — S-1–S106.
13. Дубров С.О. Вплив трахеостомії та строків її виконання на тривалість відлучення від респіратора пацієнтів з тяжкою поєднаною травмою після проведення тривалої штучної вентиляції легень // Науковий вісник Національного медичного університету імені О.О. Богомольця. — 2009. — № 3. — С. 82-86.
14. Педаченко Є.Г., Гук А.П., Каджая Н.В. та ін. Сучасні принципи діагностики та лікування хворих із невідкладною нейрохірургічною патологією: Методичний посібник. — К.: Інститут нейрохірургії ім. А.П. Ромоданова АМН України, 2005. — 46 c.
15. Cook A.M., Peppard A., Magnuson B. Nutrition considerations in traumatic brain injury // Nutr. Clin. Pract. — 2009. — Vol. 23(6). — Р. 608-620.
16. Никонов В.В., Савицкая И.Б. Роль антагонистов глутаматных рецепторов (ПК-Мерц) в лечении повреждений мозга: обзор литературы // Медицина неотложных состояний. — 2012. — № 6(45). — С. 5-10.
17. Царенко С.В. Нейрореаниматология. Интенсивная терапия черепно-мозговой травмы. — М.: Медицина, 2006. — 352 с.
18. Белкин А.А., Щеголев А.В., Кондратьев А.Н. и др. ПК-Мерц при вегетативном статусе и «малом сознании» // Интенсивная терапия. — 2004. — № 1. — С. 15-19.
19. Saniova B., Drobny M. Biochemical and clinical improvement of cytotoxic state by amantadine sulphate // Cellular and Molecular Neurobiology. — 2006. — Vol. 26. — P. 1475-1482.

/55.jpg)
/56.jpg)