Статтю опубліковано на с. 75-82
Вступ
Відомо, що біль, який відчувала дитина в ранньому післяопераційному періоді, змінює розвиток системи ноцицепції і призводить до необоротних функціональних і структурних змін у ЦНС, чим змінює «програму» відповіді на біль у майбутньому [1]. Серед основних причин неадекватної аналгезії в післяопераційному періоді у дітей: відсутність загальновизнаних і простих методів оцінки тяжкості больового синдрому в педіатрії; використання переважно наркотичних анальгетиків; неможливість або обмеження використання ефективних сучасних методів післяопераційної аналгезії та переконання частини лікарів, що такі діти є менш чутливими до болю [1, 3]. У 2010 році в Німеччині проводилося дослідження якості післяопераційного знеболювання, в якому брали участь 25 клінік (2252 пацієнти). Дані були опублікувані в журналі Dtsch. Arstebl. Int. Дослідники дійшли висновку, що біль средньої та високої інтенсивності в спокої відчували 29,5 % пацієнтів, а при активації — понад 50 %, при цьому 55 % всіх пацієнтів були не вдоволені якістю знеболювання [3–7].
У 2013 році в журналі Anesthesiology «Pain Intensity on the First Day after Surgery» була опублікована стаття, в якій наведено дані щодо оцінки болю у 1-шу добу після операції в більше ніж 50 тисяч пацієнтів із 105 клінік Німеччини. Автори дійшли висновку, що, як це не дивно, але найвища інтенсивність болю була відзначена після операцій «низької» травматичності — холецистектомії, апендектомії, гемороїдектомії та ін. Травматичність цих операцій недооцінюється лікарями, відтак, пацієнтам приділяється мало уваги [3, 11].
Неадекватна аналгезія в ранньому післяопераційному періоді погіршує перебіг і прогноз цього періоду у дітей і збільшує рівень післяопераційних ускладнень та сприяє розвитку гіпералгезії. Гіпералгезія — це стан підвищеної чутливості до болю, який виникає внаслідок інтенсивної ноцицептивної стимуляції або може бути індукований опіоїдними анальгетиками [7, 9, 10, 14]. Гіпералгезія реалізується переважно на рівні спинного мозку й асоціюється зі збільшенням інтенсивості болю та, відповідно, розвитком стрес-відповіді на біль, підвищенням ризику хронізації болю, розвитком толерантності до опіоїдів та потребою у підвищенні доз [3, 5, 8]. Для діагностики гіпералгезії стандартно визначають больовий поріг за допомогою монофіламентів фон Фрея в зоні післяопераційної рани, використовуючи монофіламенти у зростаючому порядку до найменшої сили тиску, що сприймається досліджуваним як больове відчуття [4, 6].
Метод подовженої епідуральної анестезії та аналгезії частіше почав застосовуватися при проведенні оперативних втручань і для подальшого знеболювання хворих. Подовжена епідуральна анестезія дозволяє значно зменшити кількість препаратів, що вводяться як під час наркозу, так і в ранній післяопераційний період, що дуже важливо, зважаючи на супутню патологію у хворих старшого віку і поєднання хірургічного втручання із застосуванням поліхіміотерапії [1–4]. Подовжена епідуральна анестезія дозволяє відмовитися від уведення опіоїдних анальгетиків, а також значно прискорити процес відновлення перистальтики кишечника і початок раннього ентерального харчування, знизити частоту виникнення ускладнень, пов’язаних з оперативним втручанням [4, 6]. Анестезія поперечного простору живота (ТАР-блок) є новим підходом у блокуванні аферентних нервів передньої черевної стінки за допомогою введення місцевого анестетика в ділянку трикутника Petit. Для виконання цієї процедури зазвичай використовують анатомічні орієнтири і тактильні відчуття. У наш час доведено, що застосування УЗ-підтримки збільшує відсоток успіху блокади и практично виключає можливість ненавмисної пункції черевної порожнини [10, 11].
Метою цього дослідження було порівняння ефективності та безпеки застосування регіональної аналгезії за даними комплексної оцінки знеболювання при оперативних втручаннях з приводу пухлин черевної порожнини у дітей.
Матеріал і методи
Дослідження проведені у 62 дітей віком 14,2 ± 4,2 року, прооперованих з приводу пухлин черевної порожнини — 24 (38,7 %) дитини, пухлин заочеревинного простору — 38 (41,3 %) дітей. Залежно від методики знеболювання пацієнти були розподілені на дві групи: 1-ша група — 34 дитини знеболювали безперервною внутрішньовенною інфузією фентанілу; 2-га група — 28 дітей, яких знеболювали методом комбінованої регіональної аналгезії (ТАР-блок) бупівакаїном. Показаннями до введення додаткових болюсів анальгетиків були больова поведінка, десинхронізація зі штучною вентиляцією легень і тахікардія. Додатково болюсно вводили неопіодний анальгетик парацетамол (Інфулган, «Юрія-Фарм») у дозі 1,5 мл/кг, або 1,5 мг/кг.
Дизайн передбачав створення двох рандомізованих груп пацієнтів. Критеріями включення пацієнтів у дослідження були: згода пацієнта, вік 16–18 років, анестезіологічний ризик за ASA III–IV, відсутність іншого оперативного втручання в той же період або в період за 1 місяць до нинішнього оперативного втручання, відсутність супутніх некомпенсованих патологій інших систем чи органів. Критеріями виключення з дослідження були: алергія на локальні анальгетикі, наявність у пацієнта супутніх психіатричних захворювань, тривало існуючий больовий синдром, що не пов’язаний із планованою операцією. Досліджувані групи були порівнянні за статтю, віком, антропометричними даними, супутніми захворюваннями, обсягом і тривалістю оперативного лікування.
Всім хворим проводилось комплексне інтенсивне лікування: інфузійна та трансфузійна терапія, респіраторна підтримка апаратом Hamillton C2 — режим ASV за параметрами (FiO2, 30 %, PEEP 2 см H2О, PIP 15–20 см H2О), антибактеріальне лікування, посиндромна терапія. Пацієнту в ранньому післяопераційному періоді визначали периметр мінімального порогу болю навколо післяопераційної рани. Проекція лінії післяопераційної рани умовно розділялась на два рівні відрізки трьома точками, через які у 16 векторних напрямках, з кутом між ними в 45°, за допомогою набору з 10 каліброваних монофіламентів фон Фрея (VFMs) здійснювали тиск на шкіру зі зростаючою силою від 4 г (39.216 mN) до 300 г (2941.176 mN) (Touch-Test Sensory Evaluator, North Coast Medical Inc., CA, США), притискаючи монофіламенти у зростаючому порядку до поверхні шкіри під кутом 90°, доки останній не зігнеться, на 1–1,5 с. Між дослідженнями витримували адаптаційний інтервал в 10 с. Оцінка ефективності знеболювання в ранньому післяопераційному періоді проводилась за допомогою візуально-аналогової шкали (BPS), вивчались показники: внутрішньочеревного тиску (ВЧТ) методом Крона [6–8], абдомінального перфузійного тиску (АПТ), рівня кортизолу в крові, клініки післяопераційного знеболювання. Больовий поріг вимірювали на поверхні навколо післяопераційної рани. На 3-тю, 7-му та 14-ту добу хворим виконували біопсію ран — брали фрагменти шкіри з підлеглими тканинами в області рани, відступаючи від її меж на 0,5 см. Забраний матеріал фіксувався 10% водним розчином нейтрального формаліну протягом 48 годин, потім промивався проточною водою, в подальшому проводили його зневоднення у системі багатоатомних спиртів і заливку в парафін за стандартною схемою. Приготовані напівтонкі зрізи завтовшки 7–8 мкм забарвлювали гематоксиліном і еозином (основний метод забарвлення гістологічних препаратів) для оцінки патологічних змін і реакцій тканин у процесі виникнення та загоєння ран (оцінка стану та склад тканин у краях та дні рани, наявність і характер патологічних і репаративних змін у ній), характер порушень мікрогемоциркуляції. Також гістологічні препарати, виготовлені зі шматочків тканин, взятих на 14-ту добу експеримента, окрім традиційного методу забарвлення гематоксиліном та еозином, сріблили за методом Фута для визначення розвитку в тканинах у процесі загоєння ран дрібних нервових закінчень і патологічних їх змін. Мікроскопію гістологічних препаратів проводили за допомогою світлового мікроскопа OLIMPUS BX 41 із застосуванням збільшень у 40, 100, 200 та 400 разів. Додатково проводилась допплерометрія мезентеріального кровотоку в верхній мезентеріальній, нирковій та селезінковій артеріях. Дослідження проводились без попередньої підготовки хворого, апаратом LOGIQ BOOK-XP, з використанням конвексного датчика 3,5–5,0 МГц, мікроконвексного датчика 4–8 МГц у режимі реального часу з використанням дозованої компресії датчиком черевної стінки.
На основі оцінки допплерівського спектра визначали кількісні параметри кровотоку в артеріальних судинах: пікову систолічну швидкість кровотоку (Vps — peak systolic velocity) — максимальну швидкість кровотоку в досліджуваній судині, кінцеву діастолічну швидкість кровотоку (Ved — end diastolic velocity) — максимальну швидкість кровотоку в досліджуваній судині наприкінці діастоли, індекс периферичного опору (Pourcelot, RI — resistive index) — відношення різниці пікової систолічної і кінцевої діастолічної швидкості кровотоку до пікової систолічної швидкості: RI = (Vps – Ved/Vps). Дослідження проводились на таких етапах знеболювання: 1-й етап — 12-та година після оперативного втручання; 2-й етап — 24-та година піcля оперативного втручання; 3-й етап — 48-ма година піcля оперативного втручання; 4-й етап — 36-та година піcля оперативного втручання та 5-й етап — 72-га година піcля оперативного втручання.
Статистичну обробку отриманих даних проводили із застосуванням методів варіаційної статистики за допомогою програми Stаtistica 5.5 (належить ЦНІТ ВНМУ ім. М.І. Пирогова, ліцензійний № AXXR910A374605FA). Оцінювали та визначали середні значення, стандартні відхилення та похибки середнього. Вірогідність різниці значень між кількісними величинами в разі відповідності розподілів нормальному значенню визначали за допомогою критеріїв Стьюдента та Фішера. Вірогідними вважалися відмінності при р < 0,05.
Результати та обговорення
Пацієнтів 1-ї групи (n = 28) знеболювали безперервною внутрішньовенною інфузією фентанілу в дозі 10–20 мкг/кг/год (середня доза — 14,7 ± 1,4 мг/кг); хворих дітей 2-ї групи (n = 34) — методом комбінованої РА (ТАР-блок) бупівакаїном 0,375% (Лонгокаїн, «Юрія-Фарм»). У групі ТAP-блоку після наркозу було введено 10–20 мл 0,375% бупівакаїну в нейрон-фасціальний простір поперечного м’яза живота в ділянці трикутника Petit з обох сторін. Пункцію виконували голкою для спінальної анестезії G 22 (B. Braun). Для візуалізації структур и контролю просування голки використовували конвексний датчик 4–6 МГц (Logiq 100, GE, США) [9] [2–4]. Всім хворим за 30 хвилин до оперативного втручання вводився парацетамол (Інфулган, «Юрія-Фарм») у дозі 1,5 мл/кг, або 1,5 мг/кг.
У всіх пацієнтів рухова реакція на 6–12-ту годину після операції була вже на подразнення з силою тиску 8 або 10 г, що повністю співпадало з високою оцінкою за шкалою Behavioral Pain Scale (BPS) і становило понад 4 бали (5,2 ± 0,2 бала та 5,1 ± 0,3 бала). Це свідчило про знижений больовий поріг у хворих 1-ї групи (фентаніл) у ранньому післяопераційному періоді (табл. 1). Слід зазначити, що в 2-й групі (ТАР-блок) дані прояви значно зменшувались. Визначення зони периметру гіпералгезії на 3-тю та 5-ту добу в післяопераційному періоді показало значне зменшення площі гіпералгезії при використанні мультимодальної аналгезії з використанням ТAP-блоку, а саме з 98,2 ± 10, 4 см2 проти 123,4 ± 20, 4 см2 у групі фентанілу, що приблизно в 1,4 раза більше, ніж у 2-й групі (табл. 1).
/77.jpg)
Дослідження артеріального кровообігу у верхній брижовій та ниркової артеріях виявило високий індекс резистентності в 1-й групі — 0,98 ± 0,02 та 0,92 ± 0,05; відповідно, у 2-й групі — 0,74 ± 0,04 та 0,69 ± 0,04 (за нормою 0,6–0,8) (р < 0,05), що патогенетично відображає блокаду мікроциркуляторного русла і, як наслідок, неефективне знеболювання [7–9]. Така сама тенденція спостерігалась при дослідженні внутрішньочеревного тиску. Наприклад, в 1-й групі внутрішньочеревний тиск був значно вище порівняно з 2-ю групою (14,98 ± 4,02, у 2-й групі — 5,42 ± 2,2) після початку пролонгованої інфузії бупівакаїну (р < 0,05). Варто відзначити, що у пацієнтів 1-ї групи значно вищий абдомінальний перфузійний тиск (АПТ), ніж у пацієнтів 2-ї групи, — 64,8 ± 4,2, а у 2-й групі — 57,4 ± 6,4 (р < 0,05), що свідчить про нормалізацію внутрішньочеревного тиску і, можливо, адекватність знеболювання (табл. 2).
/78.jpg)
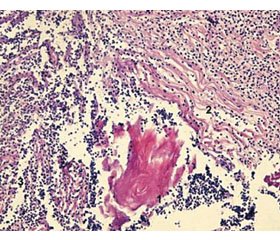
Через 3 доби після введення фентанілу у хворих 1-ї групи спостерігались певні морфологічні зміни у тканинах. Вони були більш виражені, ніж у хворих 2-ї групи. Зона ушкодження була дуже поширеною, без чітких меж, із розвитком некрозу у центрі (товщина шару некротизованих тканин становила до 5 мм), з вираженими перифокальними реактивними змінами у вигляді значного запалення (зона реактивних змін завтовшки до 7 мм), мали місце суттєві порушення мікроциркуляції. У дітей даної групи визначалась рана з глибоким дефектом тканин шкіри на глибину до 3/4 її об’єму. Краї рани були нерівні через навислі кінці потовщеного пласта епідерміса. Таке потовщення обумовлене проліферацією клітин епідерміса по краю рани та поблизу від неї. Це свідчить про високу мітотичну активність клітин базального шару епідерміса, що безпосередньо прилягає до рани (у зоні завширшки близько 1 мм). Пласт епідерміса в зоні ураження був з вираженими дистрофічними змінами у вигляді нерівномірного забарвлення ядер, балонної дистрофії їх, деякі епітеліоцити по самому краю перебували у стані некробіозу. Крайові відділи епідерміса дещо потовщені, з більш густим розташуванням ядер і дистрофічними змінами епітеліоцитів. Стінки рани практично не визначались, краї безпосередньо переходили в дно. Це обумовлено вибуханням збереженої сполучної тканини дерми та розширенням підлеглої гіподерми внаслідок контракції рани. Дно рани при цьому досить рівне, додатки шкіри в області дна відсутні. Дерма під епітелієм складалась із спрямованих у різних напрямках пучків колагенових та еластичних волокон. У власне дермі поза зоною запалення розташовувались додатки шкіри — волосяні фолікули, сальні та потові залози. Судини у дермі в зоні ураження навколо ранового каналу були паретично розширені, з вираженими дистрофічними змінами ендотелію, повнокровні, з крайовим стоянням лейкоцитів у них. Навколо додатків шкіри та периваскулярно визначались невеликі скупчення одноядерних клітин — лімфоцитів і клітин моноцитарного ряду з наявністю поодиноких лейкоцитів. Структура підлеглої гіподерми була порушена через вогнища некрозу та значну запальноклітинну інфільтрацію. У дермі та гіподермі спостерігалось накопичення набрякової рідини як один із проявів розладів мікрогемоциркуляції з розволокненням колагенових і еластичних волокон власне дерми. В набряковій рідині також зустрічались одноядерні клітини типу моноцитів крові, лімфоцитів, сегментоядерні лейкоцити у великій кількості. Також на 14-ту добу у дітей 1-ї групи в зоні формування рубцевої тканини відбувалось утворення дрібних нервових волокон, але в невеликій кількості. Мав місце виражений фіброз дерми з утворенням великої кількості колагенових волокон із набряком, розшаруванням їх. Визначалися значний периневральний набряк, фрагментація окремих нервових волокон (рис. 1).
У дітей, яких знеболювали методом комбінованої РА (ТАР-блок) бупівакаїном, на 3-тю добу експеримента у тканинах визначались нижченаведені патологічні зміни. Рана з дефектом тканин шкіри на глибину до гіподерми. Краї рани рівні, утворені шаром епідерміса, що переходив на стінки рани. Стінки рани розташовані практично під кутом 90 градусів, утворені тканинами власне шкіри. Дно рани було майже рівним. Зона ушкодження була тонка, без чітких меж, із розвитком у центрі її некрозу з перифокальними реактивними змінами у вигляді помірного запалення та незначних порушень мікроциркуляції. Товщина зони некрозу становила 0,1 мм, зони реактивних змін — до 2 мм. Епідерміс у зоні ураження також був із незначними дистрофічними змінами у вигляді нерівномірного забарвлення ядер, балонної дистрофії окремих ядер, деякі епітеліоцити по самому краю перебували у стані некробіозу. Крайові відділи епідерміса були дещо потовщені, з більш густим розташуванням ядер та дистрофічними змінами епітеліоцитів. Дерма під епітелієм складалась із спрямованих у різних напрямках пучків колагенових та еластичних волокон. У власне дермі розташовувались додатки шкіри — волосяні фолікули, сальні та потові залози. Розлади мікроциркуляції були мало виражені порівняно з такими у хворих 1-ї експериментальної групи. Судини у дермі в зоні ураження були дещо розширені, з незначними дистрофічними змінами ендотелію, помірно повнокровні, з крайовим стоянням лейкоцитів у деяких з них. Навколо додатків шкіри та периваскулярно визначались поодинокі одноядерні клітини — лімфоцити та клітини моноцитарного ряду з домішкою поодиноких лейкоцитів. Це пояснюється впливом бупівакаїну на мікроциркуляторне русло, що сприяло покращенню мікроциркуляції. Завдяки цьому у дермі та гіподермі спостерігалось незначне накопичення набрякової рідини (на відміну від дітей 1-ї групи) з незначним розволокненням колагенових і еластичних волокон власне дерми. В набряковій рідині також зустрічались одноядерні клітини типу моноцитів крові, лімфоцитів, поодинокі сегментоядерні лейкоцити (рис. 2).
/80.jpg)
Отже, ефективність використання РА та безперервної інфузії фентанілу ґрунтується на можливості впливу на різні механізми виникнення болю, як на центральний (наркотичні анальгетики), так і на периферичний [9]. Проведення РА дозволяє значно знизити потребу в опіоїдах, а їх комбінування може відновити аналгетичний потенціал останніх. Різні механізми дії даних препаратів дозволяють призначати їх у комбінації і в малих дозуваннях з метою досягнення значного аналгетичного ефекту. Слід зазначити, що використання РА сприяє повному розрішенню запалення та загоєнню рани з формуванням сполучнотканинного рубця, в якому спостерігаються процеси ремоделювання. У даній групі дітей в результаті розрішення запалення утворюється повноцінний рубець з додатками шкіри без запальних змін і розладів мікрогемоциркуляції з утворенням великої кількості дрібних нервових волокон без вираженого набряку та їх фрагментації.
Висновки
1. Комплексне вивчення реакцій больової поведінки, фізіологічних показників і лабораторних стресових тестів показало, що використання схеми комбінованої РА бупівакаїном 0,375% та безперервної внутрішньовенної інфузії фентанілу в дозі 10 мкг/кг/год для післяопераційного знеболювання призводить до ефективної аналгезії після травматичних онкологічних оперативних втручань.
2. Проведення мультимодальної аналгезії (РА та безперервна внутрішньовенна інфузія опіодних анальгетиків) значно зменшує негативні наслідки недостатнього знеболювання у дітей, прооперованих з приводу пухлин черевної порожнини, і можливе її застосування для ведення післяопераційного періоду.
3. Мультимодальна аналгезія (РА та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) покращує показники центральної та мезентеріальної гемодинаміки у дітей, прооперованих з приводу пухлин черевної порожнини, і, можливо, знижує ризик розвитку ускладнень у післяопераційному періоді.
4. Доведено що ранній післяопераційний період у дітей, прооперованих з приводу пухлин черевної порожнини, може призводити до розвитку гіпералгезії. Застосування схеми комбінованої РА бупівакаїном 0,375% та безперервної внутрішньовенної інфузії фентанілу в дозі 10 мкг/кг/год для післяопераційного знеболювання призводить до зменшення проявів гіпералгезії, а використання парацетамолу як додаткового знеболювання призводить до адекватного знеболювання та не впливає на розвиток гіпералгезії на відміну від наркотичних анальгетиків.
Список литературы
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. Региональная анестезия в педиатрии. — Синтез Бук, 2012. — 304 с.
2. Ветешев П.С., Ветешева М.С. Принципы анальгезии в раннем послеоперационном периоде // Хирургия. — 2002. — № 12. — С. 49-52.
3. Zoric S., Stamenkovic D., Stevanovic S. et al. Combined spinal epidural and general anesthesia in abdominal surgery // Med. Arh. — 2003. — Vol. 57(4). — P. 21-28.
4. Kopacz D.J., Allen H.W., Thompson G.E. A comparison of epidural levobupivacaine 0.75% with racemic bupivacaine for lower abdominal surgery // Anesth. Analg. — 2000. — Vol. 90. — P. 642-648.
5. Management of Postoperative Pain: A Clinical Practice Guideline From the American PainSociety, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists' Committee on Regional Anesthesia, Executive Committee, and Administrative Council / Chou R., Gordon D., de Leon-Casasola O. et al. // J. Pain. — 2016. — Vol. 17(2). — P. 131-57.
6. Baratta J., Schwenk E.S., Viscusi E.R. Clinical consequences of inadequate pain relief: barriers to optimal pain management / Baratta J., Schwenk E., Viscusi E. // Plast. Reconstr. Surg. — 2014. — Vol. 134(4). — P. 15-21.
7. Maier C., Nestler N., Richter H. The quality of postoperative pain management in German hospitals // Dtsch. Arstebl. Int. — 2010. — Vol. 107. — P. 607-614.
8. Hans J. Gerbershagen, Sanjay Aduckathil, Albert J.M. van Wijck, Linda M. Peelen, Cor J. Kalkman, Winfried Meissner. Pain Intensity on the First Day after Surgery A Prospective Cohort Study Comparing 179 Surgical Procedures // Anesthesiology — 04. 2013. — Vol. 118. — Р. 934-944.
9. Кучин Ю.Л., Глумчер Ф.С., Бєлка К.Ю. Опіоїд-індукована гіпералгезія під час анальгоседації у пацієнтів з черепно-мозковою травмою // Біль, знеболювання та інтенсивна терапія. — 2012. — № 1(Д). — С. 254-257.
10. Кучин Ю.Л. Стрес-індукована гіпералгезія у пацієнтів з множинною травмою // Біль, знеболювання та інтенсивна терапія. — 2013. — № 2(Д). — С. 262-266.
11. Angst M.S., Clark J.D. Opioid-induced hyperalgesia // Anesthesiology. — 2006. — Vol. 104. — P. 570-87.
12. Celerier E., Gonzalez J.R., Maldonado R. et al. Opioid-induced hyperalgesia in a murine model of postoperative pain: role of nitric oxide generated from the inducible nitric oxide synthase // Anesthesiology. — 2006. — Vol. 104(3). — P. 546-55.
13. Wilder-Smith O.H., Arendt-Nielsen L. Postoperative hyperalgesia: its clinical importance and relevance // Anesthesiology. — 2006. — Vol. 104(3). — P. 601-7.
14. Lavand`homme P., De Kock M., Waterloos H. Intraoperative epidural analgesia combined with ketamine provides effective preventive analgesia in patients undergoing major digestive surgery // Anesthesiology. — 2005. — Vol. 103(4). — P. 813-20.
15. Kopert W. The impact of opioid-induced hyperalgesia for postoperative pain // Best Practice & Research: Clinical Anaesthesiology. — 2007. — Vol. 21(1). — P. 65-83.
16. Lee M., Silverman S., Hansen H., Patel V., Manchikanti L. A comprehensive review of opioid-induced hyperalgesia // Pain Physician. — 2011. — Vol. 14(2). — P. 145-161.
17. Unal M., Gursoy S., Altun A., Duger C., Kol I.O., Kaygusuz K., Bagcivan I., Mimaroglu C. Ineffective doses of dexmedetomidine potentiates the antinociception induced by morphine and fentanyl in acute pain model // Korean J. Physiol. Pharmacol. — 2013. — Vol. 17(5). — P. 417-22.
18. Bi Y., Wang B., Yin Z., Zhang G., Chen H., Wang M. Effects of stellate ganglion block on AMP-ativated protein kinase and astrocyte in hippocampal neurons in postoperative aged rats // Zhonghua Yi Xue Za Zhi. — 2014. — Vol. 22, № 94(28). — P. 2222-6.
19. Erdivanli B., Altun M., Sezen O.K., Colakoğlu S.A. Anti-nociceptive, analgesic and pathohistological effects of intrathecal dexmedetomidine and bupivacaine inrats // Braz. J. Anesthesiol. — 2013. — Vol. 63(2). — P. 183-7.
20. Blecharz-Klin K., Joniec-Maciejak I., Piechal A., Pyrzanowska J., Wawer A., Widy-Tyszkiewicz E. Paracetamol impairs the profile of amino acids in the rat brain // Environ. Toxicol. Pharmacol. — 2014. — Vol. 37(1). — P. 95-102.
21. Brennum J., Petersen K.L., Horn A. et al. Quantitative sensory examination of epidural anaesthesia and analgesia in man: combination of morphine and bupivacaine // Pain. — 1994. — Vol. 56. — P. 327-337.
22. Hopf H., Weitz J. Postoperative pain management // Arch. Surg. — 1994. — Vol. 129(2). — P. 128-132.

/77.jpg)
/78.jpg)
/80.jpg)