Статья опубликована на с. 101-106
Острое повреждение легких вследствие трансфузий (TRALI — Transfusion related acute lung injury) — патологический синдром, который проявляется остро возникшей гипоксемией в течение 6 часов после трансфузии, с наличием двусторонних легочных инфильтратов и при отсутствии других причин –отека легких [5, 8, 31].
Данное осложнение переливания препаратов крови является одной из серьезных проблем трансфузиологии и реаниматологии. Препараты крови используются в лечении каждого третьего пациента, попавшего в отделение интенсивной терапии. Чаще всего к повреждению легких приводит трансфузия свежезамороженной плазмы. Риск развития этого осложнения существует и при трансфузии других компонентов донорской крови (эритроцитарной массы, цельной крови, тромбоцитарной массы, иммуноглобулинов, криопреципитата). Но не описано ни одного случая развития TRALI при переливании альбумина [22].
Частота развития TRALI невысока и составляет, согласно данным разных авторов, 0,002–0,26 % на дозу переливаемого препарата крови [23, 34, 35]. Однако реальная частота этого осложнения, вероятно, выше, поскольку оно не всегда диагностируется. Смертность при развитии данного синдрома составляет 5–10 % [16, 19, 28, 31]. TRALI-синдром считается одной из основных причин летальности, связанной с переливанием компонентов донорской крови, пропуская вперед только гемотрансфузионный шок и инфекционные осложнения [11, 32].
Впервые это осложнение было описано в 1951 году, когда больной с острой лейкемией умер вследствие отека легких сразу же после гемотрансфузии, связанного с реакцией гиперчувствительности немедленного типа [1, 37]. В 1966 году E. Phillips и F.G. Fleischner описали три случая развития отека легких у больных, которым проводилась гемотрансфузия. При этом отек легких являлся не следствием острой левожелудочковой недостаточности, а проявлением аллергической реакции на гемотрансфузию [18]. В 1970-х годах была установлена прямая взаимосвязь патологических изменений в легких реципиентов и несовместимости по человеческому лейкоцитарному антигену (HLA) донорской крови [30, 36]. В 1985 году M.A. Popovsky и S.B. Moore в своих исследованиях доказали, что TRALI является наиболее вероятным трансфузионным осложнением, которое часто приводит к смертельному исходу, но при этом не диагностируется. Впервые синдром TRALI как причина смерти был зафиксирован в 1992 году [19].
В настоящее время существует две патогенетические теории развития острого повреждения легких вследствие трансфузии: иммунная и неиммунная, которые дополняют друг друга.
1. В основе иммунной теории лежит выработка антител к человеческим лейкоцитарным антигенам (HLA) или к человеческим нейтрофильным антигенам (HNA), а также наличие антилейкоцитарных антител в трансфузионной среде. Эти антитела взаимодействуют с антигенами нейтрофилов и активируют их. Активированные нейтрофилы выделяют биологически активные вещества (протеазы, NO, свободные радикалы, цитокины, молекулы адгезии и др.), которые ведут к повреждению эндотелия сосудов, в том числе и легких. Повышается сосудистая проницаемость с развитием феномена «капиллярной утечки» и отека легких [3, 19, 37]. Донорские антитела могут непосредственно взаимодействовать с легочным эндотелием и моноцитами, с прямой активацией этих клеток [9]. Редким вариантом иммунологической агрессии является взаимодействие антител реципиента с лейкоцитами донора или антител и лейкоцитов разных доноров при массивных трансфузиях [4, 33]. Необходимо отметить, что антитела к лейкоцитарным антигенам чаще обнаруживались у повторно рожавших женщин [17].
2. Неиммунная теория. Примерно в 10 % случаев возникновения TRALI антилейкоцитарные антитела не были обнаружены ни у донора, ни у реципиента [36, 37]. В неиммунную теорию входят два независимых механизма [2, 24–26]:
— активация лейкоцитов пациента, которому проводится трансфузия, при наличии в его организме воспалительного процесса, под действием медиаторов воспаления (сепсис, пневмония, политравма, кровопотеря, обширное оперативное вмешательство) [2, 24–26];
— переливание препаратов крови, содержащих биологически активные липиды, которые могут активировать лейкоциты (с помощью лизофосфатидилхолинов, которые входят в состав этих липидов). Биологически активные липиды являются продуктами распада клеточных мембран и содержатся в препаратах крови с давним сроком заготовки [2, 25–27].
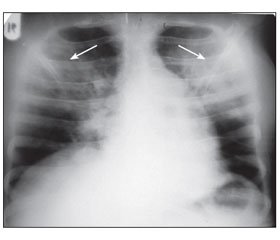
Мы встретились с TRALI-синдромом в раннем послеродовом периоде у пациентки с массивным (75 % ОЦК) гипотоническим маточным кровотечением, в связи с чем была осуществлена двусторонняя перевязка внутренних подвздошных артерий. Кровопотеря восполнялась инфузией кристаллоидных и синтетических коллоидных растворов, а также трансфузией эритроцитарной массы и свежезамороженной плазмы под контролем ЦВД и почасового диуреза. В связи с выраженной постгеморрагической анемией трансфузия эритроцитарной массы проводилась и на вторые сутки послеродового послеоперационного периода. Через 3 часа после последней гемотрансфузии возникла одышка смешанного характера, возбуждение, малопродуктивный кашель, снижение сатурации, гипотензия, тахикардия и повышение температуры тела до субфебрильных цифр. Центральное венозное давление составило 5 см водного столба. Пациентка была интубирована и переведена на ИВЛ с нормовентиляционными параметрами, с ПДКВ + 8 см водного столба. Седация и адаптация к ИВЛ проводилась раствором тиопентала натрия. Была подключена симпатомиметическая терапия (использовался дофамин). Выполнена рентгенография органов грудной клетки, показавшая наличие двусторонних инфильтратов в легких (рис. 1). Проводилась антибактериальная, утеротоническая терапия, инфузия гидроксиэтилкрахмала, глюкозо-калий-магний-инсулиновой смеси (20% глюкоза), глюкокортикоидная терапия (24 мг дексаметазона в сутки), антисекреторная (омепразол) и антикоагулянтная профилактика. На 2-е сутки подключено энтеральное питание через назогастральный зонд сбалансированными смесями на фоне стимуляции перистальтики кишечника, седация не проводилась.
/103.jpg)
В конце 3-х суток прекращена симпатомиметическая терапия. Больная переведена на вспомогательную вентиляцию в режиме CPAP. В начале 5-х суток больная переведена на самостоятельное дыхание и дезинтубирована. Состояние пациентки восстановилось до удовлетворительного, дыхательной недостаточности не отмечалось. Контрольное рентгенологическое исследование органов грудной полости проводилось на 5-е сутки (рис. 2).
Развитие острой дыхательной недостаточности в послеоперационном периоде у женщины, перенесшей массивное акушерское кровотечение и геморрагический шок, вызвало необходимость проводить дифференциальную диагностику со следующими патологическими состояниями: ОРДСВ и кардиогенным отеком легких (табл. 1, 2).
В нашем случае опорными симптомами для постановки диагноза были: раннее и острое начало одышки (через три часа после гемотрансфузии); гипотензия, не связанная с гиповолемией или со снижением сердечного выброса; ЦВД, близкое к нижней границе нормы; характерные двусторонние инфильтраты в легких (рентгенологически) и отсутствие признаков повреждения легких до гемотрансфузии.
Для проведения наглядной дифференциальной диагностики приводятся рентгенологические снимки органов грудной полости пациенток с РДСВ-синдромом и кардиогенным отеком легких (рис. 3, 4).
Дифференциальная диагностика TRALI-синдрома затруднена из-за невысокой специфичности диагностических симптомов.
Его основными отличительными критериями являются: связь с трансфузией; временной фактор развития отека легких (в первые 6 часов после трансфузии) и более мягкое течение с развитием позитивной динамики спустя 48–96 часов после возникновения повреждения легких. Рентгенологическая картина отека легких при TRALI и ОРДСВ практически не различается, но кардинально отличается от кардиогенного отека легких (табл. 2).
/103_2.jpg)
Основные симптомы, которые позволяют заподозрить TRALI: одышка смешанного характера; кашель; выделение пенистой мокроты; гипертермия; гипотензия; тахикардия, которые возникают на протяжении 6 часов после трансфузии [10]. Гипотензия является одним из патогномоничных признаков TRALI (активированные нейтрофилы выделяют биологически активные вещества, одним из которых является NO, который ведет к вазодилатации) [20]. Основное диагностическое значение имеет временной фактор, отек легких развивается в первые 6 часов после трансфузии [5, 8, 28, 31]. Также для TRALI характерна быстрая клиническая и рентгенологическая позитивная динамика (спустя 48–96 часов после повреждения) [16, 19, 28, 31]. Функция легких после перенесенного TRALI восстанавливается без структурных изменений (без возникновения фиброза) [16].
Диагностические критерии TRALI [5, 31]:
— снижение респираторного индекса (PaO2/FiO2) менее 300 мм рт.ст. или снижение сатурации (SpO2) менее 90 % при дыхании атмосферным воздухом (FiO2 = 0,21);
— острое появление симптомов в первые 6 часов после трансфузии;
— наличие двусторонних инфильтратов на рентгенограмме органов грудной клетки;
— отсутствие признаков гипертензии в малом круге кровообращения (давление заклинивания легочных капилляров (ДЗЛК) < 18 мм рт.ст.; центральное венозное давление < 12 см вод.ст.);
— отсутствие острого повреждения легких до трансфузии;
— отсутствие временной связи между другими причинами развития острого повреждения легких.
Меры профилактики:
— строгий подход к показаниям для проведения трансфузии препаратов крови, а также к правилам заготовки и хранения препаратов крови (большинство случаев развития TRALI-синдрома связано с несоблюдением протоколов переливания препаратов крови, а также правил заготовки и хранения компонентов крови);
— в данное время высказываются предложения, чтобы анамнестические данные о повторных родах ввести как критерий отказа от возможности донорства. В 2001 году было выявлено, что большинство случаев TRALI-синдрома вызвала трансфузия свежезамороженной плазмы, заготовленной от неоднократно рожавших женщин, дальнейшие исследования показали, что в этой категории доноров отмечается высокая концентрация антилейкоцитарных антител [17, 21];
— использование отмытых эритроцитов и эритроцитарной массы, обедненной лейкоцитами (отдавать предпочтение этим препаратам крови при возникновении показаний к гемотрансфузии);
— использование препаратов крови с небольшим сроком хранения (эритроцитарная масса — до 10 дней от момента заготовки);
— применение лейкоцитарных фильтров при проведении трансфузий (позволяет предотвратить HLA-сенсибилизацию и негемолитические посттрансфузионные реакции) [6].
Для лечения легкой формы TRALI-синдрома достаточно оксигенотерапии и симптоматического лечения. При лечении тяжелых форм целесо–образно использовать искусственную вентиляцию легких с ПДКВ или вспомогательную в режиме CPAP, инфузионную терапию под контролем ЦВД и диуреза, а также симптоматическую терапию. Эффективность глюкокортикоидов в лечении этого осложнения на данный момент не доказана и требует дальнейшего изучения. При установлении диагноза TRALI-синдрома использование фуросемида противопоказано. Назначение фуросемида пациентам с TRALI-синдромом ведет к усугублению артериальной гипотензии, а проведение инфузионной терапии под контролем ЦВД и ДЗЛК способствует стабилизации гемодинамики [13]. При необходимости используются симпатомиметики.
TRALI-синдром — осложнение гемотрансфузии, которое часто не диагностируется. Принципиальными клиническими отличиями от ОРДСВ являются: временной фактор (развитие отека легких в первые 6 часов после трансфузии) и более мягкое течение с положительной динамикой спустя 48–96 часов после повреждения.
Основным пусковым механизмом развития является гемотрансфузия, которая приводит к образованию антилейкоцитарных или антинейтрофильных антител, или же наличие этих антител, а также биологически активных липидов в трансфузионной среде.
Основными профилактическими мероприятиями являются: строгий подход к показаниям для проведения трансфузии и использование антилейкоцитарных фильтров.
Список литературы
1. Barnard R.D. Indiscriminate transfusion: a critique of case reports illustrating hypersensitivity reactions // N.Y. State J. Med. — 1951. — № 51 (20). — Р. 2399-40
2. Bux J., Sachs U.J. The pathogenesis of transfusion-related acute lung injury (TRALI) // Br. J. Haematol. — 2007. — № 136. — Р. 788-99.
3. Curtis B.R., McFarland J.G. Mechanisms of transfusion-rela–ted acute lung injury (TRALI): anti-leukocyte antibodies // Crit. Care Med. — 2006. — № 34. — Р. 118-S123.
4. Eastlund D.T., McGrath P.C., Burkart P. Platelet transfusion reaction associated with interdonor HLA incompatibility // Vox. Sang. — 1988. — № 55. — Р. 157-160.
5. Goldman M., Webert K.E., Arnold D.M., Freedman J., Hannon J., Blajchman M.A. Proceedings of a consensus conference: towards an understanding of TRALI // Transfus. Med. Rev. — 2005. — 19. — Р. 2-31.
6. Hebert P.C. et al. Clinical outcomes following institution of the Canadian universal leukoreduc-tion program for red blood cell transfusions // JAMA. — 2003. — № 289. — Р. 1941-1949.
7. Kazanegra R., Cheng V., Garcia A. et al. A rapid test for –B-type natriuretic peptide correlates with falling wedge pressures in patients treated for decompensated heart failure: a pilot study // J. Card Fail. — 2001. — № 7. — Р. 21-9.
8. Kleinman S. A perspective on transfusion-related acute lung injury two years after the Canadian Consensus Conference // Transfusion. — 2006. — № 46. — Р. 1465-8.
9. Kopko P.M., Paglieroni T.G., Popovsky M.A. et al. TRALI: correlation of antigen-antibody and monocyte activation in donor-recipient pairs // Transfusion. — 2003. — № 43. — Р. 177-18.
10. Kopko P.M., Marshall C.S., MacKenzie M.R. et al. Transfusionrelated acute lung injury: report of a clinical look-back investigation // JAMA. — 2002. — № 287. — Р. 1968-1971.
11. Kopko P.M. Review: TRALI: pathophysiology laboratory investigation and donor management // Immunopathol. — 2004. — V. 20 (2). — P. 103-111.
12. Krishnaswamy P., Lubien E., Clopton P. et al. Utility of –B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction // Am. J. Med. — 2001. — № 111. — Р. 274-9.
13. Levy G.J., Shabot M.M., Hart M.E. et al. Transfusion-associated noncardiogenic pulmonary edema: report of a case and a warning regarding treatment // Transfusion. — 1986. — № 26. — Р. 278-281.
14. Maisel A.S., Krishnaswamy P., Nowak R.M. et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure // N. Engl. J. Med. — 2002. — № 347. — Р. 161-7.
15. Maisel A.S., Koon J., Krishnaswamy P. et al. Utility of B-natriuretic peptide as a rapid, point-of-care test for screening patients undergoing echocardiography to determine left ventricular dysfunction // Am. Heart J. — 2001. — № 141. — Р. 367-74.
16. Moore S.B. Transfusion-related acute lung injury (TRALI): clinical presentation, treatment, and prognosis // Crit. Care Med. — 2006. — № 34. — Р. 114-S117.
17. Muller J.Y. TRALI: from diagnosis to prevention // Transfus. Clin. Biol. — 2005. — № 12 (2). — Р. 95-102.
18. Philipps E., Fleischner F.G. Pulomonary edema in the course of a blood transfusion without over-loading the circulation // Dis. Chest. — 1966. — № 50 (6). — Р. 619-623.
19. Popovsky M.A., Moore S.B. Diagnostic and pathogenetic considerations in transfusion-related acute lung injury // Transfusion. — 1985. — № 25. — Р. 573-577.
20. Popovsky M.A., Haley N.R. Further characterization of transfusion-related acute lung injury: de-mographics, laboratory features and morbidity // Transfusion. — 1999. — № 39. — Р. 97.
21. Popovsky M.A., Davenport R.D. Transfusion-related acute lung injury: femme fatale? // Transfusion. — 2001. — № 41. — Р. 312-315.
22. Popovsky M.A. Transfusion-related acute lung injury // Curr. Opin. Hematol. — 2000. — № 7. — Р. 402-407.
23. Rana R., Fernandez-Perez E.R., Khan S.A. et al. Transfusion-related acute lung injury and pulmonary edema in critically ill patients: a retrospective study // Transfusion. — 2006. — № 46. — Р. 1478-83.
24. Seeger W., Schneider U., Kreusler B. et al. Reproduction of transfusion-related acute lung injury in an ex vivo lung model // Blood. — 1990. — № 76. — Р. 1438-44.
25. Silliman C.C., Voelkel N.F., Allard J.D. et al. Plasma and lipids from stored packed red blood cells cause acute lung injury in an animal model // J. Clin. Invest. — 1998. — № 101. — Р. 1458-67.
26. Silliman C.C., Bjornsen A.J., Wyman T.H. et al. Plasma and lipids from stored platelets cause acute lung injury in an animal mo–del // Transfusion. — 2003. — № 43. — Р. 633-40.
27. Silliman C.C., Paterson A.J., Dickey W.O. et al. The association of biologically active lipids with the development of transfusion-related acute lung injury: a retrospective study // Transfusion. — 1997. — № 37. — Р. 719-26.
28. Silliman C.C., Boshkov L.K., Mehdizadehkashi Z. et al. Transfusion related acute lung injury: epidemiology and a prospective analysis of etiologic factors // Blood. — 2003. — № 101. — Р. 454-462.
29. Silver M.A., Maisel A., Yancy C.W. et al. BNP Consensus Panel 2004: a clinical approach for the diagnostic, prognostic, screening, treatment monitoring, and therapeutic roles of natriuretic peptides in cardiovascular diseases // Congest Heart Fail. — 2004. — № 10 (3). — Р. 1-30.
30. Thompson J.S., Severson C.D., Parmely M.J., Marmorstein B.L., Simmons A. Pulmonary «hypersensi-tivity» reactions induced by transfusion of non-HL-A leukoagglutinins // N. Engl. J. Med. — 1971. — № 284 (20). — Р. 1120-1125.
31. Toy P., Popovsky M.A., Abraham E. et al. Transfusion-related acute lung injury: definition and review // Crit. Care Med. — 2005. — № 33. — Р. 721-6.
32. Transfusion Related Acute Lung Injury // Food and Drug Administration. — http: // www.fda.gov/cber/ltr/trali081301.htm (10/19/2002).
33. Virchis A.E., Patell R.K., Contreras M. et al. Acute noncardiogenic lung oedema after platelet transfusion // BMJ. — 1997. — № 314. — Р. 880-882.
34. Wallis J.P. et al. Single hospital experience of TRALI // Transfusion. — 2003. — № 43. — Р. 1053-9.
35. Wiersum-Osselton J.C. et al. Transfusion-related acute lung injury (TRALI) in the Netherlands in 2002–2005 // Ned Tijdschr. Geneeskd. — 2008. — № 152. — Р. 1784-8.
36. Wolf C.F., V.C. Canale V.C. Fatal pulmonary hypersensitivity reaction to HL-A incompatible blood transfusion: report of a case and review of the literature // Transfusion. — 1976. — № 16. — Р. 135.
37. Острое повреждение легких вследствие трансфузии препаратов крови/Острый респираторный дистресс-синдром / Под ред. Б.Р. Гельфанд, В.Л. Кассиль. — М.: Литера, 2007. — С. 40-47.

/103.jpg)
/102.jpg)
/104.jpg)
/103_2.jpg)