Резюме
Актуальність теми. Інфузійна терапія є невід’ємною частиною інтенсивної терапії постраждалих з тяжкою черепно-мозковою травмою (ЧМТ), однак ефективність інфузійно-трансфузійної терапії багато в чому залежить від цілеспрямованого обґрунтування її програми, характеристик інфузійних розчинів, їх фармакологічних властивостей і фармакокінетики. На даному етапі інтенсивної терапії вибір розчину для проведення волемічної підтримки у постраждалих із тяжкою черепно-мозковою травмою залишається дискутабельним. Мета дослідження: оптимізувати методику проведення волемічної підтримки у постраждалих із тяжкою черепно-мозковою травмою з метою зменшення вираженості набрякового синдрому. Матеріали та методи. Обстежено 60 постраждалих із тяжкою ЧМТ віком від 18 до 65 років, з рівнем свідомості 5–11 балів за шкалою коми Глазго при надходженні та через 12 годин після проведення первинної ресусцитації та тяжкістю стану за шкалою APACHE II 21,0 ± 2,7 бала, які були поділені на дві групи: контроль та дослідження. Постраждалим у групі контролю волемічна підтримка проводилась розчином NaCl 0,9% за загальноприйнятою методикою. У групі дослідження волемічна підтримка проводилась збалансованим кристалоїдним розчином. В обох групах моніторувались показники збільшення товщини масиву тканин у фронтальній ділянці, на тилі стопи та окружності над променево-зап’ястковим суглобом. Результати. За даними нашого дослідження, у постраждалих, волемічна підтримка яким здійснювалась збалансованим кристалоїдним розчином, набряковий синдром був менш вираженим, також у групі дослідження спостерігається регресування набрякового синдрому на 8–9-й добі лікування, на той час як у групі контролю набряки зберігаються впродовж усіх 10 діб лікування. Висновки. Встановлено, що застосування для волемічної підтримки збалансованого кристалоїдного розчину суттєво зменшило вираженість набрякового синдрому у постраждалих із тяжкою черепно-мозковою травмою впродовж перших 10 діб лікування, дозволило ліквідувати набряковий синдром до 9–10-ї доби лікування, що, у свою чергу, дозволяє покращити параметри зовнішнього дихання, зменшити кількість ускладнень з боку дихальної системи, тривалість проведення штучної вентиляції легень, а відповідно і перебування у відділенні інтенсивної терапії та термінів лікування.
Актуальность темы. Инфузионная терапия является неотъемлемой частью интенсивной терапии пострадавших с тяжелой черепно-мозговой травмой (ЧМТ), однако эффективность инфузионно-трансфузионной терапии во многом зависит от целенаправленного обоснования ее программы, характеристик инфузионных растворов, их фармакологических свойств и фармакокинетики. На данном этапе интенсивной терапии выбор раствора для проведения волемической поддержки у пострадавших с тяжелой черепно-мозговой травмой остается дискутабельным. Цель исследования: оптимизировать методику проведения волемический поддержки у пострадавших с тяжелой черепно-мозговой травмой с целью уменьшения выраженности отечного синдрома.
Материалы и методы. Обследовано 60 пострадавших с тяжелой ЧМТ в возрасте от 18 до 65 лет, с уровнем сознания 5–11 баллов по шкале комы Глазго при поступлении и через 12 часов после проведения первичной ресусцитации и тяжестью состояния по шкале APACHE II 21,0 ± 2,7 балла, которые были разделены на две группы: контроль и исследования. Пострадавшим в группе контроля волемическая поддержка проводилась раствором NaCl 0,9% по общепринятой методике. В группе исследования волемическая поддержка проводилась сбалансированным кристаллоидным раствором. В обеих группах мониторировались показатели увеличения толщины массива тканей во фронтальной области, на тыле стопы и окружности над лучезапястным суставом. Результаты. По данным нашего исследования, у пострадавших, волемическая поддержка которым осуществлялась сбалансированным кристаллоидным раствором, отечный синдром был менее выраженным, также в группе исследования наблюдается регрессирование отечного синдрома на 9–10-е сутки лечения, в то время как в группе контроля отеки сохраняются на протяжении всех 10 дней лечения.
Выводы. Установлено, что применение для волемической поддержки сбалансированного кристаллоидного раствора существенно уменьшило выраженность отечного синдрома у пострадавших с тяжелой черепно-мозговой травмой в течение первых 10 дней лечения, позволило ликвидировать отечный синдром до 9–10-х суток лечения, что, в свою очередь, позволяет улучшить параметры внешнего дыхания, уменьшить количество осложнений со стороны дыхательной системы, длительность проведения искусственной вентиляции легких, а соответственно и пребывания в отделении интенсивной терапии и сроков лечения.
Background. Infusion therapy is an integral part of intensive care of patients with severe brain injury, but the effectiveness of infusion-transfusion therapy largely depends on the targeted grounding of its application, characteristics of infusion solutions, their pharmacological properties and pharmacokinetics. At this stage of intensive care choice of solution for volemic support in patients with severe brain injury is not resolved. Objective. To optimize the method of volemic support in patients with severe brain injury to reduce the severity of edema syndrome.
Materials and methods. The study involved 60 patients with severe brain injury, aged from 18 to 65 years old, with the level of consciousness 5–11 scores by the Glasgow Coma Scale at admission and 12 hours after the initial resussitation and severity 21 ± 2,7 scores by APACHE II scale. The patients were divided into two groups: control and research. The patients in the control group received volemic support solution NaCl 0.9% by the standard method. The research group received volemic support with balanced crystalloid solution. In both groups indicators of increasing of tissue thickness in the frontal area, the rear foot and the circumference over radiocarpal joint were monitored. Results. According to data of our study of the victims, who carried volemic support with balanced crystalloid solution severity of edema syndrome was less pronounced, as in the study group regression of edema syndrome was observed in 9–10 days of treatment. While in the control group edema remains for 10 days of treatment.
Conclusions. The application of volemic support with balanced crystalloid solution was found to significantly reduce the severity of edema syndrome in patients with severe brain injury during the first 10 days of treatment, to eliminate edema syndrome to the 9th–10th days of treatment, which in turns improves parameters of external respiration, reduces complications in the respiratory system, the duration of artificial pulmonary ventilation, and therefore staying in the emergency unit and duration of treatment.
Статтю опубліковано на с. 107-111
Вступ
Інфузійна терапія є невід’ємною частиною інтенсивної терапії постраждалих із тяжкою черепно-мозковою травмою (ЧМТ) і розв’язує такі важливі питання, як поповнення дефіциту об’єму циркулюючої крові (ОЦК) в першу добу лікування, тим самим забезпечуючи гемодинамічну стабільність і, як результат, адекватну перфузію пошкодженого мозку, що вкрай важливо для уникнення вторинних ішемічних пошкоджень (Bentsen G., Breivik H., Lundar T.). При проведенні подальшої інтенсивної терапії у даної категорії хворих волемічна підтримка необхідна для компенсації втрат рідини, що виникають в процесі лікування (Harutjunyan L., Holz C., Rieger A.).
За визнанням більшості дослідників і клініцистів, «нормальний судинний об’єм — наріжний камінь життєзабезпечення». Водночас ефективність інфузійно-трансфузійної терапії багато в чому залежить від цілеспрямованого обґрунтування її програми, характеристик інфузійних розчинів, їх фармакологічних властивостей і фармакокінетики. На даному етапі для лікування постраждалих із тяжкою черепно-мозковою травмою загальноприйнято застосування ізоосмолярних кристалоїдних розчинів для волемічної підтримки та гіперосмолярних — для корекції набряку головного мозку (Царенко С.В., Крылов В.В., Тюрин Д.Н.). Найбільш широко застосовується на даний час як базовий розчин для проведення волемічної підтримки у постраждалих із тяжкою ЧМТ розчин натрію хлориду 0,9% (Segal J.B., Blasco-Colmenares E., Norris E.J.). Основні переваги кристалоїдних розчинів — низька реактогенність, відсутність впливу на функцію нирок та імунну систему, а також відсутність значущого впливу на систему гемостазу. Головним недоліком кристалоїдів є їх швидкий перерозподіл із судинного русла в міжклітинний простір: 75–80 % введеного препарату через одну-дві години після інфузії виявляється в інтерстиції. У зв’язку з настільки нетривалим волемічним ефектом для підтримки ОЦК при ізольованому застосуванні сольових розчинів потрібне введення великого об’єму розчинів, що загрожує ризиком розвитку гіпергідратації та набрякового синдрому. Розвитку набрякового синдрому у постраждалих із тяжкою ЧМТ сприяє також синдром капілярного витоку. Синдром капілярного витоку тією чи іншою мірою присутній у переважній більшості критичних станів організму людини та тварин. Під синдромом капілярного витоку на сучасному етапі найчастіше розуміють синдром, що спостерігається в умовах критичних станів і характеризується прогресуючим патологічним наростанням капілярної проникності, що веде до втрати рідкої частини крові в інтерстиціальний сектор позаклітинного водного простору, з подальшим розвитком гіповолемії, гіпоперфузії органів і тканин, погіршенням транспорту кисню та швидким формуванням поліорганної дисфункції (Бєляєв А.В.). Обмін рідини між внутрішньосудинним та інтерстиціальним сектором підпорядкований закону Ернста Генрі Старлінга. Згідно з цим законом, рідина переміщується відповідно до градієнту тиску, що створюється, з одного боку, гідростатичним внутрішньосудинним тиском та колоїдно-осмотичним тиском інтерстиціальної рідини, з іншого — гідростатичним інтерстиціальним тиском і колоїдно-осмотичним тиском плазми крові. За класичної концепції Старлінга, в середині капіляра, приблизно в 2/3 довжини від його початку є точка рівноваги всіх вищеописаних сил, проксимальніше якої переважає екстравазація рідини, а дистальніше — резорбція. В ідеальній точці рівноваги обміну рідини немає. Реальні виміри показують, що певна зона капіляра перебуває у положенні, що близьке до рівноважного, але і в ній вихід рідини все ж переважає над резорбцією. Цей надлишок транссудату повертається в кров по лімфатичних судинах. При збільшенні гідростатичного тиску в мікроциркуляторних обмінних судинах зона рівноваги зсувається в бік посткапілярних венул, збільшуючи поверхню фільтрації та зменшуючи площу резорбції. Зменшення гідростатичного тиску веде до зворотного зрушення білярівноважної зони (Battison С., Andrews P.J.D., Graham С.).
Набряк — це типовий патологічний процес, що полягає у створенні надлишку рідини в інтерстиціальному секторі позаклітинного водного простору. Термін «набряк» не застосовується щодо внутрішньоклітинної гіпергідратації (для її визначення більш прийнятний термін «набухання клітини»). При набряку завжди не тільки присутній надлишок позаклітинної тканинної води, але й підвищується вміст натрію в тканинній рідині. Набряк — це прояв недосконалого пристосування. Пристосувальна роль набряків може полягати в тому, що вони захищають організм від розвитку гіперволемії, яка може мати небезпечні для життя наслідки. У той же час у набряклих тканинах здавлюються судини, додатково порушується мікроциркуляція, утруднюється дифузія нутрієнтів, такі тканини легше інфікуються, та процеси репарації в них відбуваються повільніше (Wallis J.P., Wells A.W., Matthews J.N.).
Найбільш очевидними механізмами втрати внутрішньосудинної рідини в інтерстицій є: збільшення градієнта гідростатичного тиску в артеріальній частині капіляра; зниження градієнта колоїдно-осмотичного тиску у венозному кінці капіляра; порушення лімфатичного дренування. З перерахованих механізмів у формуванні набрякового синдрому у постраждалих із тяжкою ЧМТ найбільш серйозне значення мають перший та другий механізми (Stummer W.).
Таким чином, суттєво вплинути на ступінь розвитку набрякового синдрому у даної категорії хворих можливо шляхом впливу на осмотичний тиск, а також шляхом проведення волемічної підтримки інфузійними розчинами, які максимально наближені за своїм іонним складом до плазми крові. Будь-яка інфузійна рідина, що не містить фізіологічної буферної основи HCO3–, буде незмінно створювати дилюційний ацидоз, оскільки інфузія такого розчину зменшує концентрацію HCO3– у всьому позаклітинному просторі, тоді як парціальний тиск CO2 (буферної кислоти) залишається постійним. Коли позаклітинний рідинний об’єм розширюється за допомогою розчину без бікарбонату, виникає гіпергідратація (Lang W., Zander R).
Тому, на нашу думку, виникає необхідність у застосуванні кристалоїдного розчину, збалансованого за вмістом електролітів та органічних аніонів, який, з одного боку, не призводив би до поглиблення метаболічного ацидозу, а з іншого — обмежував ефекти інфузійної терапії на вираженість трансвазації.
Матеріали та методи
Обстежено 60 постраждалих із тяжкою ЧМТ, які знаходились на лікуванні у відділенні інтенсивної терапії Київської міської клінічної лікарні швидкої медичної допомоги, віком від 18 до 65 років, з рівнем свідомості 5–11 балів за шкалою коми Глазго при надходженні та через 12 годин після проведення первинної ресусцитації та тяжкістю стану за шкалою APACHE II 21,0 ± 2,7 бала. У постраждалих обох груп проводилась штучна вентиляція легенів (ШВЛ), аналогоседація, інфузійна терапія. Середній артеріальний тиск підтримувався на рівні вище 90 мм рт.ст. впродовж усього періоду інтенсивної терапії.
Постраждалим у групі контролю (30 хворих) проводилась волемічна підтримка розчином натрію хлориду 0,9% за загальноприйнятою методикою в дозі 24,1–65,4 мл/кг/добу залежно від темпу діурезу, вираженості гіпертермічного синдрому, втрат по орогастральному зонду, наявності діареї, втрат на перспірацію та під контролем центрального венозного тиску (ЦВТ). Цільовим рівнем центрального венозного тиску у постраждалих із тяжкою черепно-мозковою травмою було 120 мм водного стовпа. При досягненні цільового рівня ЦВД та неможливості утримання середнього артеріального тиску на рівні 90 мм рт.ст. хворим вводився норадреналін у дозі 0,05–3 мкг/кг/хв. При збереженні у пацієнта гіпотензії, рівня венозної сатурації нижче 65 % та серцевого індексу меньше 3,5 л/хв/м2 вводився добутамін в дозах 1–20 мкг/кг/хв. Трансфузію еритроцитарної маси проводили при рівні Hb < 70 г/л; трансфузію плазми — за наявності клінічних ознак коагулопатії та рівні активованого часткового тромбопластинового часу більше 45 секунд, протромбінового часу — більше 25 секунд, фібриногену — менше 2 г/л.
Постраждалим у групі дослідження (30 хворих) волемічна підтримка проводилась збалансованими кристалоїдними розчинами, схема трансфузійної терапії, адреноміметичної та інотропної корекції з метою підтримання необхідного рівня САТ були аналогічними таким у групі контролю. Корекція набряку мозку в обох групах проводилась розчином натрію хлориду 3% у дозі 3–12 мл/кг/добу.
В обох групах упродовж 10 діб лікування моніторувались наступні показники: товщина тканин у фронтальній ділянці (мм) у динаміці сонографічним методом за допомогою лінійного датчика, товщина тканин на тилі стопи (мм) обох нижніх кінцівок у динаміці сонографічним методом за допомогою лінійного датчика, окружність над променево-зап’ястковим суглобом на обох кінцівках (см).
Результати та їх обговорення
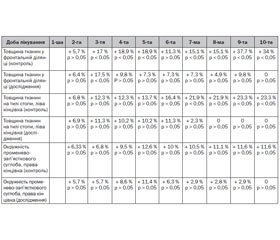
Як показало наше дослідження, результати якого наведені у табл. 1, в обох групах постраждалих із тяжкою черепно-мозковою травмою мав місце набряковий синдром, що проявлявся збільшенням товщини масиву тканин від окістя до лінії шкіри, виміряних сонографічним методом у сталій точці, на тилі стопи та у фронтальній ділянці, а також збільшенням у динаміці окружності над променево-зап’ястковим суглобом.
Однак у групі постраждалих із тяжкою ЧМТ, де волемічна підтримка проводилась розчином натрію хлориду 0,9%, приріст збільшення товщини масиву тканин у досліджуваних ділянках значно перевищує цей показник у групі, де волемічна підтримка проводилась збалансованим кристалоїдним розчином. У контрольній групі набряковий синдром спостерігається впродовж усіх десяти діб лікування, у той час як у групі дослідження спостерігається регресування набрякового синдрому починаючи з 8-ї доби лікування.
У цілому максимальний приріст збільшення товщини масиву тканин контрольної групи спостерігався у фронтальній ділянці на 10-ту добу лікування і становив 34 %, тоді як у групі дослідження цей показник повертається до вихідного рівня, тобто дорівнює нулю. Виходячи з отриманих нами даних у групі постраждалих із тяжкою ЧМТ, де волемічна підтримка здійснювалась збалансованим кристалоїдним розчином, вираженість набрякового синдрому значно зменшується до 9-ї доби лікування та повністю регресує на 10-ту добу лікування, у той час як у групі контролю показники приросту товщини масиву тканин, тобто вираженості набрякового синдрому, на 9–10-ту добу лікування досягають свого максимуму. Дев’ята, десята доба лікування відповідає термінам розвитку септичних ускладнень у постраждалих із тяжкою ЧМТ та закономірно потребує збільшення об’ємів волемічної підтримки (Царенко С.В.). Розвиток вираженого набрякового синдрому на фоні септичних ускладнень замикає порочне коло. Оскільки під дією таких прозапальних медіаторів, як брадикінін, гістамін, цитокінів (фактор некрозу пухлини альфа, інтерлейкін-2 і -6), фактора судинної проникності (судинний ендотеліальний фактор росту А), активних протеаз, вільних радикалів, бактеріальних токсинів та інших відбувається підвищення патологічної проникності ендотелію, що на фоні вже наявного набрякового синдрому може зумовити розвиток значної гіповолемії, аж до розвитку гіповолемічного шоку. У свою чергу, сам стан шоку, який характеризується системною гіпоперфузією тканин, гіпоксією ендотелію, вивільненням великої кількості агресивних медіаторів, тяжкими порушеннями обмінних процесів, обов’язково сприяє формуванню та поглибленню синдрому капілярного витоку. Також важливий негативний вплив у даному випадку чинить порушення мікроциркуляції у набряклих тканинах, що утруднює дифузію нутрієнтів, внаслідок чого набряклі тканини легше інфікуються та процеси репарації в них відбуваються повільніше (Wallis J.P., Wells A.W., Matthews J.N.).
Також варто відмітити, що виражений набряковий синдром погіршує параметри зовнішнього дихання, збільшує вірогідність утворення випоту в плевральних порожнинах при переведенні хворого зі штучної вентиляції легень на спонтанне дихання, чим подовжує тривалість проведення ШВЛ, перебування у відділенні інтенсивної терапії та термінів лікування (Бєляєв А.В.).
Висновки
1. Встановлено, що застосування для волемічної підтримки збалансованого кристалоїдного розчину суттєво зменшило вираженість набрякового синдрому у постраждалих із тяжкою черепно-мозковою травмою впродовж перших 10 діб лікування.
2. Показано, що застосування збалансованого кристалоїдного розчину дозволяє ліквідувати набряковий синдром до 9–10-ї доби лікування, що, в свою чергу, дозволяє уникнути критичної гіповолемії в період розвитку септичних ускладнень у постраждалих із тяжкою черепно-мозковою травмою.
3. Незначна вираженість набрякового синдрому при застосуванні для волемічної підтримки збалансованого кристалоїдного розчину дозволяє покращити параметри зовнішнього дихання, що зменшує кількість ускладнень з боку дихальної системи, тривалість проведення ШВЛ, а відповідно і перебування у відділенні інтенсивної терапії та термінів лікування.
Список литературы
1. Bentsen G., Breivik H., Lundar T. // Acta Anaesthesiol. Scand. — 2004. — Vol. 48, № 9. — P. 732-747.
2. Bentsen G., Breivik H., Lundar T. // Crit. Care Med. — 2006. — Vol. 34, № 12. — P. 2912-2917.
3. Harutjunyan L., Holz C., Rieger A. // Crit. Care. — 2005. — Vol. 9. — P. R530-R540.
4. Segal J.B., Blasco-Colmenares E., Norris E.J. et al. // Transfusion. — 2004. — Vol. 44. — P. 632-644.
5. Stummer W. // Neurosurg. Focus. — 2007. — Vol. 22, № 5. — P. E8.
6. Wallis J.P., Wells A.W., Matthews J.N. et al. // Transfusion. — 2004. — Vol. 44, № 7. — P. 1025-1032.
7. Zander R., Adams H.A., Boldt J., Hiesmayr M.J., Meier-Hellmann A., Spahn D.R., Standl T. Forderungen und Erwartungen an einen optimalen Volumenersatz // Anästhesiol Intensivmed Notfallmed Schmerzther — 2005. — Vol. 40.
8. Lang W., Zander R. Prediction of dilutional acidosis based on the revised classical dilution concept for bicarbonate // J. Appl. Physiol. — 2005. — Vol. 98. — P. 62-71.
9. Battison С., Andrews P.J.D., Graham С. // Critical care journals. — 2005.
10. Mehta D., Malik A.B. Signaling mechanisms regulating endothelial permeability // Physiological Reviews — 2006. — Vol. 86. — P. 279-367.
11. Бєляєв А.В. Синдром капілярної витоку // Мистецтво лікування. — 2005. — № 24. — С. 92-101.
12. Потапов А.А., Крылов В.В., Лихтерман Л.Б. и др. Современные рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы // Вопросы нейрохирургии им. Н.Н. Бурденко. — 2006. — № 1. — С. 3-8.
13. Царенко С.В. Современные подходы к интенсивной терапии тяжелой черепно-мозговой травмы // Анестезиология и реаниматология. — 2003. — № 2. — С. 45-49.
14. Царенко С.В., Крылов В.В., Тюрин Д.Н. и др. Коррекция артериальной гипертензии в практике интенсивной терапии у больных с черепно-мозговой травмой и сосудистыми заболеваниями головного мозга // Медицина неотложных состояний. — 2007. — № 3(10). — С. 71-74.

/109.jpg)