Статья опубликована на с. 126-130
Введение
Преэклампсия (ПЭ) является одним из грозных гестационных осложнений, которое проявляется гипертензией во второй половине беременности и приводит к синдрому полиорганной недостаточности у матери и дистрессу плода. В ее развитии основную роль играет отсутствие полноценной трансформации узких спиральных артерий в широкие и рефрактерные к вазоактивным стимулам маточно-плацентарные сосуды [1–3]. Ишемия плаценты способствует синтезу и высвобождению в кровоток матери вазоконстрикторов. Важную роль в патогенезе ПЭ играют синдром системного воспалительного ответа, тромбофилия, оксидативный стресс и эндотелиальная дисфункция [1–4]. Известно, что генерализованный сосудистый спазм, гиповолемия и гиперкоагуляция — черты тяжелой ПЭ, которая имеет раннее начало, характеризуется быстрым прогрессированием клинической картины и низкой эффективностью антигипертензивных препаратов. При легком и среднетяжелом течении ПЭ на первый план выходят симптомы, связанные с эндотелиальной дисфункцией уже в конце процесса гестации. Эти беременные поддаются консервативной терапии, но все-таки в большинстве случаев нуждаются в досрочном родоразрешении [4].
Нарушения автономной нервной регуляции матери на фоне ПЭ проявляются гиперсимпатикотонией [5–8]. Последняя оказывает влияние на тип центральной материнской гемодинамики (ЦМГ). Снижение уровня парасимпатической регуляции у беременных с ПЭ в последние годы принято связывать с уменьшением экскурсии диафрагмы на фоне значительного повышения внутрибрюшного давления [5]. Поэтому изменения симпатовагального баланса могут обладать определенной ценностью в прогнозировании и ранней диагностике ПЭ, а также способствовать усовершенствованию существующих подходов к ведению данного контингента беременных.
Целью работы было изучение взаимосвязи симпатовагального баланса и типа ЦМГ у беременных с ПЭ.
Материалы и методы
Протокол исследования был одобрен комитетом по биоэтике медицинской академии последипломного образования. Наблюдаемые беременные были проинформированы о методах исследования, его целях, показаниях и возможных осложнениях до включения в исследование. Все пациентки дали письменное информированное согласие на участие в исследовании.
Всего были обследованы 102 беременные в сроках гестации 32–37 недель, 30 из которых были с физиологическим течением процесса гестации и составили группу I (контроля). Во II группе под наблюдением находилось 40 беременных с ПЭ легкой и средней степени. К III группе были отнесены 32 пациентки с ПЭ тяжелой степени.
У всех обследованных беременных проводили изучение типа ЦМГ методом биоимпедансной кардиографии на реографическом комплексе «Реоком» (НТЦ «ХАИ Медика», Украина) и показателей вариабельности сердечного ритма (ВСР) матери на 10-минутных записях в положении лежа на правом боку с помощью компьютерно-диагностической системы «Кардиолаб» (НТЦ «ХАИ-Медика», Украина). В ходе изучения ЦМГ проводили определение сердечного индекса (СИ) и общего периферического сопротивления сосудов (ОПСС). По частотным показателям ВСР оценивали значение общей мощности спектра ВСР (TP) и мощности трех спектральных компонентов: очень низкочастотного (VLF), низкочастотного (LF) и высокочастотного (HF). Изучали следующие временные характеристики ВСР матери: SDNN (стандартное отклонение кардиоинтервалов), RMSSD (квадратный корень из суммы квадратов разности величин последовательных пар RR-интервалов), pNN5O (процент количества пар последовательных кардиоинтервалов, отличающихся более чем на 50 мс), АМо (число кардиоинтервалов, соответствующих значению моды (или попавших в модальный интервал) в проценте к объему выборки и стрессовый индекс, который определяется отношением высоты гистограммы к ее ширине и характеризует степень напряжения регуляторных систем организма. Все обследованные пациентки с ПЭ получали антигипертензивные препараты в соответствии с типом ЦМГ. Беременным с гиперкинетическим типом ЦМГ назначали карведилол по 6,25–12,5 мг 2 раза в сутки, эукинетическим типом — метилдопу по 250–500 мг 4 раза в сутки, а при гипокинетическом — метилдопу по 500 мг 4 раза в сутки и нифедипин по 20 мг 2 раза в сутки.
Полученные результаты обработаны статистически методами параметрической статистики (среднее — M, ошибка — m) с помощью пакета программ Excel, адаптированных для медико-биологических исследований. Для сравнения данных между группами обследованных использовали тест ANOVA. Для изучения корреляции был использован тест Спирмена.
Результаты
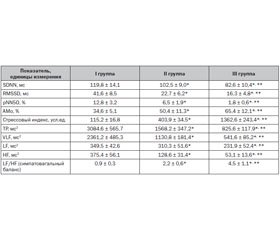
Изучение типов ЦМГ позволило установить увеличение значений СИ и ОПСС у пациенток с ПЭ легкой и средней степени (табл. 1). У беременных с ПЭ тяжелой степени были отмечены снижение показателей СИ и значительное возрастание ОПСС, что отражало увеличение пред- и постнагрузки на сердце матери. Гиперкинетический тип ЦМГ был обнаружен у 77,8 % пациенток II группы, у остальных 22,2 % беременных с ПЭ легкой и средней степени было установлено наличие эукинетического типа ЦМГ. В III группе обследованных преобладал гипокинетический тип ЦМГ — 59,4 % беременных с ПЭ тяжелой степени. Эукинетический тип ЦМГ был отмечен у 40,6 % пациенток III группы. Таким образом, гипердинамическая модель гемоциркуляции с нормальным или слегка повышенным ОПСС и увеличенным сердечным выбросом была характерной для беременных с ПЭ легкой и средней степени. На фоне ПЭ тяжелой степени гиподинамический паттерн системы кровообращения на фоне значительно возросшего ОПСС и уменьшенного сердечного выброса был отражением формирующейся сердечной недостаточности.
/127.jpg)
Полученные результаты отражали угнетение вегетативной функции у беременных с ПЭ (табл. 2). Наибольшую мощность демонстрировали спектральные компоненты ВСР в области VLF, что было следствием значительной активации гипоталамо-гипофизарно-надпочечниковой оси у обследованного контингента. На фоне ПЭ было установлено возрастание активности центрального симпатического контура. Об этом свидетельствовало относительное увеличение значений AMo, стрессового индекса и LF. Гиперсимпатикотония была проявлением отсутствия гестационной перестройки автономной нервной регуляции у беременных с ПЭ. Величина симпатовагального баланса у беременных I, II и III групп соответственно составил 0,9 ± 0,3, 2,2 ± 0,6 и 4,5 ± 1,1. Постепенное возрастание автономного баланса у беременных с ПЭ было отмечено соответственно увеличению степени тяжести ПЭ. Значения показателей парасимпатического звена вегетативной функции — RMSSD, pNN5O и HF были снижены во II и III группах. Поэтому ПЭ уменьшала влияние n. vagus на регуляцию системы кровообращения, что сопровождалось снижением активности автономного контура и кардиореспираторной синхронизации.
Изучение корреляционных взаимоотношений между симпатовагальным балансом и показателями ЦМГ позволило выявить определенные закономерности (табл. 3).
Была обнаружена слабая корреляционная зависимость между симпатовагальным балансом и СИ (R = –0,30; p < 0,05), симпатовагальным балансом и ОПСС (R = 0,32; p < 0,05) у беременных группы контроля. У пациенток с ПЭ легкой и средней степени тяжести сила корреляционной взаимосвязи в парах симпатовагальный баланс versus СИ (R = –0,34; p < 0,05) и симпатовагальный баланс versus ОПСС (R = 0,38; p < 0,05) была практически на прежнем уровне. Отмечено возрастание силы корреляции Спирмена между симпатовагальным балансом и СИ (R = –0,63; p < 0,05), симпатовагальным балансом и ОПСС (R = 0,70; p < 0,05) у беременных с тяжелой ПЭ. Это отражало, что гипокинетический тип ЦМГ на фоне ПЭ тяжелой степени в III группе был обусловлен избыточным повышением симпатовагального баланса.
Обсуждение
Проведенные исследования позволили установить, что в положении лежа на правом боку сохранялось сбалансированное влияние автономной нервной регуляции с обеспечением протекторной роли парасимпатического звена на гемодинамику матери при физиологическом течении беременности. Именно в этой позиции беременная матка осуществляет компрессию на аорту и полую вену [5]. Известно, что значительная компрессия сопровождается снижением венозного возврата к сердцу и активирует симпатические механизмы поддержания сосудистого тонуса [4, 8]. В ходе исследования было установлено несоответствие увеличения симпатовагального баланса в ответ на сдавление брюшной аорты и нижней полой вены у женщин с ПЭ. Это дает возможность считать, что в стимуляции симпатических центров принимал участие дополнительный механизм компрессии магистральных сосудов — повышенное внутрибрюшное давление. Поэтому гиперсимпатикотония могла быть следствием абдоминальной компартментализации. Это приводило к застойному венозному депонированию крови в брюшной полости, дальнейшему снижению возврата к сердцу и усилению симпатических реакций на гиповолемию. Таким образом, цепь событий: повышение внутрибрюшного давления, увеличение аортокавальной компрессии, гиповолемия и гиперсимпатикотония — носила характер порочного круга. Гипотеза о значительной роли абдоминальной компартментализации в патогенезе ПЭ требует дальнейшего изучения и детализации.
Полученные в ходе работы данные поддерживают хорошо известную гипердинамическую модель легкой и среднетяжелой ПЭ. Сохраняющаяся гестационная гиперволемия при возросшем тонусе периферических сосудов обеспечивала увеличенный сердечный выброс. Дальнейший переход к гиповолемии и сниженному сердечному выбросу отражал гиподинамическую гемоциркуляцию на фоне тяжелой ПЭ [4]. Указанные особенности позволяют считать гиперсимпатикотонию у пациенток с легкой и среднетяжелой ПЭ компенсаторной реакцией. Она была направлена на обеспечение перфузии во внутренних органах матери. Тяжелая ПЭ сопровождалась максимальным возрастанием симпатической регуляции. Высокое ОПСС и гиповолемия приводили к гипоперфузии конечных органов у пациенток с тяжелой ПЭ. Таким образом, ПЭ разрушала гестационный ресеттинг автономной нервной системы, направленный на поддержание гиперволемии и низкого ОПСС.
У женщин репродуктивного возраста парасимпатическая нервная регуляция преобладает над активностью симпатического звена вегетативной функции. Это особенно характерно для I половины беременности. Повышение мощности вагального тона создает необходимые условия для возрастающего уровня эрго-, трофотропных реакций, в основе которых лежит гиперволемия [5–7]. На фоне ПЭ отмечено увеличение активности симпатической регуляции. В ряде исследований было продемонстрировано троекратное и более превышение мощности симпатического тона на фоне ПЭ аналогичного показателя при физиологическом течении беременности [6, 7]. Дополнительное снижение уровня парасимпатической регуляции значительно увеличивало симпатовагальный баланс у беременных с ПЭ. Уменьшение активности парасимпатического звена вегетативной функции было связано с уменьшением роли дыхательной синусовой аритмии в генезе феномена ВСР. Это могло быть обусловлено ограниченной подвижностью дыхательной мускулатуры на фоне повышения формирования абдоминального компартмента [5]. Известно, что угнетение активности автономного контура регуляции сопровождается эндотелиальной дисфункцией, оксидативным стрессом, синдромом системного воспалительного ответа матери и тромбофилией [3]. Значительное повышение симпатовагального баланса было признаком генерализованного сосудистого спазма и гипоперфузии внутренних органов. Ранее маточно-плацентарный контур гемодинамики и почечные артерии были установлены как зоны наибольшего сосудистого сопротивления на фоне ПЭ [1, 2, 4]. Проведенная работа демонстрировала, что даже патогенетически обусловленное в соответствии с типом ЦМГ назначение антигипертензивных препаратов не обеспечивало восстановления симпатовагального баланса. Поэтому единственным эффективным лечением пациенток с тяжелой ПЭ остается прерывание беременности. Возможно, что лишь снижение внутрибрюшного давления в послеродовом периоде может способствовать восстановлению симпатовагального баланса. Симпатовагальный баланс может рассматриваться как важный биофизический маркер ПЭ, который является отражением степени тяжести заболевания и связанных с них гемодинамических нарушений.
Заключение
Гиперсимпатикотония у беременных с ПЭ являлась следствием формирования абдоминального компартмента. Это сопровождалось угнетением парасимпатического звена автономной нервной регуляции. Повышение симпатовагального баланса приводило к гиповолемии, возрастанию ОПСС и снижению СИ. Величина симпатовагального баланса более 2,0 может считаться биофизическим маркером ПЭ. В дальнейшем необходимо проведение изучения предикторной роли симпатовагального баланса у беременных группы высокого риска по развитию ПЭ.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Список литературы
1. Rosser M.L., Katz N.T. Preeclampsia: an obstetrician's perspective // Adv. Chronic. Kidney Dis. — 2013. — 20(3). — 287-296.
2. Hladunewich M., Karumanchi SA., Lafayette R. Pathophysiology of the Clinical Manifestations of Preeclampsia // Clin. J. Am. Soc. Nephrol. — 2007. — 2. — 543-549.
3. Jerath R., Barnes V.A., Fadel H.E. Mechanism of development of preeclampsia linking breathing disorders to endothelial dysfunction // Med. Hypoth. — 2009. — 73(2). — 163-166.
4. Tamás P.I.Z., Szilágyi A. Discordant clinical characteristics suggest different pathogenesis of praeeclampsia // J. Perinat. Med. — 2007. — 35(suppl. 2). — 278.
5. Maeda K. Preeclampsia is caused by continuous sympathetic center excitation due to an enlarged pregnant uterus // J. Perinat. Med. — 2014. — 42(2). — 233-237.
6. Schobel H.P., Fischer T., Heuszer K. et al. Preeclampsia — a state of sympathetic over activity // N. Engl. J. Med. — 1996. — 335. — 1480-1485.
7. Yang C.C.H., Chao T., Kuo B.J.K. et al. Preeclamptic pregnancy is associated with increased sympathetic and decreased parasympathetic control of HR // American Journal of Physiology — Heart and Circulatory Physiology. — 2000. — 278. — 1269-1273.
8. Andrietti S., Kruse A.J., Bekkers S.C. et al. Cardiac adaptation to pregnancy in women with a history of preeclampsia and a subnormal plasma volume // Reprod. Sci. — 2008. — 15(10). — 1059-1065.

/127.jpg)
/128.jpg)