Статья опубликована на с. 131-134
Актуальность
Аварии мирного времени, сопровождающиеся взрывами и пожарами в замкнутом пространстве, помещениях промышленных объектов, возгорание пиротехники в местах скопления людей, аварии на транспорте, применение зажигательного оружия в локальных военных конфликтах способны стать причиной многофакторного поражения у обожженных [1]. В очаге пожара человек подвергается воздействию нескольких поражающих факторов. Во-первых, это высокая температура окружающего воздуха, приводящая к ожогу кожных покровов и к общему перегреванию организма. Во-вторых, поражающим фактором являются токсичные продукты горения, вдыхаемые с воздухом и приводящие к острым отравлениям, наибольшее представительство из которых составляет монооксид углерода (СО) — угарный газ.
По статистике Государственной службы Украины по чрезвычайным ситуациям, в январе — феврале 2015 года на территории Украины (кроме временно оккупированных территорий и областей, где проводится АТО) возникло 937 пожаров с 527 погибшими людьми.
В структуре острых отравлений в цивилизованных странах на угарный газ приходится от 15 до 30 % от всех отравлений. Анализ показывает, что большинство пострадавших умирает на начальной стадии развития огненного бедствия, то есть еще до прибытия пожарно-спасательных подразделений. 66,9 % от общего количества погибших приходится на пострадавших с отравлением угарным газом и продуктами горения [2, 3].
Токсичность окиси углерода обусловлена прежде всего его концентрацией в воздухе и продолжительностью экспозиции. Однако тяжесть интоксикации также зависит от других факторов: первоначального и функционального состояния, возраста (тяжелее отравления протекают у детей и пожилых людей).
Токсикодинамика отравления СО такова, что главным путем элиминации СО из организма является дыхательная система. Около 60–70 % яда выводится в течение первого часа. Более 96 % яда выделяется через 4 часа после отравления. Последние остатки окиси углерода остаются растворенными в плазме крови и полностью исчезают в течение 12 часов.
Влияние угарного газа на организм человека сопровождается ускоренным образованием эндогенного СО. При вдыхании газовой смеси с содержанием 6,8 % монооксида углерода в течение 30 минут ускоряется скорость образования эндогенного СО в 5 раз. Гипоксия и высокие концентрации угарного газа могут приводить к деградации гема и развитию декомпенсированного ацидоза. Наиболее чувствительными к многофакторной гипоксии при отравлении угарным газом оказываются нервная и сердечно-сосудистая системы. Образование в крови карбоксигемоглобина значительно снижает доступ кислорода к тканям. Очень быстро развиваются острая дыхательная недостаточность, пневмония. На электрокардиографии выявляются нарушения ритма и проводимости, признаки ишемии миокарда [3, 4].
Наибольшие трудности в лечении обожженных возникают при сочетании ожогов кожи с термоингаляционным поражением дыхательных путей. У таких больных течение шока резко отягощается из-за токсического воздействия ядовитых продуктов горения на дыхательные пути и организм в целом. Особенностью инфузионной терапии у этих больных является, с одной стороны, агрессивность, а с другой — большая осторожность в определении объема и скорости инфузии, поскольку постоянно имеется угроза развития отека легких, а снижение темпа и количества вводимых внутривенно жидкостей вызывает снижение перфузии внутренних органов, что, в свою очередь, способствует сохранению и усугублению гиповолемии [1, 5].
Высокая смертность тяжелообожженных в периоде ожогового шока и в ближайшее время после выхода из него свидетельствует о том, что вопросы, связанные с коррекцией у них расстройств кровообращения, далеки от разрешения.
Материалы и методы
Цель исследования — определение механизмов, способствующих раннему формированию синдрома гемодинамических расстройств у пострадавших с многофакторным токсикотермическим поражением, на основании полученных данных определение возможных путей улучшения качества интенсивной терапии у данной категории пострадавших.
Для реализации поставленных целей и задач проведено обследование 46 пострадавших с тяжелой термической травмой в возрасте от 30 до 50 лет.
Дизайн исследования включал две группы пострадавших с ожоговой травмой. Первая группа — 25 человек с ожоговой травмой в сочетании с отравлением угарным газом и вторая группа — 21 человек с ожоговой травмой без признаков отравления угарным газом. Группы были рандомизированы по возрасту и степени тяжести ожоговой травмы. Средний возраст в 1-й группе составил 39,74 ± 3,90 года, во 2-й — 38,88 ± 2,94 года.
Индекс тяжести термического поражения (ИТТП) в 1-й группе составлял 88,26 ± 2,75 усл.ед., во 2-й — 86,96 ± 6,46 усл.ед. и выше. ИТТП представляет собой модифицированный индекс Франка и используется в качестве показателя тяжести термического поражения [40].
Критериями исключения были предшествующие хронические заболевания сердца, легких, печени, почек.
В целом больные обеих групп имели сравнимую по тяжести термическую травму, различия статистически недостоверны (р ≥ 0,05).
У всех больных в динамике мониторировались показатели артериального давления, пульс, центральное венозное давление, частота дыхательных движений, почасовый и суточный диурез, анализировались клинические и биохимические показатели крови.
Контролируемые параметры центральной гемодинамики включали ударный объем (УО), систолический индекс, минутный объем крови, сердечный индекс (СИ), фракцию выброса (ФВ). Указанные показатели определялись с применением переносного ультразвукового диагностического сканера модели MINDRAY DP 6600 с использованием датчика с фазированной решеткой, частота 2–4 MHz, применялся В- и М-режим в парастернальной позиции по длинной оси. Показатели общего периферического сосудистого сопротивления (ОПСС) и удельного периферического сосудистого сопротивления (УПСС) рассчитывались по Н.Н. Савицкому (1974): ОПСС = АДср × 1333 × 60/МОК; УПСС = ОПСС/ST, где ST — площадь поверхности тела, вычисляемая по формуле Дюбуа.
Уровень карбоксигемоглобина определяли при помощи портативного пульсоксиметра с технологией Rainbow Masimo SET: Masimo RAD 57.
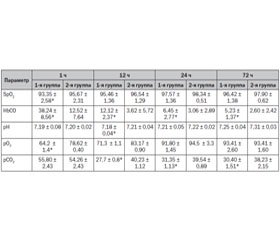
Исследования проводились при поступлении, через 12, 24 и 72 часа.
Статистическая обработка данных проводилась в соответствии с правилами обработки медико-биологической информации с помощью пакета лицензионных Microsoft Excel 2010 для ПЭВМ. Для оценки достоверности различий двух связанных выборок к параметрическим критериям использовали t-критерий Стьюдента для зависимых и независимых выборок, к непараметрическим — критерий Манна — Уитни для независимых и T-критерий Вилкоксона для зависимых выборок. При проведении множественных сравнений проводился непараметрический ранговый однофакторный анализ Крускала — Уоллиса.
Результаты и их обсуждение
В ходе проведенного сравнительного исследования было установлено, что у пострадавших в начальном периоде ожоговой болезни происходит развитие метаболического ацидоза на фоне дефицита гемического транспорта кислорода (табл. 1). Согласно полученным данным более выраженными эти изменения были в 1-й группе пострадавших. Так, достоверно (р ≤ 0,05) по сравнению со 2-й группой на всем протяжении исследования, несмотря на высокий уровень pO2 артериальной крови, изменения кислотно-основного состояния соответствовали метаболическому ацидозу. Данные обстоятельства косвенно свидетельствовали о неадекватной оксигенации тканей и наличии анаэробного гликолиза.
При поступлении у всех пострадавших наблюдались клинические и лабораторные признаки гипоксии. При этом в первой группе пациентов снижение pаO2 и повышение pаСO2 сохранялись на протяжении первых 12 часов наблюдения (р ≤ 0,05). На последующих этапах исследования показатель pO2 артериальной крови оставался в пределах физиологической нормы. Применение кислорода как антидота СО в высоких концентрациях у пациентов 1-й группы приводило к повышенной элиминации О2 и служило причиной формирования гипокапнии (табл. 1). Уровень HbСО у всех пациентов постепенно снижался к 12-му часу лечения и через 24 часа у всех пострадавших соответствовал физиологическому уровню.
Показатели центральной гемодинамики на фоне противошоковых мероприятий демонстрировали уменьшение УО, ФВ, СИ, УИ с увеличением ОПСС, что свидетельствовало о снижении производительности сердца (табл. 2).
Обращала на себя внимание сохраняющаяся в течение всего периода исследования низкая производительность сердца у пациентов с термотоксическим поражением (р ≥ 0,05 между этапами исследования). Выявлялась средняя (r = 0,52; r = 0,47) корреляционная зависимость между динамикой уровня HbСО, pаO2 и ФВ на первом этапе исследования. Также имела место прямая корреляционная зависимость (r = 0,62) между pаСO2 и значениями ОПСС. Высокие величины ОПСС на всех этапах исследования указывали на создание сопротивления кровотоку при низких параметрах производительности миокарда. Риск развития отека легких на фоне жидкостной реанимации был более высоким у пациентов с термотоксическим поражением и на 2–3-е сутки лечения был зафиксирован у 8 (32 %) человек.
Заключение
Формирование синдрома гемодинамических расстройств у пострадавших с многофакторным термотоксическим поражением на фоне отравления угарным газом протекает в условиях выраженного метаболического ацидоза. Высокое ОПСС способствует поддержанию нарушенной перфузии тканей, снижению сократительной способности миокарда. Указанные факторы препятствуют поддержанию необходимого темпа жидкостной реанимации и являются основанием для поиска и разработки новых принципов и схем противошоковых мероприятий у пострадавших с многофакторным термотоксическим поражением.

/133.jpg)