Статтю опубліковано на с. 139-143
Вступ
Щорічно в світі діагностується близько 16,9 млн інсультів, з них близько 5,9 млн завершується летальними випадками. У країнах Західної Європи, США, Японії, Австралії за останні 15 років смертність від інсульту знизилася більше ніж на 50 % (щорічно на 3–7 %). У даний час цей показник становить 37–47 осіб на 100 тис. населення [1, 3, 6].
Серед причин смертності в Україні інсульт значно випередив злоякісні новоутворення і впевнено посідає друге місце на відміну від багатьох інших країн. Смертність від даної патології серед чоловіків віком 47–74 роки становить 606 осіб, а серед жінок — 408 осіб на 100 тис. населення. Це, відповідно, в 11,2 і 12,75 раза вище порівняно зі Швейцарією і в декілька разів — порівняно з іншими країнами Європи [8, 9]. Навіть порівняно з Росією, від якої Україна мало відрізняється за соціально-економічним розвитком і структурою системи охорони здоров’я, смертність від інсульту серед чоловіків більша в 1,5 раза, а серед жінок — майже у 2 рази [2, 4]. До того ж статистика інсульту в Україні має тенденцію до подальшого погіршення, тоді як у багатьох інших країнах ситуація суттєво покращується.
В Україні сучасна стратегія лікування інсульту впроваджується повільно. Лише 13–15 % хворих на інсульт госпіталізуються в межах терапевтичного вікна, частина хворих узагалі не госпіталізуються до стаціонарів і не отримують адекватної допомоги [5, 8].
В основі розвитку гострого порушення мозкового кровообігу за підтипом ішемії лежить порушення гемодинаміки по привідній артерії. Тривалість та етіопатогенетичний механізм даного порушення і визначає в подальшому неврологічний дефіцит і можливості його регресу у майбутньому [7]. З огляду на вищенаведене актуальним постає питання ранньої діагностики порушень гемодинаміки у пацієнтів із гострим ішемічним інсультом і їх впливу на локалізацію і величину зони некрозу головного мозку, неврологічний дефіцит і можливості функціонального відновлення пацієнта.
Матеріали та методи
У роботі подані обстеження 74 хворих у гострому періоді ішемічного інсульту, які отримали стандартну терапію згідно з локальним протоколом (до даного спостереження не включались пацієнти, яким була проведена тромболітична терапія). Для дослідження відбирали хворих з атеротромботичним (АТ) і кардіоемболічним (КТ) підтипами ішемічного інсульту, які надійшли до стаціонару в перші 4,5 години з моменту розвитку захворювання. Хворі з іншою або не встановленою етіологією ішемічного інсульту були виключені з дослідження. Всього до групи спостереження увійшли 31 жінка та 43 чоловіки віком від 38 до 79 років (середній вік 64,7 ± 6,3 року).
Для оцінки неврологічного дефіциту користувалися шкалою Національного інституту здоров’я США (National Institutes of Healht, США; Liden et al., 1994). Відповідно до даної шкали бал 0 характеризує нормальний стан пацієнта, 34 бали — коматозний. Сумарний бал клінічних проявів від 3 до 8 свідчить про неврологічні порушення легкого ступеня тяжкості, 9–12 балів — про порушення середнього ступеня тяжкості; від 13 до 15 — тяжкі порушення, понад 15 — про надто тяжкий стан хворого.
Для визначення результативності реабілітаційних заходів і характеристики досягнутого рівня повсякденної життєвої активності хворих при різних підтипах ішемічного інсульту ми користувалися модифікованою шкалою Ренкіна (mRS). За цією шкалою бал 0 означає відсутність симптоматики; 1 бал характеризує відсутність суттєвої недієздатності (хворий здатний виконувати всі звичайні обов’язки та свою роботу); 2 бали — легка недієздатність (хворий не здатний до праці на своєму попередньому місці, але може за собою доглядати без допомоги сторонньої людини); 3 бали — помірна недієздатність (пацієнт потребує допомоги, але пересувається самостійно); 4 бали — помірно тяжка недієздатність (хворий не здатний пересуватися без сторонньої допомоги та потребує її для реалізації фізіологічних потреб); 5 балів — тяжка недієздатність (хворий прикутий до ліжка і потребує постійного догляду та уваги); 6 балів — померлий.
Дослідження мозкової гемодинаміки у хворих із гострим порушенням мозкового кровообігу проводили на момент надходження до стаціонару. В дослідженні використовували допплерограф Hivision Ascendus виробництва фірми Hitachi (Японія). При проведенні спектрального допплерівського аналізу оцінювали якісні (форма допплерівської кривої, наявність «спектрального» вікна) та кількісні параметри (швидкісні характеристики потоку, рівень периферичного опору, допплерівський спектр, цереброваскулярний резерв).
Результати та обговорення
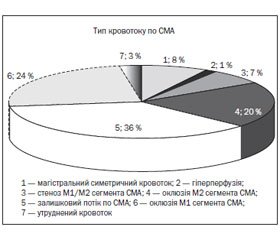
За даними дуплексного сканування магістральних артерій голови і шиї на момент надходження до стаціонару, у хворих відповідно до загальноприйнятих принципів класифікації було виділено такі види допплерограм: симетричний магістральний кровоток, гіперперфузія, залишковий потік по середній мозковій артерії (СМА) на фоні атеротромбозу/оклюзії внутрішньої сонної артерії (ВСА), оклюзія/стеноз М1 сегмента СМА, оклюзія/стеноз М2 сегмента СМА, порушення перфузії на фоні набряку головного мозку (рис. 1).
Залишковий потік по СМА на фоні атеротромбозу/оклюзії ВСА
У 27 (36,5 %) випадках нами був виявлений залишковий потік по СМА на фоні атеротромбозу/оклюзії привідної артерії. У 25 (33,8 %) випадках на момент надходження до стаціонару було зареєстровано атеротромбоз в ділянці біфуркації ЗСА/гирлі ВСА з редукцією кровотоку в іпсилатеральних СМА і передній мозковій артерії (ПМА), підвищенням показників периферичного опору в екстракраніальному відділі ВСА/загальної сонної артерії (ЗСА) за рахунок дистально розташованої перешкоди кровотоку.
Середні значення основних допплерографічних показників у групі наведені в табл. 1.
При аналізі даних комп’ютерної/магнітно-резонансної томографії (КТ/МРТ) головного мозку виявили 2 (7,4 %) пацієнтів з лакунарними інфарктами головного мозку в підкіркових структурах. У 7 (25,9 %) пацієнтів виявили малі кіркові інфаркти, в 11 (40,7 %) — кірково-підкіркові інфаркти. Обширний глибинний і тотальний інфаркти мозку були зареєстровані у 2 (7,4 %) і 5 (18,5 %) випадках відповідно. При оцінці за шкалою ASPECT понад 7 балів було у 19 осіб і менше 7 балів — у 8 осіб. У 5 пацієнтів із тотальним інфарктом мозку (менше 7 балів за шкалою ASPECT) було зареєстровано летальні випадки на –21-шу добу з моменту захворювання. Причиною смерті в усіх випадках був набряк-набухання головного мозку.
Згідно з результатами клініко-неврологічного обстеження за шкалою NIHSS неврологічний дефіцит легкого і середнього ступеня був зареєстрований у 18 (66,6 %) пацієнтів, тяжкий — у 4 (14,8 %) пацієнтів і надтяжкий — у 5 (18,5 %).
Ступінь відновлення неврологічного дефіциту на 21-й день захворювання за модифікованою шкалою Ренкіна у 9 хворих (33,3 %) становив 0–2 бали, у 3 хворих (11,1 %) — 3 бали, у 10 (37,0 %) — 4–5 балів і у 5 (18,5 %) — 6 балів. На 21-й день захворювання летальність у цій підгрупі була 18,5 %.
У 2 (7,4 %) пацієнтів виявився залишковий потік по СМА на фоні оклюзії інтракраніальної ділянки ВСА при ішемічному інсульті КЕ підтипу. За даними КТ/МРТ головного мозку, в обох випадках мав місце тотальний півкульовий інфаркт мозку, що поширювався на територію кровопостачання як СМА, так і ПМА.
Неврологічний дефіцит за шкалою NIHSS становив 18 і 20 балів і був оцінений як надтяжкий. Хворі померли на 3-тю і 6-ту добу від початку захворювання.
Стеноз/оклюзія СМА
У 5 (6,8 %) пацієнтів з АТ підтипом ішемічного інсульту підвищення середньої лінійної швидкості кровотоку (ЛШК) у СМА на боці інсульту було понад 80 см/с з ознаками порушення спектральних характеристик, індекс спектрального розширення 0,68 ± 0,12. Причиною даних змін могло бути як гемодинамічно незначиме ураження М1 сегмента СМА, так і стенотичні ураження М2 (дистального) сегмента СМА різного ступеня тяжкості.
Середні значення основних допплерографічних показників у групі подані в табл. 2.
У 33 (44,6 %) пацієнтів з АТ і КЕ підтипами ішемічного інсульту було діагностовано оклюзію М1 або М2 сегмента СМА. У 2 (2,7 %) пацієнтів з АТ підтипом ішемічного інсульту було відзначено зниження середньої ЛШК по СМА менше 20 см/с (оклюзія М1 сегмента СМА), у 7 (9,5 %) — більше 20 см/с. Середня ЛШК не була нижчою за 20 см/с на фоні стенотичного ураження привідної ВСА менше 75 %. Це дозволило виключити субоклюзію/оклюзію привідних ВСА і ЗСА і віднести даний тип до атеротромбоемболічної оклюзії М2 сегмента СМА.
Подібний тип кровотоку по СМА з ЛШК нижче 20 см/с (оклюзія М1 сегмента) на фоні відсутності значних атеросклеротичних змін привідних магістральних артерій шиї і голови був зареєстрований у 16 (21,6 %) пацієнтів з КЕ підтипом ішемічного інсульту. У інших 8 (10,8 %) пацієнтів з КЕ підтипом ішемічного інсульту було діагностовано оклюзію М2 сегмента СМА.
Середні значення основних допплерографічних показників у групі наведені в табл. 3.
При дослідженні хворих зі стенотичним ураженням СМА в 1 (1,4 %) випадку розташування стенозуючої атеросклеротичної бляшки в ділянці відходження лентикулостріарних артерій був зареєстрований розвиток обширного глибинного інфаркту. У 3 (4,2 %) випадках було зареєстровано малий кірковий інфаркт; кірково-підкірковий інфаркт спостерігався в 1 (1,4 %) хворого.
У випадку атеротромбоемболічної або кардіоемболічної оклюзії М1 сегмента СМА у 4 (5,4 %) випадках спостерігався тотальний інфаркт, в 5 (6,8 %) — обширний глибинний інфаркт, в 8 (10,8 %) пацієнтів кірково-підкірковий, а в 1 (1,4 %) — малий кірковий інфаркт мозку. У випадку оклюзії М2 сегмента СМА малий кірковий і кірково-підкірковий інфаркти спостерігалися в 6 (8,1 %) і 8 (10,8 %) пацієнтів відповідно. В 1 (1,4 %) випадку виявлено обширний глибинний інфаркт (табл. 4).
/142.jpg)
За результатами клініко-неврологічного обстеження хворих на момент надходження до стаціонару у 3 (60,0 %) пацієнтів зі стенозом М1/М2 сегмента СМА було діагностовано легкий неврологічний дефіцит за шкалою NIHSS; у 2 (40,0 %) пацієнтів неврологічний дефіцит був середнього ступеня тяжкості. У випадку оклюзії М1 сегмента СМА у 5 (27,8 %) пацієнтів був виявлений тяжкий неврологічний дефіцит, у 2 (11,1 %) — дефіцит був вкрай тяжким. Неврологічний дефіцит середнього і легкого ступеня спостерігався в 10 (55,6 %) і 1 (5,6 %) пацієнта відповідно. Оклюзія М2 сегмента СМА корелювала з неврологічним дефіцитом середнього і легкого ступеня в 7 (46,7 %) і 6 (40,0 %) пацієнтів відповідно. В 2 (13,3 %) пацієнтів виявили неврологічний дефіцит тяжкого ступеня.
На 21-й день госпіталізації відновлення неврологічних порушень за модифікованою шкалою Ренкіна у 3 (60,0 %) хворих зі стенозом М1/М2 сегмента СМА становило 0–2 бали, що свідчило про повне відновлення або легку неспроможність у більшої частини пацієнтів, а у 2 (40,0 %) була відзначена помірно тяжка недієздатність. У хворих з оклюзією М1 сегмента СМА на 21-шу добу захворювання повне відновлення або легка неспроможність були у 2 (11,1 %) пацієнтів, помірна і помірно тяжка неспроможність була відмічена в 10 (55,6 %); у 3 (16,7 %) пацієнтів виявлена тяжка неспроможність і у 3 хворих зафіксовано (16,7 %) летальні випадки. У пацієнтів з оклюзією М2 сегмента СМА лише в 1 (6,7 %) випадку були виявлені помірна і помірно тяжка неспроможність, в 4 (26,6 %) випадках тяжка неспроможність, у той час коли у 9 (60,0 %) хворих було повне відновлення або легка неспроможність.
Отже, стеноз М1/М2 сегмента і оклюзія М2 сегмента СМА асоціювались з добрим відновленням життєдіяльності, в той час як оклюзія М1 сегмента СМА прогностично мала менш сприятливий характер.
Симетричний магістральний кровоток
У 2 (2,7 %) пацієнтів з АТ і в 4 (5,4 %) пацієнтів з КЕ підтипами ішемічного інсульту реєструвався магістральний тип кровотоку по СМА з КА менше 15 %. У 1 (1,4 %) пацієнта з КЕ підтипом ішемічного інсульту з ознаками гіперперфузії в басейні ураженої артерії виявлені особливості кровотоку вірогідно можна трактувати як ранню реканалізацію судини.
У 6 (8,1 %) пацієнтів із симетричним магістральним типом кровотоку показники середньої ЛШК, пульсаційний індекс (ПІ), індекс опору (RI), тібіально-плечовий індекс (ТПІ), коефіцієнт овершуту (КО) були в межах норми, ознаки активації колатерального кровотоку були відсутні. Середня ЛШК знаходилась у діапазоні 45–80 см/с, значення ПІ знаходились в межах 0,65–1,05.
В 4 (66,7 %) випадках магістральний симетричний тип кровотоку поєднувався з відсутністю змін за даними МРТ, у 2 (33,3 %) випадках — із малим кірковим інфарктом мозку.
При неврологічному обстеженні хворих у найгострішому періоді інфаркту мозку й оцінці неврологічного дефіциту за шкалою NIHSS у 6 (100 %) хворих виявлено неврологічний дефіцит легкого ступеня тяжкості.
При дослідженні ступеня відновлення порушених функцій на 21-й день захворювання за модифікованою шкалою Ренкіна в усіх пацієнтів був зареєстрований легкий ступінь неспроможності, що вказувало на позитивну динаміку одужання і регрес неврологічного дефіциту.
Гіперперфузія
В 1 (1,4 %) випадку гіперперфузії реєструвалось підвищення ЛШК зі зниженням показників периферичного опору і цереброваскулярної реактивності в басейні СМА на стороні інфаркту мозку і КА більше 15 %. Результат компресійного тесту показав відсутність реакції на компресію ЗСА на боці інсульту.
Середня ЛШК по СМА на стороні інфаркту мозку становила 88,4 см/с; ПІ — 0,6; RI — 0,47; КО — 1,18; коефіцієнт асиметрії — 38 %; ТПІ — 0,75.
При порівнянні отриманих даних із МРТ-дослідженням головного мозку були виявлені кірково-підкіркові інфаркти мозку.
Синдром гіперперфузії пояснюється розвитком ацидозу в ділянці інфаркту, що призводить до компенсаційної вазодилатації піальних артерій і розвитку гіперперфузії, коли прохідність артерій відновлена.
Неврологічний дефіцит на момент надходження до стаціонару був оцінений як легкого ступеня, а ступінь відновлення порушених функцій на 21-шу добу захворювання при оцінці за модифікованою шкалою Ренкіна був оцінений як помірна недієздатність.
Утруднена перфузія
Критеріями утрудненої перфузії були зниження діастолічної швидкості в базальних артеріях мозку і підвищення показників периферичного опору. Зважаючи на те, що у пацієнтів контрольної групи ПІ знаходився в межах 0,65–1,05, а RI — 0,35–0,72, ми об’єднали в дану групу хворих із ПІ вище 1,05 та RI вище 0,72. Пацієнти з однобічним утрудненням перфузії внаслідок дистальної оклюзії СМА увійшли до попередніх груп. Отже, двостороннє утруднення перфузії відзначено у 2 (2,7 %) хворих із вогнищами ішемії в басейнах правої і лівої СМА. Середня ЛШК у лівій та правій СМА була відповідно 36,5 і 41,4 см/с у одного пацієнта; 29,7 і 34,8 см/с — у другого. ПІ становив 1,46 і 1,52 у першого пацієнта та 1,63 і 1,57 — у другого. RI дорівнював 0,84 і 0,79 у першого пацієнта та 0,91 і 0,87 — у другого. В той же час ТПІ за рахунок двобічного ураження не зазнав значних змін і становив 0,96 в обох випадках.
Даний характер змін церебральної гемодинаміки спостерігався при двосторонньому ураженні магістральних артерій голови і супроводжувався тотальним інфарктом міокарда.
Порівняння з клінічними даними показало, що цей тип кровотоку є прогностично несприятливим. При надходженні до стаціонару в обох пацієнтів було діагностовано тяжкий неврологічний дефіцит за шкалою NIHSS, а на 21-шу добу захворювання в 1 хворого був тяжкий ступінь функціональної неспроможності за шкалою Ренкіна, а другий пацієнт помер.
Висновки
Найбільш тяжкий перебіг ішемічного інсульту з вираженим неврологічним дефіцитом і високою летальністю ми спостерігали при утрудненій перфузії головного мозку і оклюзії гирла ВСА. При залишковому потоці по СМА і за умови оклюзії М1 сегмента СМА здебільшого спостерігався неврологічний дефіцит середнього ступеня тяжкості з помірно тяжкою недієздатністю. У випадку симетричного магістрального кровотоку, стенозу М1/М2 сегментів, оклюзії М2 сегмента СМА неврологічний дефіцит був здебільшого легким із добрим функціональним відновленням.
/140.jpg)

/141.jpg)
/142.jpg)