Журнал «Медицина неотложных состояний» 4 (75) 2016
Вернуться к номеру
Исследование ЭЭГ-предикторов нейромедиаторной и нейроглиальной активности у больных с острой церебральной недостаточностью различного генеза
Авторы: Черний В.И.(1), Андронова И.А.(2), Городник Г.А.(2), Черний Т.В.(1), Назаренко К.В.(2), Андронова М.А.(2)
1 - Государственное научное учреждение «Научно-практический центр профилактической и клинической медицины» Государственного управления делами, г. Киев, Украина
2 - Донецкий национальный медицинский университет им. М. Горького, г. Лиман, Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
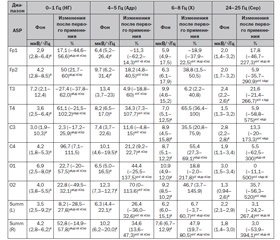
Мета дослідження: вивчення впливу Ентропу на зміну нейрофізіологічних ЕЕГ-предикторів глутаматної ексайтотоксичності, нейромедіаторної і нейрогліальної активності у хворих із гострою церебральною недостатністю (ГЦН) різного генезу. Матеріал і методи дослідження. Обстежено 123 пацієнти (76 чоловіків і 47 жінок) віком від 28 до 72 років, із тяжкою черепно-мозковою травмою — 67 хворих, із мозковим інсультом — 56 пацієнтів, які перебували на лікуванні в нейрохірургічному відділенні інтенсивної терапії. Було обстежено 45 пацієнтів (28 чоловіків і 17 жінок) віком від 36 до 72 років із діагнозом «ішемічний інсульт» і 11 хворих (7 чоловіків і 4 жінки) віком від 32 до 70 років із діагнозом «геморагічний інсульт». Обстежено 67 пацієнтів (37 чоловіків і 30 жінок) віком від 26 до 69 років із тяжкою ізольованою черепно-мозковою травмою. Усі пацієнти з тяжкою черепно-мозковою травмою і мозковим інсультом отримували стандартну терапію згідно з міжнародними протоколами лікування та наказами МОЗ України. Пацієнти були розділені на три групи: 40 хворих, яким проводили лікування за стандартним протоколом (група порівняння), 83 пацієнти (1-ша і 2-га підгрупи групи дослідження) додатково до стандартного протоколу отримували препарат Ентроп. Диференціація на 1-шу (32 хворі) і 2-гу (51 хворий) підгрупи проведена в 1-шу добу до введення Ентропу на підставі вихідного запису ЕЕГ і розрахунку 1-го інтегрального коефіцієнта ((δ + θ + β1)/(α + β2)), що відображає ступінь дезорганізації ЕЕГ-патерну: 1-ша підгрупа — kfc1 > 3,5; 2-га підгрупа — kfc1 < 3,5. Ентроп вводили через зонд один раз на добу в дозі 100 мг (перша доба), 200 мг (друга доба), 300 мг (третя доба і наступні). ЕЕГ-дослідження були проведені в 1-шу добу терапії (препарат вводили в дозі 100 мг), у 2-гу добу (препарат вводили в дозі 200 мг), на 3-тю добу, 5-ту, 7-му і 14-ту добу (препарат вводили в дозі 300 мг). Дизайн дослідження: відкрите проспективне дослідження за типом «випадок — контроль». Реєстрацію ЕЕГ здійснювали за допомогою нейрофізіологічного комплексу DX-NT32 (м. Харків). Вивчали показники абсолютної спектральної потужності (АСМ, мкВ/√Гц), відносної потужності (%). Для дослідження різних медіаторних систем ЦНС вивчали т.зв. «вузькі» діапазони (0–1 Гц, 4–5 Гц, 5–6 Гц, 11–12 Гц, 24–25 Гц), що відображають їх активність. Проводили комп’ютерну томографію та магнітно-резонансну томографію головного мозку, транскраніальне доплерографічне дослідження екстра- та інтракраніальних судин. Вивчали глибину коматозного стану пацієнтів за допомогою шкали коми Глазго (ШКГ), Скандинавської шкали інсультів щодня протягом усього періоду спостереження. Рівень порушення свідомості за шкалою коми Глазго у хворих при надходженні в нейрохірургічне відділення інтенсивної терапії варіював від 6 до 9 балів. Використання препарату Ентроп збільшувало шанс відновлення свідомості до 14 балів за ШКГ («помірне оглушення») вже на 7-му добу терапії (ОR — odds ratio — ОR ± 95% ДІ = 5,5 (2,8–13,2)), підвищувало шанс відновлення свідомості до 15 балів за ШКГ («ясна свідомість») до 14-ї доби лікування (ОR ±95% ДІ = 133 (32,74–547,61)) у порівнянні з терапією за стандартним протоколом. Висновки. Високий рівень ЕЕГ-дезорганізації (значення 1-го інтегрального коефіцієнта вище за 3,5) у пацієнтів із ГЦН після введення Ентропу зумовлює значну активацію переважно серотонінергічної системи мозку з гіперпродукцією серотоніну, з прискоренням процесів метаболізму в нейрогліальній популяції і з помірними асиметричними ангіоспастичними ефектами при безпосередньому впливі серотоніну на морфологічно змінені судини мозку. Менш виражена ЕЕГ-дезорганізація (рівень 1-го інтегрального коефіцієнта нижче за 3,5) у пацієнтів із ГЦН після застосування Ентропу зумовлює значну активацію переважно норадренергічної системи мозку з активацією гіпоталамо-гіпофізарної системи, діенцефального рівня неспецифічної регуляторної системи головного мозку і структур правої півкулі з симетричною оптимізацією швидкості артеріального кровотоку в каротидних і вертебробазилярному басейні. ЕЕГ-предиктори зниження глутаматергічної нейромедіаторної активності в ЦНС (процеси падіння ЕЕГ-активності дельта- і активації ритмів альфа- і бета-діапазонів з високою оберненою кореляцією) були зафіксовані у понад 50 % пацієнтів групи дослідження у відповідь на застосування Ентропу в дозі більше за 200 мг, що поряд з іритацією холінергічної системи забезпечує вихід із коматозного стану.
Цель исследования: изучение влияния Энтропа на изменение нейрофизиологических ЭЭГ-предикторов глутаматной эксайтотоксичности, нейромедиаторной и нейроглиальной активности у больных с острой церебральной недостаточностью (ОЦН) различного генеза. Материалы и методы. Обследовано 123 пациента (76 мужчин и 47 женщин) в возрасте от 28 до 72 лет с тяжелой черепно-мозговой травмой — 67 больных, с мозговым инсультом — 56 пациентов, находившихся на лечении в нейрохирургическом отделении интенсивной терапии. Было обследовано 45 пациентов (28 мужчин и 17 женщин) в возрасте от 36 до 72 лет с диагнозом «ишемический инсульт» и 11 больных (7 мужчин и 4 женщины) в возрасте от 32 до 70 лет с диагнозом «геморрагический инсульт». Обследовано 67 пациентов (37 мужчин и 30 женщин) в возрасте от 26 до 69 лет с тяжелой изолированной черепно-мозговой травмой. Все пациенты с тяжелой черепно-мозговой травмой и мозговым инсультом получали стандартную терапию согласно международным протоколам лечения и приказам МЗ Украины. Пациенты были распределены на три группы: 40 больных, которым проводили лечение по стандартному протоколу (группа сравнения), 83 пациента (1-я и 2-я подгруппы группы исследования) дополнительно к стандартному протоколу получали препарат Энтроп. Дифференцировка на 1-ю (32 больных) и 2-ю (51 больной) подгруппы проведена в 1-е сутки до введения Энтропа на основании исходной записи ЭЭГ и расчета 1-го интегрального коэффициента ((δ + θ + β1)/(α + β2)), отражающего степень дезорганизации ЭЭГ-паттерна: 1-я подгруппа — kfc1 > 3,5; 2-я подгруппа — kfc1 < 3,5. Энтроп вводили через зонд один раз в сутки в дозе 100 мг (первые сутки), 200 мг (вторые сутки), 300 мг (третьи сутки и последующие). ЭЭГ-исследования были проведены в 1-е сутки терапии (препарат вводили в дозе 100 мг), во 2-е сутки (препарат вводили в дозе 200 мг), на 3-и сутки, 5, 7 и 14-е сутки (препарат вводили в дозе 300 мг). Дизайн исследования: открытое проспективное исследование по типу «случай — контроль». Регистрацию ЭЭГ осуществляли с помощью нейрофизиологического комплекса DX-NT32 (г. Харьков). Изучали показатели абсолютной спектральной мощности (АСМ, мкВ/√Гц), относительной мощности (%). Для исследования различных медиаторных систем ЦНС изучали т.н. «узкие» диапазоны ЭЭГ (0–1 Гц, 4–5 Гц, 5–6 Гц, 11–12 Гц, 24–25 Гц), отражающие их активность. Проводили компьютерную томографию и магнитно-резонансную томографию головного мозга, транскраниальное допплерографическое исследование экстра- и интракраниальных сосудов. Изучали глубину коматозного состояния пациентов с помощью шкалы комы Глазго (ШКГ), Скандинавской шкалы инсультов ежедневно в течение всего периода наблюдения. Результаты и обсуждение. Уровень нарушения сознания по шкале комы Глазго у больных при поступлении в нейрохирургическое отделение интенсивной терапии варьировал от 6 до 9 баллов. Использование препарата Энтроп увеличивало шанс восстановления сознания до 14 баллов по ШКГ («умеренное оглу-
шение») уже к 7-м суткам терапии (ОR — odds ratio — ОR ± 95% ДИ = 5,5 (2,8–13,2)), повышало шанс восстановления сознания до 15 баллов по ШКГ («ясное сознание») к 14-м суткам лечения (ОR ± 95% ДИ = 133 (32,74–547,61)) по сравнению с терапией по стандартному протоколу. Выводы. Высокий уровень ЭЭГ-дезорганизации (значения 1-го интегрального коэффициента выше 3,5) у пациентов с ОЦН после введения Энтропа предопределяет значительную активацию преимущественно серотонинергической системы мозга с гиперпродукцией серотонина, с ускорением процессов метаболизма в нейроглиальной популяции и с умеренными асимметричными ангиоспастическими эффектами при непосредственном воздействии серотонина на морфологически измененные сосуды мозга. Менее выраженная ЭЭГ-дезорганизация (уровень 1-го интегрального коэффициента ниже 3,5) у пациентов с ОЦН после применения Энтропа предопределяет значительную активацию преимущественно норадренергической системы мозга с активацией гипоталамо-гипофизарной системы, диэнцефального уровня неспецифической регуляторной системы головного мозга и структур правого полушария с симметричной оптимизацией скорости артериального кровотока в каротидных и в вертебробазилярном бассейне. ЭЭГ-предикторы снижения глутаматергической нейромедиаторной активности в ЦНС (процессы падения ЭЭГ-активности дельта- и активации ритмов альфа- и бета-диапазонов с высокой обратной корреляцией) были зафиксированы у более 50 % пациентов группы исследования в ответ на применение Энтропа в дозе более 200 мг, что наряду с ирритацией холинергической системы обеспечивает выход из коматозного состояния.
Purpose of the study. To study the influence of entrop on the neurophysiological EEG-changes of glutamate excitotoxicity, neuroglial and neurotransmitter activity in patients with acute cerebral insufficiency of different nature. Material and methods. 123 patients were examined (76 men and 47 women, aged from 28 to 72 years old) with severe traumatic brain injury (SBI) — 67 patients and with cerebral stroke (CS) — 56 patients who were treated in the neurosurgical intensive care unit. The study involved 45 patients (28 men and 17 women) aged from 36 to 72 years old with diagnosed ischemic stroke (IS), and 11 patients aged from 32 to 70 years old with a diagnosis of hemorrhagic stroke (GS) — 7 men and 4 women. 67 patients were examined (37 men and 30 women) aged from 26 to 69 years old with severe isolated brain injury. All patients with severe traumatic brain injury and cerebral stroke received basic therapy according to international treatment protocols and the Ministry of Health of Ukraine orders. The patients were divided into the three groups: 40 patients were treated according to standard protocol (comparison group (HS)), 83 patients (1st and 2nd sub-groups (SG) of the research group (GI)) in addition to the standard protocol received entropy. Subdivision on the 1st (32 patients) and 2nd (51 patients) subgroups was held on the 1st day before the starting of the entrop-therapy based on of the original recording of EEG and the calculation of the 1st integral coefficient ((δ + θ + β1)/(α + β2)), characterizing the level of EEG pattern disorders: 1st subgroup — kfc1 > 3.5; 2nd subgroup — kfc1 < 3.5. The entrop was given once daily in a dose of 100 mg (the first day), 200 mg (second day), 300 mg (the third day and after that). EEG has been conducted on the 1st day of therapy (drug was administered at a dose of 100 mg), on the 2nd day (drug was administered at a dose of 200 mg), on the 3rd day, 5th, 7th and 14th day (drug was administered at a dose of 300 mg). Study design. Open prospective study case — control. EEG recordings were performed by DX-NT32 neurophysiological complex (Kharkiv). We have studied the absolute spectral power (AFM, uV/rt-Hz) and relative power (%) characteristics. To investigate the different neurotransmitter systems we have studied so-called narrow range (0–1 Hz, 4–5 Hz, 5-6 Hz, 11–12 Hz, 24–25 Hz), characterising their activity. Computer tomography, magnetic resonance imaging of the brain, transcranial Doppler investigation of extra- and intracranial vessels were performed. Consciousness level was studied by the Glasgow Coma Scale (GCS), Scandinavian stroke scale (SSS) daily using pending observation period. The level of consciousness by the Glasgow coma scale in patients on admission to the neurosurgical intensive care unit ranged from 6 to 9 scores. Usage of entrop improved recovery of consciousness up to 14 scores by the GCS (moderate stuporous) to the 7th day of therapy (odds ratio (OR): OR ± 95 % CI = 5.5 (2,8–13,2)), improved recovery of consciousness up to 15 scores by the GCS (clear mind) to the 14th day of treatment (OR ± 95 % CI = 133 (32.74–547.61)) in comparison with the standard protocol treatment. The high level of EEG disorders (1st value integral coefficient greater than 3.5) in patients with ACI after entrop injections advantageously predetermines significant activation of the serotonergic system of the brain serotonin hyperproduction, accelerated metabolism in neuroglial populations with moderate and asymmetric with direct angiospastic effects at serotonin effects on the morphological changes of the brain vessels. Less severe disorganized EEG (level 1, the integral coefficient below 3.5) in patients with ACI after entrop applying mostly predetermines significant activation of the noradrenergic system of the brain to the activation of the hypothalamic-pituitary system, diencephalic level of non-specific regulatory brain systems and structures with the right hemisphere symmetric optimization of blood flow velocity in the carotid and vertebrobasilar pools. EEG predictors of reduction of glutamatergic neurotransmitter activity in the central nervous system (highly inversely correlated processes fall EEG delta activity and activation of alpha and beta rhythms ranges) were reported in 50 % of patients in the study group as a response to the use of entrop in a dose of 200 mg, that, along with irritation of the cholinergic system, it provides recovery from a coma.
гостра церебральна недостатність, спектрально-когерентний аналіз ЕЕГ, нейромедіаторна система мозку, нейротропний фармакологічний вплив, Ентроп
острая церебральная недостаточность, спектрально-когерентный анализ ЭЭГ, нейромедиаторные системы мозга, нейротропное фармакологическое воздействие, Энтроп
acute cerebral insufficiency, spectral coherent analysis of EEG, brain neutransmitter systems, neurotropic drug effect, Entrop
Статья опубликована на с. 45-56

/49-1.jpg)
/50-1.jpg)
/51-2.jpg)
/52-1.jpg)
/53-1.jpg)