Статья опубликована на с. 64-71
Политравма остается серьезной проблемой современного здравоохранения, унося ежегодно жизни болем 5,8 миллиона человек в мире. Ожидается, что число этих жертв будет расти по мере увеличения техногенной нагрузки на человечество [1–3]. Согласно данным ВОЗ, тремя лидирующими причинами травм и связанной с ними летальности являются автодорожные инциденты, суициды и убийства [4]. Главной, потенциально предотвратимой причиной смерти пациентов с тяжелой травмой является массивное неконтролируемое кровотечение [5, 6].
Эффективная интенсивная терапия при массивном кровотечении вследствие травмы предполагает раннее выявление источника кровотечения и неотложные мероприятия с целью минимизации кровопотери, восстановления перфузии тканей и потребления кислорода, капиллярного кровотока, метаболического гомеостаза и достижения стабильности гемодинамики. Основой интенсивной терапии травматического кровотечения является стратегия Damage Control Resuscitation, включающая допустимую гипотензию, рестриктивную инфузионную терапию, гемостатическую реанимацию, температурный контроль и согревание пациента, коррекцию ацидоза и Damage Control Surgery [7, 8].
Примерно у 30–40 % всех пациентов с травматическими кровотечениями при госпитализации диагностируют коагулопатию [9]. Основными пусковыми моментами острой травматической коагулопатии являются гипоперфузия тканей, воспаление и острая активация нейрогуморальной системы. Гипоперфузия приводит к активации протеина С, появлению активированных факторов V и VIII и угнетению ингибитора активатора плазминогена 1 с последующим развитием гиперфибринолиза. Повреждение и активация клеток эндотелия вызывает разрушение телец Вайбеля — Паладе, которые содержат фактор фон Виллебранда и P-селектин, и отслоение (shedding) гликокаликса. В отличие от этого, существует ятрогенная коагулопатия, которая возникает вторично на фоне массивной инфузионной терапии, способствующей ацидозу, гипотермии и гемодилюции. Коагулопатия является составной частью «порочного круга» в патогенезе травмы в сочетании с ацидозом и гипотермией [10–12]. У пациентов с коагулопатией доказано значительное увеличение частоты полиорганной недостаточности и смерти по сравнению с пациентами с похожими травмами при отсутствии коагулопатии [13]. Ранняя острая коагулопатия, связанная с травматическим поражением, признана многофакторным первичным состоянием, которое является результатом сочетания шока, вызванного кровотечением, образования комплекса тромбина — тромбомодулина в травмированной ткани и активации фибринолитических и антикоагулянтных механизмов. Компоненты патогенеза ранней посттравматической коагулопатии представлены на схеме (рис. 1) [14]. Для ее описания используют ряд терминов, в том числе «острая травматическая коагулопатия», «ранняя коагулопатия при травме», «острая коагулопатия при травматическом шоке», «посттравматическая коагулопатия» и «травма-ассоциированная коагулопатия» [15, 16].
/65-1.jpg)
Предложена шкала для прогнозирования риска развития посттравматической коагулопатии, основанная на оценке тяжести и объема повреждений при травме (табл. 1) [17].
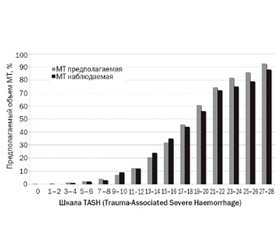
Существует также большое количество шкал для прогнозирования массивности кровопотери и необходимости в гемотрансфузии при травме. Основными компонентами этих шкал являются механизм и объем повреждения, показатели гемодинамики (АД, частота сердечных сокращений (ЧСС)), лабораторные данные (Hb, эритроциты, Ht, дефицит оснований, рН), данные методов визуализации (СКТ, УЗИ-диагностика повреждений внутренних органов по протоколу FAST), степень угнетения сознания по Шкале комы Глазго (рис. 2) [18].
По нашим наблюдениям, эффективна эмпирическая оценка кровопотери, основанная на анатомической локализации и совокупности повреждений с учетом маркеров массивной кровопотери (АДсист.< 90 мм рт.ст., рН < 7,3; ВЕ ≥ –4, температура тела < 35,5 °C, МНО > 1,5, Hb < 100) с последующей переоценкой на основании клинико-лабораторных признаков эффективности противошоковой терапии и восполнения кровопотери [19].
Клинические рекомендации в виде Европейского консенсуса по интенсивной терапии массивного кровотечения и коагулопатии при травме были впервые опубликованы в 2007 г., обновлены в 2010 и 2013 гг. Они являются частью европейской Кампании «STOP кровотечение» (STOP the Bleeding Campaign) — международной инициативы с целью снижения заболеваемости и смертности, связанных с кровотечением вследствие травматического повреждения [20]. В апреле 2016 г. опубликовано 4-е издание этих рекомендаций [14].
Исходя из собственного практического опыта, мы убеждены, что большинство рекомендаций Европейского консенсуса по ИТ массивного кровотечения и коагулопатии при травме выполнимы в условиях украинских медицинских учреждений и должны лечь в основу национального протокола ИТ массивной посттравматической кровопотери и коагулопатии. Приведем краткое изложение некоторых положений этих рекомендаций с указанием степени доказательности [14].
— Избегание гипоксемии (1A) и поддержание нормоволемии у пациентов с травмой (1В).
— Необходима ранняя визуализация возможных повреждений внутренних органов (УЗИ, СКТ) (1В).
— Необходима динамическая оценка уровня Нb (1В) и измерение уровня сывороточного лактата и/или дефицита оснований, как чувствительных тестов для оценки и мониторинга степени кровотечения и шока (1В).
— Ранний и повторный мониторинг коагуляции (протромбиновое время, АЧТВ, количество тромбоцитов и фибриногена) (1А) и/или тромбоэластография (1C).
— Целевое систолическое АД 80–90 мм рт.ст., пока кровотечение не остановлено (1C).
— У больных с тяжелой ЧМТ (шкала комы Глазго ≤ 8) рекомендуют среднее АД ≥ 80 мм рт.ст. (1C).
— Ограниченная стратегия замещения объема, пока кровотечение не контролируется (1В).
— При наличии угрожающей жизни гипотензии — введение вазопрессоров (1C).
— Рекомендуют инотропы при дисфункции мио–карда (1C).
— Использование изотонических кристаллоидов для начальной инфузии у гипотензивных пациентов с травмой (1A).
— Чрезмерного использования 0,9% раствора NaCl следует избегать (2С).
— Гипотонических растворов, таких как лактат Рингера, следует избегать у больных с тяжелой ЧМТ (1С).
— Использование коллоидов должно быть ограничено из-за неблагоприятного воздействия на гемостаз (2C).
— Целевой уровень гемоглобина от 70 до 90 г/л (1C).
— Раннее применение мер по снижению потерь тепла и согревание пациента с целью достижения и поддержания нормотермии (1C).
— Необходимо соблюдение принципов Damage Control Surgery (1B).
— Для стартового лечения больных с ожидаемой массивной кровопотерей рекомендуют использовать одну из двух следующих стратегий: свежезамороженная плазма (СЗП) + эритроциты в соотношении по меньшей мере 1 : 2 (1В); или концентрат фибриногена + эритроциты в соответствии с уровнем гемоглобина (1C).
— Вводить транексамовую кислоту как можно раньше при наличии или риске значительного кровотечения (1 г в течение 10 мин, с последующим вливанием 1 г в течение 8 часов) (1A).
— Введение транексамовой кислоты в течение 3 ч после травмы (1В).
— Следует рассмотреть возможность введения первой дозы транексамовой кислоты по пути в больницу (2C).
— Рекомендуют стратегию целенаправленной коррекции кровопотери, руководствуясь стандартными значениями гемокоагуляции и/или тромбоэластографией (1C).
— Введение СЗП для поддержания протромбинового времени и АЧТВ < 1,5 раза от нормы (1C).
— Избегать переливания плазмы у пациентов без существенного кровотечения (1В).
— Внутривенный концентрат фибриногена или криопреципитат при значительном кровотечении, сопровождающемся тромбоэластографическими признаками функционального дефицита фибриногена, или уровне фибриногена в плазме менее 1,5–2,0 г/л (1C).
— Начальная инфузия 3–4 г концентрата фибриногена. Это эквивалентно 15–20 единицам криопреципитата. Повторные дозы — исходя из результатов тромбоэластографии или лабораторной оценки уровня фибриногена (2C).
— Рекомендуют вводить тромбоциты для поддержания количества тромбоцитов выше 50 × 109/л (1C) и выше 100 × 109/л у пациентов с продолжающимся кровотечением и/или ЧМТ (2C).
— Во время массивной трансфузии поддерживать уровень кальция в пределах нормального диапазона (1C).
— Показано введение тромбоцитов пациентам со значительным кровотечением или внутричерепным кровоизлиянием, которые ранее получали антиагреганты (2C).
— Рекомендуют раннее использование концентрата протромбинового комплекса (КПК) для экстренного прекращения эффекта витамин-К-зависимых пероральных антикоагулянтов (1A).
— Используют КПК (25–50 ед/кг) при угрожающих жизни посттравматических кровотечениях у пациентов, принимающих новые пероральные антикоагулянты (2C).
— При нормальном уровне фибриногена КПК или СЗП можно вводить при кровотечении у пациента с доказанной гипокоагуляцией (2C).
Клинические рекомендации авторитетной Британской организации National Institute for Health and Care Excellence (NICE) акцентируют внимание на аналогичных подходах при более категоричном отношении к нецелесообразности и вредности инфузии кристаллоидов и коллоидов при массивной кровопотере и отдают предпочтение раннему восполнению массивной кровопотери препаратами и компонентами крови [21].
— Активируйте протокол массивной трансфузии по клиническим показаниям — нестабильная гемодинамика и недостаточный ответ на стартовую волемическую терапию.
— Используйте в/в транексамовую кислоту, как только будет возможно, при активном или подозреваемом кровотечении.
— Максимально рестриктивная инфузия при массивном кровотечении.
— Менее рестриктивная инфузия при доминировании тяжелой ЧМТ.
— Не используйте кристаллоиды и коллоиды при массивном кровотечении, если доступны препараты крови.
— Трансфузия крови и СЗП в соотношении 1 : 1.
Весьма эффективными в отношении ИТ массивной кровопотери являются рекомендации Ассоциации анестезиологов Великобритании. Применение универсальной донорской крови позволяет начать качественное восполнение кровопотери неотложно, уже на этапе транспортировки в стационар и раннем госпитальном этапе. Представляется целесообразным внедрение таких подходов в практику отечественной анестезиологии и интенсивной терапии, что требует соответствующей организационной и юридической поддержки [22].
— Каждое учреждение должно иметь регулярно обновляемый протокол массивной трансфузии.
— Начальная ресусцитация при массивной кровопотере должна включать 4 единицы крови и 4 единицы СЗП (15–20 мл/кг у взрослого); рекомендовано использование тромбоконцентрата.
— Кровь 0(I) должна быть всегда готова для неотложной трансфузии в случае жизнеугрожающего кровотечения.
— Кровь 0(I) Rh– для экстренной трансфузии при жизнеугрожающем состоянии необходима детям и женщинам детородного возраста.
— Кровь 0(I) Rh+ может использоваться у взрослых мужчин.
— Одногруппная кровь должна быть готова в течение ближайшего времени (15–20 мин) после получения образца крови.
— В случае массивного кровотечения должна быть готовность к трансфузии крови и СЗП в качестве предпочтения перед другими жидкостями.
— При продолжающемся кровотечении необходимо мониторировать целевые точки ИТ, тесты коагуляции, фибриноген, количество и функцию тромбоцитов.
— Трансфузия СЗП показана при МНО > 1,5; криопреципитата — при фибриногене < 1,5; тромбоцитов — при их количестве < 75 х 109.
— Оптимальный триггер Нb, который демонстрирует улучшение исходов, при либеральном подходе — 90–100 г/л; при рестриктивном — 70–80 г/л.
— Триггер Нb выше 80 г/л показан у пациентов с ишемической болезнью сердца, включая острый коронарный синдром, и после кардиальной хирургии.
В современной литературе, посвященной инфузионной терапии, наблюдается изменение понятийного аппарата в отношении патофизиологии циркуляторного шока и гиповолемии. Time-management современной инфузионной терапии представляют в виде четырехфазного процесса (рис. 3) [23]:
1. Острая фаза — спасение (resuscitation): переливание жидкости для лечения угрожающих жизни состояний, связанных с нарушением тканевой перфузии.
2. Оптимизация (optimization).
3. Последующая стабилизация (stabilization): титрация и выбор типа жидкости, скорости и объема инфузии с точки зрения улучшения тканевой перфузии.
4. Деэскалация (de-escalation): минимизация введения жидкости, мобилизация избытка жидкости, оптимизация баланса жидкости.
Каждая фаза инфузионной терапии имеет свои задачи и пути их реализации, а также разные подходы к оптимальному мониторингу [24].
Фаза спасения — от 0 до 24 ч:
— Высока вероятность гиповолемии.
— Сбалансированные солевые растворы рекомендуют в качестве первой линии жидкостей.
— Коллоиды можно рассматривать при гиповолемии как жидкости второго ряда реанимации с учетом риска острого почечного повреждения и коагулопатии.
— Исключением является необходимость как можно скорейшего переливания крови у пациентов с массивным кровотечением.
— Альбумин может играть положительную роль при сепсисе, но противопоказан при черепно-мозговой травме.
— Первоначальный болюс жидкости рекомендуется в дозе до 20–30 мл/кг. Есть данные, что более низкие дозы могут быть столь же эффективны.
— Все чаще рекомендуют раннее использование вазопрессоров, таких как норадреналин или адреналин, в качестве дополнительной стратегии реанимации во время фазы спасения, в основном чтобы уменьшить объем инфузионной терапии и улучшить перфузию органов путем увеличения венозного возврата, среднего артериального давления и сердечного выброса. Рассматривается вопрос об использовании комбинаций вазопрессорных агентов.
Фаза оптимизации:
— На этапе оптимизации, как правило, между 24 и 72 ч, частота гиповолемии существенно снижается.
— Объем инфузионной терапии до 5–15 мл/кг вводят при подозрении на гиповолемию.
— Большая часть любой в/в введенной жидкости может накапливаться в тканях в условиях повышенной проницаемости (ятрогенный интерстициальный отек).
— Неблагоприятные последствия увеличения баланса жидкости, в частности увеличение смертности и продление механической вентиляции, продемонстрированы у пациентов с сепсисом и острым респираторным дистресс-синдромом.
Фаза стабилизации:
— Обычно происходит между 72 и 96 ч.
— Частота гиповолемии низкая, нет необходимости в инфузии дополнительной жидкости, кроме компенсации потерь и введения необходимых лекарств.
— Нет четкого консенсуса в отношении объема при соблюдении стратегии рестриктивной инфузии.
Фаза деэскалации:
Как правило, после 96 ч или при гемодинамической стабильности рекомендуют достичь отрицательного баланса жидкости путем либо ограничения внутривенного введения, либо увеличения удаления жидкости путем диуреза, либо ультрафильтрации.
Современная терминология инфузионной терапии при гиповолемии включает следующие определения:
— Болюс жидкости — быстрая внутривенная инфузия 500 мл и более в течение 15 минут для интенсивной терапии гиповолемического шока. Необходима обязательная оценка ответа пациента на болюс жидкости.
— Пробная инфузия (fluid challenge) — введение внутривенно 100–200 мл в течение 5–10 минут с последующей переоценкой статуса тканевой перфузии.
— Инфузия жидкости — постоянное внутривенное введение жидкости для поддержания гомеостаза, замещения потерь, предотвращения органного повреждения, детоксикации.
— Жидкость для поддержания объема — внутривенное введение при невозможности перорального. Титруют в соответствии с потребностями больного, включая замещение потерь. При отсутствии потерь количество жидкости не должно превышать 1–
2 мл/кг/час.
— Кумулятивный жидкостный баланс — сумма ежедневного водного баланса в течение нескольких дней.
— Перегрузка жидкостью — кумулятивный жидкостный баланс, превышающий 10 % от веса тела, который может быть связан с повышенной вероятностью неблагоприятного исхода.
Рекомендации в отношении минимального и оптимального мониторинга при инфузионной терапии гиповолемии представлены в табл. 2 [23].
Все еще дискутабельным остается вопрос раннего использования вазопрессоров и их выбора в ранней интенсивной терапии гиповолемического шока. Показано уменьшение воспалительного ответа вследствие массивного повреждения тканей при использовании вазопрессоров в дополнение к инфузии в сравнении только с инфузией. Раннее использование вазопрессоров рекомендуют в качестве дополнительной стратегии реанимации во время фазы спасения (rescue) при интенсивной терапии шока, чтобы уменьшить объем инфузионной терапии и улучшить перфузию органов путем увеличения венозного возврата, среднего артериального давления и сердечного выброса [25].
Согласно Европейским рекомендациям (2014, 2016), введение вазопрессоров показано при отсутствии реакции на первоначальный инфузионный болюс и при жизнеугрожающей гипотензии. Инотропные агенты должны быть добавлены, когда нарушение функции сердца сопровождается низким или недостаточным сердечным выбросом и признаки тканевой гипоперфузии сохраняются после оптимизации преднагрузки (1–2С) [14, 26].
Аналогичные данные представлены в Канадских рекомендациях (2015) [27]:
— рутинное использование вазопрессоров не рекомендовано;
— вазопрессин может быть показан при геморрагическом и гиповолемическом шоке;
— второй вазопрессор нужно добавить, если не достигнуто САД > 70 мм рт.ст.
— при неидентифицированном шоке, не отвечающем на жидкостную ресусцитацию, норэпинефрин может быть первой линией.
Резюмируя, акцентируем внимание на вопросах интенсивной терапии травматической кровопотери, которые требуют решения в рамках национального протокола:
1) каждое медучреждение должно иметь протокол массивной трансфузии, а пациенты с массивной кровопотерей должны быть выделены в отдельную группу гемостатической и инфузионно-трансфузионной терапии;
2) в случае масивного кровотечения — трансфузия крови и СЗП в соотношении не менее 1 : 2 в качестве предпочтения перед другими инфузионными средами;
3) кровь 0 (I) необходима для неотложной трансфузии при жизнеугрожающем кровотечении;
4) одногруппная кровь должна быть готова через 15–20 мин после получения образца крови;
5) неотложное введение концентрата фибриногена или криопреципитата при массивном кровотечении с признаками дефицита фибриногена;
6) мониторинг целевых точек ИТ и гемокоагуляции путем традиционных тестов и тромбоэластографии для целенаправленной коррекции кровопотери;
7) при угрожающей жизни гипотензии показано ранене использование вазопрессоров и их комбинаций;
8) ранние меры по снижению потерь тепла и согреванию пациента.
Список литературы
1. Injuries and violence: the facts 2014 / World Health Organization, 2014 // http://iogt.org/wp-content/uploads/2015/03/injuries-violence-facts‑2014-WHO.pdf
2. GBD2013 Mortality and Causes of Death Collaborators. Glo–bal, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013 // Lancet. — 2015. — Vol. 385 (9963). — P. 117-171.
3. Murray C.J., Lopez A.D. Alternative projections of morta–lity and disability by cause 1990–2020: Global Burden of Disease Study // Lancet. — 1997. — Vol. 349 (9064). — P. 1498-504.
4. The global burden of disease: 2004 update / World Health Organization, 2008 // http://www.who.int/healthinfo/global_burden_disease/GBD_report_2004update_full.pdf
5. Cause-specific mortality and morbidity. World Health Statistics 2009 / World Health Organization // http://www.who.int/whosis/whostat/EN_WHS09_Table2.pdf
6. Campbell H.E., Stokes E.A., Bargo D.N. et al. Quantifying the health care costs of treating severely bleeding major trauma patients: a national study for England // Crit. Care. — 2015. — Vol. 19 (1). — P. 276.
7. Lamb С.M. et al. Damage Control Surgery in the Era of Damage Control Resuscitation // Br. J. Anaesth. — 2014. — Vol. 113 (2). — P. 242-249.
8. Giannoudi M., Harwood P. Damage control resuscitation: lessons learned // Eur. J. Trauma Emerg. Surg. — 2016. — Vol. 42 (3). — P. 273-282.
9. Schöchl H., Nienaber U., Maegele M. et al. Transfusion in trauma: thromboelastometry-guided coagulation factor concentrate-based therapy versus standard fresh frozen plasma-based therapy // Crit. Care. — 2011. — Vol. 15 (2). — R83.
10. Maegele M., Schochl H., Cohen M.J. An update on the coagulopathy of trauma // Shock. — 2014. — Vol. 41 (Suppl. 1). — P. 21-25.
11. Khan S., Davenport R., Raza I. et al. Damage control resuscitation using blood component therapy in standard doses has a limited effect on coagulopathy during trauma hemorrhage // Intensive Care Med. — 2015. — Vol. 41 (2). — P. 239-247.
12. Gando S., Wada H., Thachil J. Scientific and Standardization Committee on DIC of the International Society on Thrombosis and Haemostasis (ISTH). Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma-shock (COT/ACOTS) // J. Thromb. Haemost. — 2013. — Vol. 11 (5). — P. 826-835.
13. Cap A., Hunt B.J. Thepathogenesis of traumatic coagulopathy // Anaesthesia. — 2015. — Vol. 70 (Suppl. 1). — P. 96-101.
14. Rossaint R., Bouillon B., Cerny V. et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition // Critical Care. — 2016. — Vol. 20 (1). — P. 100.
15. Frith D., Davenport R., Brohi K. Acute traumatic coagulopathy // Curr. Opin. Anaesthesiol. —2012. — Vol. 25 (2). — P. 229-234.
16. Engels P.T., Rezende-Neto J.B., Al Mahroos M. et al. The natural history of trauma-related coagulopathy: implications for treatment // J. Trauma. — 2011. — Vol. 71 (Suppl. 1). — S448-455.
17. Tonglet M.L., Minon J.M., Seidel L. et al. Prehospital identification of trauma patients with early acute coagulopathy and massive bleeding: results of a prospective non-interventional clinical trial evalua–ting the Trauma Induced Coagulopathy Clinical Score (TICCS) // Critical Care. — 2014. — Vol. 18. — P. 648.
18. Maegele M., Brockamp T., Nienaber U. et al. Predictive Models and Algorithms for the Need of Transfusion Including Massive Transfusion in Severely Injured Patients // Transfus. Med. Hemo–ther. — 2012. — Vol. 39 (2). — P. 85-97.
19. Йовенко И.А., Кобеляцкий Ю.Ю., Царев А.В. и др. Практика инфузионно-трансфузионной терапии кровотечений при тяжелой огнестрельной травме: вопросы выбора препаратов и целевых конечных точек // Медицина неотложных состояний. — 2015. — № 2. — С. 164-170.
20. Rossaint R., Bouillon B., Cerny V. et al. The STOP the Ble–eding Campaign // Crit. Care. — 2013. — Vol. 17 (2). — P. 136.
21. Major trauma: assessment and initial management. NICE guideline (February 2016) // https://www.nice.org.uk/guidance/ng39/resources/major-trauma-assessment-and-initial-management‑1837400761285.
22. Klein A.A., Arnold P., Bingham R.M. et al. AAGBI guidelines: the use of blood components and their alternatives 2016 // https://www.aagbi.org/sites/default/files/Blood%20components%20and%20alternative%20ONLINE%20CONSULT_0.pdf
23. Hoste E.A. et al. Four Phases of Intravenous Fluid Therapy: A Conceptual Model // Br. J. Anaesth. — 2014. — Vol. 113 (5). — P. 740-747.
24. Myburgh J.A. Fluid resuscitation in acute medicine: what is the current situation? // J. Intern. Med. — 2015. — Vol. 277. — P. 58-68.
25. Beloncle F. et al. Does vasopressor therapy have an indication in hemorrhagic shock? // Annals of Intensive Care. — 2013. — Vol. 3. — P. 13.
26. Cecconi M. et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine // IntensiveCareMed. — 2014. — Vol. 40 (12). — P. 1795-1815. http://www.ncbi.nlm.nih.gov/pubmed/?term=Cecconi%20M%5Bauth%5D27. Djogovic D. et al. Vasopressor and Inotrope Use in Canadian Emergency Departments: Evidence Based Consensus Guidelines // CJEM. — 2015. — Vol. 17 (S1). — P. 1-16.

/65-1.jpg)
/65-2.jpg)
/66-1.jpg)
/67-1.jpg)
/68-1.jpg)