Статья опубликована на с. 72-78
В настоящее время в интенсивной терапии все большее внимание уделяется так называемому метаболическому направлению, которое придает важное значение роли обменных процессов в развитии критических состояний, возникающих на фоне гипоксии. Это обусловлено тем, что для работы всех функциональных систем организма необходима энергия [1–3].
При нормальном обеспечении кислородом энергия образуется из питательных веществ (в основном из глюкозы) благодаря ряду метаболических превращений.
Выработка энергии зависит от 3 взаимосвязанных путей: гликолиза в цитоплазме, цикла Кребса и цепи транспорта электронов в митохондриях [4].
Основные реакции биотрансформации питательных веществ замыкаются на цикле Кребса или аэробном дыхании, которые тесно связаны с окислительным фосфорилированием — наиболее эффективным способом синтеза АТФ, в результате которого компоненты дыхательной цепи осуществляют перенос электронов. Этот путь энергообразования является наиболее эффективным, он присущ клеткам всех типов и действует постоянно.
С образованием энергии, необходимой для обеспечения жизнедеятельности организма, тесно связан сукцинат натрия (янтарная кислота), так как она является продуктом пятой и субстратом шестой реакции в цикле Кребса.
Н.А. Кребс еще в 1953 году в своей фундаментальной работе «Обзор преобразования энергии в живой материи» открыл и описал механизмы работы дыхательной цепи и показал уникальную роль сукцината: «В условиях напряжения механизмов синтеза АТФ (гипоксия, различные стрессовые воздействия), когда другие окислительные процессы угнетены, сукцинатдегидрогеназа, окисляя сукцинат, активно пропускает поток протонов и электронов на дыхательную цепь, минуя НАД-зависимое звено. Это имеет огромный физиологический смысл в плане ранней адаптации к гипоксии на уровне клетки» [5].
В ходе дальнейших исследований Л.Д. Лукьяновой и другими авторами было установлено, что «главным моментом в развитии любой гипоксии всегда является нарушение субстратного звена в дыхательной цепи митохондрий, а именно дефицит сукцината» [6, 7].
Вместе с тем при гипоксии дыхательная цепь митохондрий не может принять на себя водород от какого-либо иного субстрата, кроме янтарной кислоты, так как только при ее окислении водород поступает на наиболее близкий к кислороду участок дыхательной цепи, что является удобным и экономным в энергетическом плане для организма [8]. Феномен активного окисления сукцината получил название эффекта монополизации дыхательной цепи [9].
Таким образом, ключевым моментом клеточных расстройств всегда является дефицит энергии (АТФ), которая синтезируется в митохондриях при непосредственном участии кислорода.
Именно митохондрии, как АТФ-продуцирующие клеточные органеллы, являются основным местом развития гипоксического каскада биохимических процессов, приводящих к гибели клетки [5]. Происходит не только замедление митохондриального синтеза АТФ, но и нарушение всего обмена веществ в органелле в целом, что включает в себя понятие «митохондриальная дисфункция».
Уместно напомнить, что при различных критических состояниях ключевым звеном является гипоксия, в условиях которой зарождаются метаболический хаос, энергетический голод, активизация свободнорадикального окисления, что приводит к расстройству тканевого дыхания на уровне митохондрий и вносит свой вклад в развитие «триады смерти» (рис. 1).
Представляют большой интерес исследования группы авторов, проведенные у пациентов с сепсисом, которые установили, что метаболические расстройства и усиление анаэробного дыхания развивались раньше, чем существенные сдвиги гемодинамики. Это позволило авторам заключить, что метаболические реакции в клетках и органах в целом могут быть значимыми адаптивными мерами предотвращения развития синдрома полиорганной недостаточности (СПОН) и смерти [11].
Ряд других исследователей показали, что период ранней адаптации к гипоксии предшествует гемодинамическим расстройствам и устранять митохондриальную дисфункцию (как следствие гипоксии и энергетического дефицита) необходимо до гемодинамической катастрофы или в ранние сроки после нее [12].
Важным является понимание патофизиологических сдвигов, развивающихся при критических состояниях, которые базируются на двух фундаментальных положениях:
— основным эффектом любой гипоксии является дефицит энергии;
— гипоксия приводит к формированию в организме синдрома системного воспалительного ответа (ССВО), который может сопровождаться кризисом биоэнергетики вследствие истощения синтеза АТФ, что обусловливает повышение потребности в энергии [13, 14].
Это определяет значимость включения в комплекс интенсивной терапии на самых ранних этапах лечебной помощи для предупреждения или максимально быстрого устранения этих метаболических нарушений дополнительных энергетических субстратов, способных восстанавливать функционирование дыхательной цепи митохондрий и поддерживать жизнедеятельность клетки, ткани, органа и организма в целом.
Таким образом, проблема гипоксии не может быть решена без обеспечения энергетического субстрата, способного вернуть процессы окисления в клетке на привычный аэробный путь.
В настоящее время имеется большой выбор инфузионных сред и установлено, что основным действующим веществом тех из них, которые обладают антигипоксическим действием, являются субстраты цикла Кребса (ацетат, малат, фумарат, сукцинат), среди которых особое место занимает сукцинат, являющийся универсальным метаболитом человеческого организма со свойствами метаболического и энергетического корректора [15].
Среди инфузионных растворов, содержащих сукцинат (реамберин, цитофлавин, ремаксол), все большее внимание клиницистов привлекает реамберин как наиболее соответствующий требованиям сбалансированного энергокорректора, воздействующего сразу на несколько звеньев дисбаланса гомеостаза [16–18].
Реамберин является сбалансированным полиионным раствором, имеющим физиологическую ионную структуру, близкую к содержанию электролитов в плазме крови, позволяющим достигать физиологического кислотно-щелочного баланса с бикарбонатными и метаболизирующимися ионами, что дает возможность избегать риска таких ятрогенных осложнений, как нарушение осмолярности плазмы и кислотно-щелочного равновесия.
Дополнение сбалансированного полиионного раствора уникальным энергетическим субстратом — сукцинатом натрия — позволяет вернуть процессы окисления в клетке на привычный аэробный путь за счет его незаменимого участия в реакциях цикла Кребса и как субстрата второго комплекса дыхательной цепи митохондрий [20].
Реамберин оказывает прямое влияние на клеточный метаболизм и транспорт свободного кислорода в ткани, а также обладает неспецифическим гемодинамическим действием, что обусловливает его многокомпонентные эффекты прежде всего на первично возникающие вследствие гипоксии метаболические расстройства, ведущие к развитию «триады смерти»:
— увеличение продукции энергии в клетке в условиях гипоксии путем стимуляции сукцинатного типа дыхания, восстановления функционирования цикла Кребса, улучшения работы энергозависимых ионных каналов;
— угнетение чрезмерной активации свободнорадикального окисления, что способствует увеличению энергопродукции, стабилизирует клеточные мембраны, уменьшает ферментемию, обеспечивает противовоспалительный эффект;
— уменьшение тяжести метаболического ацидоза;
— стимуляция продукции инсулина, снижение выраженности стресс-индуцированной гипергликемии и связанных с ней осложнений, интенсификация утилизации глюкозы и ускорение становления анаболической фазы постагрессивного периода;
— ускорение восстановления моторной функции кишечника [14–16].
В повседневной клинической практике реамберин уже нашел широкое применение. Однако не всегда учитываются его дополнительные метаболические и органопротективные эффекты, возможность его применения в комплексе интенсивной терапии на всех этапах лечебного процесса, включая и догоспитальный этап скорой медицинской помощи, что, особенно на ранних этапах начала его введения в достаточных дозах, может существенно повлиять на повышение качества лечения, его продолжительность и стоимость, снижение числа тяжелых осложнений и летальность [17–19].
Целью исследования стали изучение использования реамберина для профилактики и коррекции органных нарушений у пациентов при агрессивном воздействии различного генеза и оценка его влияния на течение заболевания и летальность.
Материалы и методы исследования
Проведено проспективное исследование, охватывающее 124 пациента, распределенных на 3 группы (табл. 1). Первую группу составили пациенты с заболеваниями разной этиологии, имеющие высокий риск развития СПОН. Они были подразделены на 2 подгруппы: контрольную, где пациенты получали базисную стандартную терапию основного заболевания, и основную, где дополнительно к базисной стандартной терапии получали реамберин в дозе 6–14 мл/кг/сутки внутривенно капельно в течение 3–5 дней. У всех пациентов первой группы изучалась динамика маркеров развития ССВО и органной дисфункции.
/74-1.jpg)
Вторую группу составили пациенты с тяжелым сепсисом и септическим шоком, которые были разделены на две подгруппы: контрольную, в которой интенсивная терапия проводилась в соответствии с международными рекомендациями, разработанными экспертами «Движения за выживаемость при сепсисе», и основную, где дополнительно к этому вводился реамберин в дозе 6–14 мл/кг/сутки внутривенно капельно в течение 5–7 суток. Проводилось изучение состояния микроциркуляции на основе шкалы тяжести шокового состояния Р. Spronk, гастрально-альвеолярного градиента CO2 (ГАГСО2, мм рт.ст.) на основе гастральной тонометрии и конечной порции выдыхаемого газа; оценка метаболического ответа и митохондриального редокси-статуса (динамика уровня глюкозы, соотношение лактата и пирувата, активность АЛТ, АСТ, γ-глутамилтрансферазы, α-гидроксибутиратдегидрогеназы, концентрация С-реактивного белка и протеина С, а также интегральная оценка тяжести состояния пациентов по шкалам APAСHE II и SOFA с оценкой результатов лечения по конечным точкам на исходном этапе, на 3-и, 5-е и 28-е сутки).
В третьей группе исследовалось кардиопротективное действие реамберина при кардиохирургических вмешательствах на фибриллирующем сердце в условиях искусственного кровообращения с последующим восстановлением организованной деятельности сердца путем проведения электрической дефибрилляции. Пациенты также были разделены на две подгруппы: контрольную — со стандартным комплексом послеоперационной интенсивной терапии и основную — с использованием реамберина в первые 6 часов после операции в дозе 14 мл/кг массы тела внутривенно капельно в дополнение к стандартному комплексу интенсивной терапии. Исследовалась динамика уровня кардиоспецифических ферментов, отражающих ишемически-реперфузионное повреждение миокарда: креатинфосфокиназа (КК), ее изофракция КК-МВ, тропонин I, лактатдегидрогеназа.
Статистическую обработку результатов исследования проводили с использованием методов биометрического анализа, реализованных в пакетах программ Excel 2003, Statistica 8.0.
Результаты исследования и их обсуждение
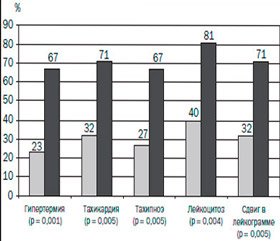
В первой группе исследования нами было выявлено, что профилактическое назначение препарата реамберин у пациентов в критических состояниях разной этиологии обусловливало значительное снижение частоты появления маркеров ССВО (рис. 2). Аналогичным образом в основной группе значительно реже появлялись ранние признаки полиорганных нарушений по сравнению с пациентами контрольной группы, причем данные отличия носили достоверный характер (рис. 3).
Таким образом, применение реамберина у пациентов в критическом состоянии с высоким риском развития ССВО и СПОН оказывает профилактический эффект, о чем свидетельствуют:
— уменьшение числа случаев проявлений ССВО как ранней системной реакции на вызвавшие их факторы;
— уменьшение числа случаев появления ранних признаков полиорганных нарушений, особенно респираторной, почечной, гастроинтестинальной, печеночной дисфункций.
Во второй группе исследования под влиянием реамберина наблюдалось более быстрое улучшение микроциркуляции, о чем свидетельствовало восстановление общей и регионарной перфузии в сравнении с контрольной группой: с 6,41 балла исходно до 0,96 балла по шкале Р. Spronk на 5-е сутки заболевания, в группе контроля — с 6,1 до 9,5 балла. Аналогичная динамика нашла свое отражение при анализе показателя гастрально-альвеолярного градиента CO2 (ГАГСО2) в виде снижения с 5,9 мм рт.ст. исходно в обеих подгруппах пациентов до уровня 0,93 в основной и 1,66 мм рт.ст. в контрольной подгруппе на 5-е сутки исследования.
Улучшение функционального состояния печени вносило весомый вклад в предупреждение дальнейшего прогрессирования ПОН.
Реамберин оказывает влияние на ведущие звенья патогенеза СПОН — микроциркуляторную дисфункцию и митохондриальную депрессию, что сопровождается улучшением общего состояния больных, быстрым регрессом полиорганных нарушений, улучшением клинических исходов с повышением выживаемости и качества жизни.
Улучшение микроциркуляции сопровождалось восстановлением эффективного транспорта кислорода. Так, в подгруппе с применением реамберина через 24 часа его доставка повышалась с 103,6 ± 10,7 до 164,8 ± 11,9 мл/мин/м2 (р = 0,003), в то время как в контрольной подгруппе — с 104,7 ± 11,3 до 131,5 ± 13,2 мл/мин/м2 (р = 0,12).
Существенная разница была отмечена во влиянии реамберина на уровень глюкозы крови и суточные дозы инсулина по сравнению с контрольной группой. Уже ко вторым суткам уровень глюкозы снижался до максимальной границы нормы, в контрольной подгруппе превышал 7,0 ммоль/л. Суточная доза инсулина при этом уменьшалась: в основной подгруппе — почти в 3 раза (с 33,8 ± 6,7 до 12,3 ± 2,4 ед/сут), в контрольной подгруппе — в 1,4 раза (с 34,1 ± 7,3 до 24,4 ± 6,1 ед/сут).
При анализе динамики уровня лактата нами была выявлена его нормализация в основной подгруппе уже на 3-и сутки (с 5,9 до 1,73 ммоль/л), чего не наблюдалось в контрольной группе (с 5,9 до 2,68 ммоль/л). Подобная динамика была выявлена при анализе индекса лактат/пируват. Так, в основной подгруппе было отмечено снижение индекса с 57,6 до 7,1 на 5-е сутки исследования по сравнению с контрольной подгруппой (с 62,5 до 12,3 соответственно). Катаболический индекс в группе с применением реамберина снижался с 9,3 до 2,6 на 5-е сутки исследования, в контрольной группе эта динамика была менее выражена (с 9,3 до 5,1).
Снижение суточной дозы инсулина для поддержания оптимальных значений глюкозы в крови в группе больных, получавших реамберин, наряду с повышением потребления кислорода, снижением концентрации лактата, лактат-пируватного и катаболического индексов указывают на значительную роль сукцината в обмене веществ у критических больных, что согласуется с данными других авторов [15].
Показательными явились результаты исследования маркеров печеночной дисфункции и показателей, характеризующих метаболический ответ при использовании реамберина (табл. 2).
Как видно, достоверно ускорялось восстановление функционального состояния печени. Изу–чаемые показатели нормализовались уже на 3-и сутки после проведения ранней целенаправленной интенсивной терапии. Напротив, в контрольной группе нормализация лабораторных показателей достигалась только к 5-м суткам лечения. Интенсивнее и в большей мере снижался уровень α-гидроксибутират-дегидрогеназы, что свидетельствовало о существенном уменьшении выраженности митохондриальной дисфункции при использовании реамберина.
Интегративным показателем степени развития полиорганной дисфункции, соответственно определяющим прогноз на выживание, являются шкалы APAСHE II и SOFA. Так, в основной подгруппе уже на 3-и сутки заболевания было отмечено уменьшение числа баллов по шкале APAСHE II с 14 до 8 и по SOFA — с 4,1 до 1,5, достигшее к 7-м суткам уровня 6,0 и 0,3 балла соответственно, что отражало положительную динамику в течении заболевания. В контрольной группе имели место менее быстрый регресс признаков развития СПОН и менее значительное снижение по сравнению с основной подгруппой: на 3-и сутки по шкале APAСHE II отмечалось снижение с 16 до 11 и по шкале SOFA — с 3,9 до 2,4 балла, к 7-м суткам — соответственно 8,0 и 1,1 балла.
Несомненный положительный эффект влияния реамберина был отмечен при оценке результатов лечения по конечным точкам. Так, по сравнению с контрольной подгруппой в основной подгруппе было выявлено снижение длительности пребывания в ОРИТ (с 11,8 до 9,3 %), уровня летальности (с 21,1 до 16,6 %) и персистирующей органной дисфункции (с 31,6 до 22,2 %). При этом в основной группе был выше на 19,6 % уровень выздоровления до 28-го дня заболевания и на 18,7 % лучше восстановление качества жизни до 36-го дня заболевания по сравнению с контрольной подгруппой.
Таким образом, реамберин оказывает влияние на ведущие звенья патогенеза СПОН — микроциркуляторную дисфункцию и митохондриальную депрессию, что сопровождается улучшением общего состояния пациентов, быстрым регрессом полиорганных нарушений, улучшением клинических исходов с повышением уровня выживаемости и качества жизни.
В третьей группе пациентов было проведено исследование кардиопротективного действия реамберина в кардиохирургической клинике на фибриллирующем сердце в условиях АИК с последующим проведением электрической дефибрилляции, что характеризуется развитием ишемически-реперфузионного и постдефибрилляционного повреждения миокарда в раннем послеоперационном периоде. Нами был установлено полифункциональное воздействие реамберина на экстракардиальный и интракардиальный гомеостаз.
Так, при его использовании уже через 12 часов после операции не наблюдалось дисбаланса КЩС, газового состава крови и уровня электролитов, имеющих место у пациентов контрольной подгруппы. Улучшались показатели газового состава крови после операции. Через 24 часа после операции отмечалось повышение РаО2 на 4,7 %, РvО2 — на 3 % при одновременном снижении РаСО2 на 5,6 %.
Положительное влияние реамберина на экстракардиальный гомеостаз способствовало лучшему восстановлению миокарда после проведения операции на сердце, что отражала динамика кардиоспецифических ферментов в раннем послеоперационном периоде.
Включение реамберина в комплекс интенсивной терапии ускоряло нормализацию интракардиального гомеостаза, обеспечивая снижение уровня биомаркеров повреждения сердца, таких как КК (на 7,2 %), КК-МВ (на 7,6 %) и тропонин I (на 30,8 %), по сравнению с контрольной подгруппой. Динамика лактатдегидрогеназы в обеих подгруппах обследованных пациентов отражена на рис. 4. Через 12 часов после операции отмечалась тенденция к ее снижению в отличие от контрольной подгруппы, где ее уровень продолжал нарастать.
Таким образом, использование реамберина в качестве органопротектора и энергокорректора в целях фармакологической защиты миокарда патогенетически обосновано, так как наряду со снижением темпа нарастания биомаркеров повреждения сердца нормализуется экстракардиальный гомеостаз, что оказывает комплексный кардиопротективный эффект.
Выводы
1. Реамберин может быть рекомендован в качестве метаболического и энергетического корректора для профилактики и коррекции микроциркуляторно-митохондриальной дисфункции как ключевого звена СПОН при различных критических состояниях.
2. Многофакторность действия реамберина благодаря его полиорганно-протекторному действию позволяет уменьшать полипрагмазию, избегать либо снижать число нежелательных взаимодействий одновременно вводимых лекарственных средств и ятрогенных осложнений.
3. Реамберин может быть использован в комплексе интенсивной терапии на всех этапах лечебного процесса начиная с догоспитального этапа скорой медицинской помощи. Для достижения максимального эффекта он должен вводиться своевременно (в период ранней адаптации к гипоксии) в соответствующих дозах, начиная с насыщающей, на фоне устранения нарушений микроциркуляции и адекватной доставки кислорода на уровне тканей, что позволяет предупреждать и корригировать органные и системные нарушения, улучшая конечные клинические результаты.

/73-1.jpg)
/74-1.jpg)
/75-1.jpg)
/75-2.jpg)
/76-1.jpg)
/77-1.jpg)