Статья опубликована на с. 79-82
Количественный рост нейротравмы в мире приобретает характер «скрытой эпидемии» [1]. Наибольшая частота получения ЧМТ приходится на лиц молодого и среднего возраста, а коэффициент смертности увеличивается параллельно возрасту пострадавших [2]. При этом среди мужчин смертность от ЧМТ в 2 раза больше, чем среди женщин. Степень структурного повреждения головного мозга при ЧМТ также выступает общепризнанным критерием прогноза тяжести течения и исхода травматической болезни головного мозга [3]. Социальная значимость ЧМТ определяется и высоким уровнем инвалидизации пострадавших [4]. Так, у двух из трех больных, перенесших ЧМТ (50–80 % наблюдений), проявляются последствия ЧМТ, протекающие с частыми состояниями декомпенсации, временной нетрудоспособности, последующей инвалидности. Поскольку по долгосрочным прогнозам ожидается дальнейшее увеличение ЧМТ — как по частоте, так и по тяжести, вопросы улучшения качества медицинской помощи приобретают первостепенное значение. По мнению многих авторов, одной из важнейших задач, которые приходится решать при организации и проведении лечения пострадавших с ЧМТ, является прогнозирование течения и исходов травматической болезни головного мозга. То есть прогноз при ТЧМТ оказывает влияние на коррекцию и адекватное динамическое управление лечебно-диагностическим процессом.
Цель данного исследования — на основании общепринятых прогностических критериев и выявленных биохимических маркеров построить прогностическую поэтапную модель тяжести течения и исхода ТЧМТ.
Материалы и методы
Основой работы послужили материалы комплексного клинического обследования, КТ-оценка структурных характеристик головного мозга и ликворосодержащих пространств, а также данные лабораторно-биохимических исследований, которые характеризуют состояние нейрогуморально-гормональных взаимоотношений и обмен О2 в организме, что позволяет оценить патогенетические особенности ТЧМТ и построить прогностическую модель ее исходов. Для этого обследовано 280 пострадавших мужского пола с ТЧМТ, средний возраст которых составлял 38,2 ± 4,1 года.
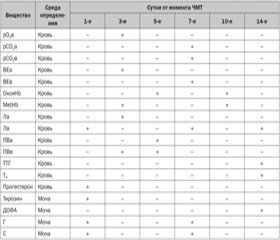
При построении модели прогноза были введены понятия критериев и маркеров тяжести течения и исходов ТЧМТ. К критериям тяжести течения и исходов ТЧМТ относили степень структурного повреждения головного мозга, исходную тяжесть расстройств сознания и витальных функций, а также возраст больных. В роли маркеров выступали показатели, характеризующие нейрогуморально-гормональные системы и обмен О2 в организме, уровни АКТГ, кортизола, альдостерона, тиреотропного гормона (ТТГ), Т3, Т4, прогестерона (ПГР), тестостерона, эстрадиола в крови, которые определялись радиоиммунными методами; адреналина (А), норадреналина (НА), дофамина (ДФМ), ДОФА, серотонина (С), гистамина (Г) в суточной моче. Динамическое содержание отдельных видов гемоглобина (метHb, сульфHb, оксиHb) изучали в одной пробе крови, уровни общего гемоглобина (HbО) и гематокрит (Ht) — по унифицированным методикам. Об уровнях лактата (Л) и пирувата (ПВ) в притекающей и оттекающей от мозга крови судили, определяя их энзимным методом. Кислотно-щелочное состояние, рО2, рСО2 в притекающей и оттекающей от мозга крови определяли на аппарате ABL-620 («Radiometer», Дания). Полученные данные сравнивали с показателями 30 здоровых добровольцев. Математическая обработка полученных результатов проведена на персональном компьютере с использованием пакета прикладных программ Statistica 6.0 в среде Windows XP.
О каждом больном были собраны данные, включающие 208 признаков, а именно: возраст, исходные тяжесть состояния и степень расстройств сознания, характер структурного повреждения головного мозга, биохимические показатели на 1-е, 3-и, 5, 7, 10 и 14-е посттравматические сутки и исходы лечения. Эти признаки оценивались как по количественной, так и по интервальной шкале. Число градаций признаков варьировало от 2 до 4. Увеличение градации признака соответствовало росту тяжести состояния пострадавшего. Первичное сжатие информации проводилось при помощи изучения оценки связи предиктных признаков с признаком, характеризующим исход ТЧМТ, при помощи методов параметрического (Пирсона) и непараметрического (Спирмена) корреляционного анализа. В матрице исходных данных оставляли только те признаки, у которых выявляли сильную (r > 0,7) или умеренную (0,7 > r > 0,3) и статистически значимую (р < 0,05) связь с результирующим признаком — исходом. Построение моделей поэтапного (1-е, 3-и, 5, 7, 10 и 14-е сутки) прогноза проводили методом дискриминантного анализа, который полностью соответствует решению задачи классификации больных с ТЧМТ по вариантам исходов (выжил, умер) в зависимости от совокупности ряда предиктных факторов. Для каждой группы больных (умерших и выживших) отдельно определялась линейная дискриминантная функция (ЛДФ), которая объединяла все включенные в модель признаки. Для уменьшения количества расчетов использовали ΔЛДФ
(ЛДФ1–ЛДФ2). Каждого конкретного больного относили к группе выживших (ЛДФ1) при положительном исходе и к группе умерших (ЛДФ2) — при отрицательном. Если ΔЛДФ ≈ 0, прогноз был неопределенным.
Результаты и их обсуждение
Для выявления прогностических биохимических маркеров исхода и тяжести течения ТЧМТ мы разделили всю совокупность обследованных больных на группу выживших (143 человека) и группу умерших на этапах лечения (137 больных). Средняя летальность составила 48,9 %. Анализ подтвердил наличие независимой от исхода ТЧМТ повышенной потребности организма в О2. Об этом свидетельствовал высокий уровень кортизола в крови, который превышал норму от 436,3 до 1039,7 %. При этом у впоследствии умерших, в отличие от выживших, доставка О2 к мозгу была снижена на всех этапах наблюдения с дефицитом рО2а 16,4; 31,4; 29,2 % на 3-и, 10-е, 14-е сутки. Одновременно мы отмечали независимое от исхода снижение потребления О2 клетками мозга, поскольку уровень рО2 в оттекающей от мозга крови на отдельных этапах наблюдения превышал норму на 45 %. Дефицит доставки и потребления О2, более выраженный при неблагоприятном исходе ТЧМТ, мог увеличивать степень деструкции мозговой ткани за счет усиления патологического метаболического каскада. И действительно, у впоследствии умерших уровень Л в оттекающей от мозга крови был ниже уровня его в притекающей крови на 1, 7 и 14-е сутки наблюдения, свидетельствуя об активном потреблении Л клетками мозга для уменьшения повреждающего действия гипоксии. Последняя могла поддерживаться нарушением мозгового кровотока (МК) из-за изменения содержания таких медиаторов, как НА, С, Г.
Анализ показал независимый от исхода рост Г, который усиливает отек головного мозга посредством расширения сосудов и повышения проницаемости клеточных мембран. При неблагоприятном исходе наибольшие отклонения Г от нормы (на 594,7–689,8 %) соответствовали 3-м и 7-м суткам, а на 1-е и 7-е сутки уровень его достоверно превышал таковой у выживших. Параллельно на фоне значительного и независимого от исхода роста уровня А мы отмечали достоверный, более выраженный у впоследствии умерших рост НА на протяжении всего срока наблюдения. При неблагоприятном исходе максимальные подъемы НА (на 444,0–556,3–439,0 % сверх нормы) соответствовали 3, 7 и 14-м суткам наблюдения. Это не только подтверждало вазоспазм и первичную ишемию мозга на 3-и сутки после ТЧМТ, но и указывало на формирование вторичной ишемии к 7-м. Для умерших характерным было истощение резервов САС к 14-м суткам наблюдения. Анализ не выявил роста АКТГ ни в одной из групп больных. Вместе с тем мы отмечали достоверный дефицит ТТГ у впоследствии умерших, который сочетался с низкими уровнями Т3 и Т4 при неблагоприятном исходе ТЧМТ. Одновременно в ответ на ТЧМТ усиливались нейропротективные реакции. Так, параллельно росту Г мы отмечали увеличение экскреторного С, более выраженное у впоследствии умерших. Рост ПГР достоверно превышал норму в обеих группах больных, но у выживших пациентов его уровень был достоверно выше, чем у умерших на этапах лечения. Так, в 1-е сутки после ТЧМТ уровень ПГР у них превышал норму на 2737,6 % против 1204,3 % у умерших.
В целом выявлено 18 достоверных биохимических маркеров исхода ТЧМТ.
Поэтому, выявив достоверные биохимические маркеры тяжести течения и исхода ТЧМТ (табл. 1), мы перешли к построению прогностической модели с учетом совокупности основных критериев исхода ТЧМТ: степени структурного повреждения головного мозга, исходной тяжести расстройств сознания и витальных функций, а также возраста больных.
В первый этап прогноза (1-е посттравматические сутки) вошло 3 наиболее значимых из совокупности определяемых признаков:
ΔЛДФ = 6,165628 – 1,14941 × С1 + 0,142438 ×
× ПГР1 – 2,12041 × КЛ ГР,
где ΔЛДФ = ЛДФ1–ЛДФ2; 6,165628 — константа; –1,14941; 0,142438 и –2,12041 — коэффициенты для значений С, ПГР и клинической группы в 1-е сутки.
Прогноз 2-го этапа по данным, полученным на 3-и посттравматические сутки, строился на основании четырех прогностических признаков:
ΔЛДФ = 22,17134 – 1,70357 × КЛ ГР – 5,80305 ×
× ТЯЖ – 1,4114 × МТ Hb3 – 3,063 84 × ВОЗ,
где 22,17134 — константа, –1,70357; –5,80305; –1,4114 и –3,06384 — коэффициенты.
Прогноз исхода ТЧМТ на 5-е сутки после травмы — это 3-й этап прогноза. Он строился на основании четырех наиболее значимых признаков:
ΔЛДФ = 11,46343 + 0,025891 × ОКHb5 – 1,38803 ×
× КЛ ГР – 3,86661 × ТЯЖ – 2,02893 × ВОЗ,
где 11,46343 — константа, 0,025891; –1,38803; –3,86661 и –2,02893 — коэффициенты.
Построение модели 4-го этапа прогноза исхода ТЧМТ осуществлялось на основании клинических и лабораторных данных, полученных на 7-е сутки после травмы. В модель вошло 5 наиболее прогностически значимых признаков. Значения ЛДФ вычислялись по формуле:
ΔЛДФ = 68,237 + 4,193785 × ВЕв7 – 3,2264 × Г7 –
– 18,5241 × КЛ ГР + 16,575 × Лв7 + 1,073721 × С7,
где 68,237 — константа, 4,193785; –3,2264; –18,5241; 16,575 и 1,073721 — коэффициенты.
Разработка модели 5-го этапа прогноза проводилась на основании клинических и лабораторных данных, полученных на 10-е сутки после травмы. В модель вошло 2 наиболее прогностически значимых признака.
ΔЛДФ = – 17,828 +0,19608 × ОКHb10 – 1,7796 ×
× МТHb10,
где –17,828 — константа, 0,19608; –1,7796 — коэффициенты.
Построение модели 6-го этапа прогноза производилось на основании клинических и лабораторных данных, полученных на 14-е сутки после травмы. В модель вошло 3 наиболее прогностически значимых признака. Значения ЛДФ вычислялись по формуле:
ΔЛДФ = 24,86644 – 0,00829 × ДОФА14 – 4,2665 ×
× Лв14 – 2,88013 × КЛ ГР,
где 24,86644 — константа, –0,00829; –4,2665; –2,88013 — коэффициенты.
В целом на всех этапах наблюдения (табл. 2) информационная способность этой модели была высокой, составляя от 87,5 до 97,6 %.
Выводы
Высокодостоверная поэтапная модель прогноза тяжести течения и исхода ТЧМТ должна включать такие общепризнанные прогностические критерии, как степень структурного повреждения головного мозга, исходная тяжесть расстройств сознания и витальных функций, возраст пострадавшего, в сочетании с биохимическими маркерами: С и ПГР в 1-е сутки; метHb — в 3-и; оксиHb — в 5-е; С, Г, Лв, ВЕв — в 7-е; метHb, оксиHb — в 10-е; ДОФА, Лв — в 14-е.

/81-1.jpg)
/82-1.jpg)