Статья опубликована на с. 92-95
Острый респираторный дистресс-синдром (ОРДС) является клиническим синдромом, характеризующимся некардиогенным отеком легочной ткани с тяжелым нарушением газообмена и механики дыхания, соотношением вентиляция/перфузия в легких. Лечение основано на использовании инвазивной механической вентиляции легких (МВЛ) с низким дыхательным объемом (ДО), умеренными или высокими PEEP и FiO2 для улучшения оксигенации и снижения работы дыхания [1].
По данным E. Festic et al. [2], диагностические критерии ОРДС включают острое начало, двусторонние легочные инфильтраты на Rо-граммах, отсутствие значительных дисфункций левого желудочка (давление заклинивания легочных капилляров < 18 мм рт.ст.) и отношение PaO2/FiO2 (P/F) — ≤ 300. Соотношение SpO2/FiO2 (S/F) определяли параллельно. Отношение SF/PF описано уравнением регрессии: SF = 57 + 0,61 PF (p < 0,001). Отношения SF 181 и 235 соответствовали P/F 300 и 200. При SF 235 чувствительность составляла 57 % и специфичность — 100 %. Вывод: отношение S/F является надежным неинвазивным суррогатным показателем для выявления ОРДС с преимуществом в простоте и неинвазивности: P/F = SF – 57 / 0,61.
Ретроспективное когортное исследование [3] проведено у 260 пациентов с тяжелым сепсисом и септическим шоком. Общая летальность — 28 %. Низкое соотношение S/F < 164 связано с повышенной летальностью по сравнению с S/F > 236; отношение S/F коррелирует с P/F (R = 0,48; p < 0,0001).
Механическая вентиляция легких вызывает структурные изменения в легких: термин «респираторные легкие» подразумевает диффузные альвеолярные инфильтраты и гиалиновые мембраны, повышенную сосудистую проницаемость, легочный отек, что многие авторы определяют как вентилятор–индуцированное легочное повреждение (Ventilator Induced Lung Injury — VILI) [4].
J.A. Lorente et al. [5] выполнили прижизненную биопсию легких у 101 больного с ОРДС. Диффузное альвеолярное повреждение (ДАП) при ОРДС, выявленное в 56,4 % случаев, ассоциировалось с высокой летальностью. ДАП проявлялось повышенной альвеолокапиллярной проницаемостью и появлением гиалиновых мембран (ранних признаков фиброза).
В проспективном мультицентровом (20 отделений интенсивной терапии (OИТ)) рандомизированном контролируемом исследовании, проведенном R.M. Kacmarek et al., установлено, что в первые 12–36 часов от начала ОРДС используется тактика открытых легких (Open Lung) с PEEP > 10 см вод.ст., дыхательным объемом 4–8 мл/кг, FiO2 ≥ 0,5, что улучшало оксигенацию без различий в летальности, количестве дней без МВЛ и частоте баротравмы: летальность до 60 суток — 29 % при Open Lung против 33 % в группе ARDS Network Protocol (p = 0,18) [6]. K. Okamoto установлена допустимая гипоксемия: PaO2 — 60 мм рт.ст., SpO2 — 90 % при PaCO2 ~ 49 мм рт.ст., pH 7,25–7,35 [7]. Низкий индекс PaO2/FiO2 и шок ассоциируются, по мнению K. Chawla et al. [8], с неудачной неинвазивной вентиляцией легких (НВЛ) и высокой летальностью — 37,1 %. Предикторами неудач при НВЛ являются: низкое значение PaO2/FiO2, шок, оценка по шкале APACHE II > 20 баллов. Неинвазивная МВЛ при ОРДС применяется только в случае легкого и среднетяжелого течения, при тяжелом ОРДС НВЛ лишь приводит к запоздалой интубации [9]. В этиологии гипоксической респираторной недостаточности 51,82 % занимает пневмония. НВЛ была невозможной у 51 % пациентов при PaO2/FiO2 > 200 мм рт.ст. [10].
Согласно данным K.N. Kangelaris et al. [11], в подгруппах больных с ОРДС с поздней интубацией летальность до 60 суток от момента заболевания выше (56 %) в сравнении с подгруппой с ранней интубацией — 36 % (p < 0,03) и подгруппой пациентов, не требующих интубации, — 26 % (p = 0,002). Поздняя интубация ассоциируется с увеличением частоты летальности. Берлинские определения ОРДС при 5 см вод.ст. позволяют лучше оценить рекрутабельность легких [12].
V. Fanelli et al. [13] считают, что МВЛ с ДО 6 мл/кг идеальной массы тела поддерживает давление плато (Pplato) ниже 30 см вод.ст., не предотвращает риск VILI. В исследовании оценивали эффективность и безопасность стратегии вентиляции с очень низким ДО (ультрапротективный ДО — 3 мл/кг) и экстракорпоральным удалением CO2. Снижение ДО до 4 мл/кг и Pplato < 25 см вод.ст. с удалением СO2 (ультрапротективная стратегия МВЛ) и низкопоточным удалением CO2 улучшает клинические исходы при среднетяжелом OРДС.
/93-1.jpg)
У 103 пациентов из четырех многопрофильных ОИТ, которым требовалась МВЛ более 24 часов, R. Panwar et al. [14] сравнивали две стратегии оксигенации: консервативную (или рестриктивную), с целевыми значениями SpO2 88–92 % (n = 52), и либеральную, с целевым SpO2 ≥ 96 %. Результаты исследования поддерживают консервативную стратегию оксигенации у пациентов, получающих инвазивную МВЛ. Консервативная (рестриктивная) стратегия оксигенации (SpO2 88–92 %) более безопасна, чем либеральная (SpO2 ≥ 96 %), так как вредные эффекты гипероксии и гипероксемии превышают риск допустимой гипоксемии [15].
Клинические вопросы в формате PICO представлены J. Claesson et al. [16]: P — релевантная популяция пациентов; I — интервенции; С — тщательный осмотр; О — значимый исход.
Мультицентровое контролируемое исследование J. Waechter et al. [17] включало ОИТ 24 госпиталей в 3 странах мира с анализом данных 28 849 пациентов; наиболее низкая летальность установлена у больных, в 1-й час получавших более 1 л жидкости, у которых вазоактивные агенты назначались в 1-й час терапии.
В исследовании Fluid and Catheter Treatment Trial (FACTT) консервативные протоколы инфузионной (FACTT Conservative), консервативной (FACTT Lite) и либеральной (FACTT Liberal) терапий отличались кумулятивным водным балансом (за 7 дней): 1,918 ± 323,000 мл — при режиме Lite; 1,36 ± 491,00 мл — Conservative и 6,992 ± 502,000 мл — Liberal (p < 0,001). Результаты сходны при терапии Lite и Conservativе; летальность не отличалась во всех группах (24 % при Lite, 25 % при Conservative и Liberal, p = 0,84); продолжительность МВЛ больше в группе Liberal [18].
M.W. Sempler et al. [19] провели ретроспективный анализ мультицентрового рандомизированного исследования Fluid and Catheter Treatment Trial для сравнения консервативной и либеральной инфузионной терапии при ОРДС и определения роли центрального венозного давления (ЦВД) в стратегии инфузионной терапии у 934 пациентов с МВЛ при ОРДС с изменением ЦВД (609 из них — без исходного шока). У больных с ЦВД > 8 мм вод.ст. летальность была одинаковой (18 и 18 %, р = 0,928) при консервативной и либеральной инфузионной терапии. В группе с ЦВД ≤ 8 мм вод.ст. летальность оказалась ниже при консервативной инфузионной терапии (17 против 36 %, р = 0,005). Мультивариантный анализ показал взаимосвязь между начальным ЦВД и влиянием типа инфузионной терапии на летальность (р = 0,031). Выводы: консервативная инфузионная терапия при ОРДС снижает летальность у пациентов с исходно низким ЦВД. В этой популяции применение внутривенной жидкости приводит к росту летальности.
По данным C. Mikacenic et al. [20], увеличение содержания циркулирующего и альвеолярного интерлейкина-17А (IL-17A) ассоциируется с повышением уровня альвеолярных нейтрофилов, альвеолярной проницаемости, частоты органной дисфункции при ОРДС.
Реактивация цитомегаловируса часто наблюдается при ОРДС и является причиной роста летальности. Из 399 пациентов с ОРДС у 68 % серопозитивные результаты на ЦМВ; реактивация вируса наблюдалась у 27 % из них [21].
J.J. Hye et al. [22] считают, что при ОРДС и рефрактерном септическом шоке изолированная вено-венозная или вено-артериальная экстракорпоральная мембранная оксигенация (ECMO) ведет к неадекватной тканевой перфузии, особенно коронарного и церебрального кровотока. VVA-модификация является альтернативой в лечении ОРДС при рефрактерном шоке. Экстракорпоральная мембранная оксигенация начала исследоваться с 1950-х годов в кардиохирургии; вено-венозная ECMO — при тяжелой ОДН во время пандемии H1N1 в 2009 году; при тяжелом ОРДС с рефрактерной гипоксемией выживаемость пациентов в специальных центрах респираторной терапии составляла 79 %. Доказательств в пользу использования ECMO в будущем при рефрактерной гипоксемии недостаточно [23].
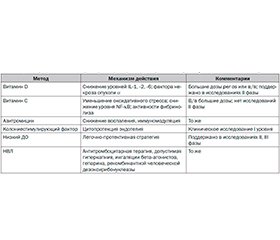
Согласно исследованиям K.G. Brower et al. [24], шкала оценки степени тяжести повреждения легких (Lung Injury Prediction Score, LIPS) включаeт: зло–употребление алкоголем, ожирение, химиотерапию, гипоальбуминемию, ЧДД > 30 в 1 мин, SpO2 < 95 %, FiO2 > 35 %, pH ≤ 7,35 и диабет. Оценка по шкале LIPS > 4 баллов позволяет выявлять пациентов с риском развития ОРДС (чувствительность — 69 %, специфичность — 78 %). Авторами предложены методы профилактики ОРДС у пациентов высокого риска (табл. 2).
Список литературы
1. Chiumello D., Coppola S. Nonintubated Patients with Acute Respiratory Distress Syndrome: A Watchful Evaluation // Journal Critical Care Med. — 2016. — Vol. 44, iss. 1. — Р. 246-247.
2. Festic E., Bansal V., Kor D.J., Cajic O., Illness USC Injury Trials Group, Lung Injury Prevention Study 1 (2015). SpO2/FiO2 Ratio on hospital Admission is on Indicator of Early Acute Respiratory Distress Syndrome Development Among Patients at Risk // J. Intensive Care Med. — 2015. — Vol. 30. — P. 209-216.
3. Serpa Neto A., Cardoso S.O., Ong D.S., Esposito D.C. et al. The use of the pulse oximetric saturation/fraction of inspired oxygen ratio for risk stratification of patients with severe sepsis and septic shock // Journal of Critical Care. — 2013. — Vol. 18. — P. 681-686.
4. Slutsky A.S., Raniery V.M. Ventilator-Inducted Lung Injury // N. Engl. J. Med. — 2013. — Vol. 369. — P. 2126-2136.
5. Lorente J.A. et al. Acute respiratory distress syndrome: does histology matter? // Crit. Care. — 2015. — № 19. — P. 337.
6. Kacmarek R.M., Villar J., Sulemanji D., Montiel R. et al. Open Lung Approach for the Acute Respiratory Distress Syndrome: A Pilot, Randomized Controlled Trial // Journal of Critical Care Med. — 2015. — Vol. 44, iss. 1. — P. 32-42.
7. Okamoto K. Permissive hypoxemia: another strategy // Journal of the Japanese Society of Intensive Care Medicine. — 2016. — Vol. 23, № 2. — P. 113-116.
8. Chawla R., Mansuriya J., Modi N., Pandey A. et al. Acute respiratory distress syndrome: Predictor of noninvasive ventilation fai–lure and intensive care unit mortality in clinical practice // Journal of Critical Care. — 2016. — Vol. 31, iss. 1. — P. 26-30.
9. Sehgal J.S., Dhooria S., Agarwal R., Chaudhty D. Noninvasive ventilation in acute respiratory distress syndrome: A long way ahead // Journal of Critical Care Med. — 2016. — Vol. 20, iss. 2. — P. 129-130.
10. Guillaume C. et al. Failure of Noninvasive Ventilation for De Novo Acute Hypoxemic Respiratory Failure: Role of Tidal Volume // Journal of Critical Care Med. — 2016. — Vol. 20, iss. 2. — P. 282-290.
11. Kangelaris K.N., Ware L.B., Wang Ch.J., Janz D.K. et al. Timing of Intubation and Clinical Outcomes in Adults with Acute respiratory Distress Syndrome // Journal of Critical Care Med. — 2016. — Vol. 44, iss. 1. — P. 120-129.
12. Caironi P., Carlesso E., Cressoni M., Chiumello D. et al. Lung Recruitability is Better Estimated ed According to the Berlin Definition of Acute Respiratory Distress Syndrome at Standard 5 cm H2O rather Than Higher Positive End-Expiratory pressure. Retrospective Cohort Study // Journal of Critical Care Med. — Vol. 43, iss. 4. — P. 781-790.
13. Fanelli V., Ranieri M.V., Mancebo J., Moerer O. et al. Feasibility and safety of low-flow extracorporeal carbon dioxide removal to facilitate ultra-protective ventilation in patients with moderate acute respiratory distress syndrome // Crit. Care — 2016. — Vol. 20. — P. 36.
14. Panwar R., Hardil M., Bellomo R., Barrof L. et al. Conservative versus Liberal Oxygenation Targets for Mechanically Ventilated Patients. A Pilot Multicenter Randomized Controlled Trail // Am. J. of Resp. and Crit. Care Med. — 2016. — Vol. 193, № 1. — P. 43-51.
15. Pannu S.R., Dziadzko M.A., Gajic O. How Much Oxygen? Oxygen Titration Goals during Mechanical Ventilation // Am. J. of Resp. and Crit. Care Med. — 2016. — Vol. 193, № 1. — P. 4-5.
16. Claesson J., Freundlich M., Gunnarsson J., Laake J.H. et al. Scandinavian clinical practice guideline on mechanical ventilation in adults with the acute respiratory distress syndrome // Acta Anaesthesiologica Scandinavica. — 2015. — Vol. 59, iss. 3. — P. 286-297.
17. Waechter J., Kumar A., Lapinsky S.E., Marshall J. et al. Interaction Between Fluid and Vasoactive Agents on Mortality in Septic shock. A Multicenter, Observational Study // Journal of Critical Care Med. — 2014. — Vol. 42, iss. 10. — P. 2158-2168.
18. Grissom C.K., Hirshberg E.L., Dickerson J.B., Brown S.M. et al. Fluid Management with a Simplified Conservative Protocol for the acute Respiratory Distress Syndrome // Jounal of Crit. Care Med. — 2015. — Vol. 43, iss. 2. — P. 288-295.
19. Semler M.W., Wheeler A.P., Thompson R.T., Bernard G.R. et al. Impact of Initial Central Venous Pressure on outcomes of conservative Versus Liberal Fluid Management in Acute Respiratory Distress Syndrome // Journal of Critical Care Med. — 2016. — Vol. 44, iss. 4. — P. 782-789.
20. Mikacenic C., Hansen E., Radelld F., Gharib S.A. et al. Interleukin‑17A is Associated with Alveolar Inflammation and Poor outcomes on Acute Respiratory Distress Syndrome // Journal of Critical Care Med. — 2016. — Vol. 44, iss. 3. — P. 496-502.
21. Ongl D.S., Spitoniy C., Kllin F.M. et al. Cytomegalovirus reactivation and mortality in patients with acute respiratory distress syndrome // Intensive Care Med. — 2016. — Vol. 42, iss. 3. — P. 333-341.
22. Hye J.J., Doosoo J., Tun S.K., Woo H.Ch. et al. Veno-veno-arterial extracorporeal membrane oxygenation treatment in patients with several acute respiratory distress syndrome and septic shock // Crit. Care. — 2016. — Vol. 20. — P. 28.
23. Mosier J.M., Kelsey M. et al. Extracorporeal membrane oxygenation (ECMO) for critically ill adults in the emergency department in the emergency department: history, current applications, and future directions // Crit. Care. — 2015. — № 19. — P. 431.
24. Brower R.G., Antonelli M. What’s new in ARDS: can we prevent it? // Intensive Care Med. — 2016; DOI: 10.1007/s00134-016-4280-0.

/93-1.jpg)
/94-1.jpg)