Статья опубликована на с. 134-138
Введение
Абдоминальная гистерэктомия является одной из травматичных операций в акушерско-гинекологической практике, при которой может отмечаться значительный дискомфорт в послеоперационном периоде [1]. Применение мультимодального подхода к послеоперационной аналгезии у данных пациентов является предпочтительным, так как он обладает хорошей аналгезией при незначительных побочных эффектах [2]. Реакция организма на хирургическую травму и послеоперационный болевой синдром приводит к совокупности патофизиологических эндокринных и метаболических изменений, именуемых хирургическим стресс-ответом. В реализации данного ответа основную роль играет активизация соматосенсорных и симпатических афферентов. Одним из наиболее мощных триггеров является болевая импульсация с места разреза, активизирующая вегетативную нервную систему. Эффективная блокада нервов, иннервирующих переднюю брюшную стенку, значительно снижает проявления послеоперационного болевого синдрома и вызванные им расстройства внутренних органов и систем. Полученные за последние годы данные об эффективности блокады поперечного пространства живота (Transversus Abdominis Plane block — TAP-блок) обусловили появление значительного интереса к ней [3]. В то же время, по данным литературы, сравнительная оценка ТАР-блока с другими методами послеоперационного обезболивания освещена недостаточно широко.
Цель исследования: проведение сравнительного анализа различных методик послеоперационного обезболивания с точки зрения их влияния на метаболические компоненты хирургического стресс-ответа и реакции вегетативной нервной системы.
Материалы и методы
В исследование вошли 104 женщины, которым в плановом порядке выполнена абдоминальная гистерэктомия. В зависимости от вида послеоперационного обезболивания все пациентки разделены на три группы. В контрольную группу (I) вошли 37 женщин, которые в послеоперационном периоде получали системно декскетопрофен в дозе 50 мг каждые 8 часов и морфина гидрохлорид 10 мг внутривенно по требованию. Вторая группа (II) была представлена 33 пациентками, у которых дополнительно к основной аналгезии применялась про–дленная эпидуральная аналгезия (ЭДА). В третьей группе (III) применение декскетопрофена в дозе 50 мг каждые 8 часов сочеталось с применением продленного ТАР-блока и опиатов по требованию. Пациенты всех групп были сопоставимы по возрасту, весу, росту и объему и длительности операций, уровню анестезиологического риска по ASA I–II класса (табл. 1).
/135-1.jpg)
У пациенток контрольной группы и ТАР-блока проводилась стандартизированная тотальная внутривенная анестезия в условиях миоплегии ардуаном. Индукция осуществлялась внутривенным введением тиопентала натрия в дозе 4–5 мг/кг и диазепама 5–10 мг. Аналгезия обеспечивалась внутривенным фракционным введением фентанила, индукционная доза — 3,7–3,8 мкг/кг, в течение операции доза определялась из расчета 4–5 мкг/кг/ч. Пациенткам, которым проводилась продленная ЭДА, оперативное вмешательство выполнялось под комбинированной общей анестезией с эпидуральной аналгезией. Эпидуральный катетер использовался для проведения продленной эпидуральной аналгезии в послеоперационном периоде. Эпидуральная аналгезия осуществлялась через шприцевой дозатор (Utas, Украина) 0,0625% раствором бупивакаина со скоростью 6–8 мл/ч.
Блокада поперечного пространства живота (ТАР-блок) выполнялась сразу после операции методикой, основанной на анатомических ориентирах [4, 5]. У всех пациентов, распределенных в группу TAP-блока, треугольник Petit легко пальпировался, поперечная нейрофасциальная плоскость живота была локализована после одной-двух попыток, блок был выполнен без осложнений.
Для выполнения ТАР-блока использовался эпидуральный набор B.Braun Perifix® 400. После окончания операции в асептических условиях через поясничные треугольники Petit иглой Tuohy 18G выполнялась пункция нейрофасциального поперечного пространства живота. Поперечное пространство живота (ТАР) идентифицировалось методом «двух хлопков»: первый «хлопок» возникает при прохождении иглы через фасцию наружной косой мышцы живота, второй «хлопок» указывает на прохождение иглы через фасцию внутренней косой мышцы живота и идентификацию ТАР-пространства [6]. После проведения аспирационной пробы и отсутствия признаков внутрисосудистого расположения катетера вводилась тест-доза лидокаина 20 мг. В последующем производилась инъекция лидокаина 1% 20 мл билатерально, затем устанавливался катетер для дальнейшего обезболивания. Сенсорный блок развивался в течение 20–30 мин. Уровень сенсорного блока определялся методом «булавочного укола». В послеоперационном периоде продолжалось болюсное введение локальных анестетиков в ТАР-пространство в течение 24 часов. Дальнейшее обез–боливание проводилось дискретно бупивакаином 0,375% по 10 мл с обеих сторон. При наличии болевого синдрома у пациента, который оценивался по визуальной аналоговой шкале (ВАШ) боли в 40 мм и более, дополнительно вводился морфина гидрохлорид 10 мг внутривенно.
Всем пациентам перед оперативным вмешательством, а также после экстубации и через 2, 4, 6, 12, 24 ч проводился контроль неинвазивного артериального давления, SpO2, EtCO2 и ЧД. Мониторинг выполнялся с помощью реанимационно-хирургического монитора Utas «ЮМ 300Р» (Украина). Кроме перечисленных параметров, данный аппарат выполняет спектральный анализ вариабельности сердечного ритма (ВРС), что позволяет оценить активность вегетативной системы у пациенток [7].
Состояние гормонального гомеостаза изучали методом определения концентрации кортизола в суточной моче как интегративный показатель стресс-ответа на послеоперационный болевой синдром. Также в динамике у всех женщин определяли уровень глюкозы крови как один из показателей влияния послеоперационного стресса на активность контринсулярных гормонов. Критерием эффективности проводимой аналгезии в хирургической клинике считалось снижение интенсивности болевого синдрома по ВАШ до 30–40 мм и менее. Статистический анализ выполнялся с помощью пакета прикладных программ Statistica v. 6
Результаты
Послеоперационный болевой синдром вызывает изменения тонуса вегетативной нервной системы (ВНС), а также приводит к дисбалансу между ее симпатическим и парасимпатическим отделами. Мы проводили спектральный анализ сердечного ритма с целью определения степени изменения активности вегетативной нервной системы (табл. 2). Полученные результаты свидетельствуют, что исходные показатели ВСР у пациенток всех групп перед операцией значимо не отличались и соответствовали нормальному соотношению тонуса симпатического и парасимпатического отделов вегетативной нервной системы.
/136-1.jpg)
При применении системной аналгезии НПВС в сочетании с опиатами по требованию у пациентов в послеоперационном периоде отмечался выраженный дисбаланс между его отдельными составляющими. Постепенное увеличение очень низкочастотных компонентов ВСР (VLF) указывает на активацию нейрогуморальной регуляции ангиотензиновой, терморегуляторной, хеморецептивной систем. В группе, в которой использовалась ЭДА, значения VLF на момент экстубации были на 32 % ниже, чем в контрольной, что указывает на низкий уровень гормональной модуляции регуляторных механизмов, в то время как в группе ТАР-блока значение VLF было увеличено на 18 %. На других этапах исследования показатели VLF в I группе постепенно снижались, что обусловлено уменьшением уровня церебрального влияния, вызванного действием наркотических анальгетиков. Во II и III группе было зафиксировано увеличение показателей VLF через 2 часа после операции до 911,8 (527,1–1299,9) и 1834,4 (1010,5–2538,3), что указывает на повышение уровня гормональной модуляции регуляторных механизмов, обусловленных увеличением церебрального влияния. Данные изменения в большей степени были характерны для группы ТАР-блока. Мощность низкочастотного спектра (LF), характеризующего влияние симпатоадреналовой системы на сердечную деятельность, была увеличена на всех этапах исследования во всех группах по сравнению с исходными значениями, что свидетельствует о повышении уровня мобилизующего потенциала ВНС. Наибольшие изменения отмечались в группах, где использовались методы региональной аналгезии. Параллельно с активацией симпатического отдела также происходила активация парасимпатического отдела ВНС, что подтверждалось увеличением значений высокочастотного компонента ВСР (HF). Наиболее значимое увеличение показателей отмечалось в группе ЭДА, что свидетельствует о высоком уровне восстановительного потенциала. Коэффициент LF/HF, отражающий вклад симпатического (LF) и парасимпатического (HF) звеньев в состояние вегетативной нервной системы, имел разнонаправленные изменения. В группе ТАР-блока преобладание ПНС в первые 6 часов менялось на СНС. Для контрольной группы характерной оставалась активизация симпатического отдела ВНС. У пациентов в группе ЭДА коэффициент LF/HF не имел значительных изменений в послеоперационном периоде.
Сравнительный анализ параметров гормонального гомеостаза показал, что содержание кортизола в суточной моче значительно превышало нормальные показатели (28,5–213,7 мкг/сутки) во всех трех группах. В контрольной группе показатели суточного кортизола мочи увеличивались в 3 раза по сравнению с нормальными значениями. В то же время в I группе исследования (TAP) показатели кортизола суточной мочи в первые послеоперационные сутки превышали верхнюю границу нормы в 2,2 раза, а во II группе (ЭДА) — в 2,1 раза. Таким образом, кортизол суточной мочи в контрольной группе в первые послеоперационные сутки в 1,3 раза превышал этот показатель в I группе исследования (ТАР) и в 1,6 раза — во II группе (ЭДА). Увеличение экскреции суточного кортизола мочи в 2 раза и более в сравнении с исходной (до операции) величиной свидетельствует о наличии хирургического стресса в послеоперационном периоде.
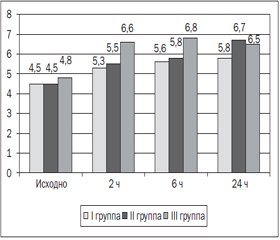
Повышенный уровень глюкозы в послеоперационном периоде отмечается во всех группах (рис. 1).
Гипергликемия — это проявление повышения уровня контринсулярных гормонов как следствие хирургического стресс-ответа. Наиболее высокие показатели гипергликемии отмечались в контрольной группе через 6 часов после операции — 6,8 (5,9–7,6), в то время как в группах исследования ЭДА и ТАР уровень глюкозы был ниже и составлял 5,6 (5,2–5,8) и 5,8 (5,3–6,5) соответственно (р < 0,001). В I и II группах изменения уровня глюкозы в крови имели однонаправленный характер и были статистически незначимы.
Обсуждение
При спектральном анализе вариабельности ритма сердца, который характеризует функциональную активность разных отделов вегетативной нервной системы, выяснилось, что добавление местного анестетика как компонента мультимодальной аналгезии эпидурально или при ТАР-блоке сопровождается существенной активностью обоих отделов ВНС — парасимпатического за счет резорбтивного, сегментарного действия и симпатического за счет компенсаторного ответа на первоначальную активацию парасимпатического отдела ВНС. Возникает напряжение функционирования структур ВНС, что может приводить к истощению и срыву компенсации. После ТАР-блока степень активации по отношению к исходному состоянию была ниже в обоих отделах ВНС по сравнению с эпидуральным применением местного анестетика. Наименьшая степень активации структур ВНС зарегистрирована у больных при системном применении декскетопрофена в сочетании с морфином. Однако это также не может однозначно восприниматься позитивно вследствие того, что определенные дозы морфина могут блокировать адаптационно-компенсаторные реакции ВНС.
В послеоперационном периоде наблюдалось повышение уровня глюкозы плазмы во всех трех группах, что может свидетельствовать о тенденции к сохранению послеоперационной стресс-индуцированной гипергликемии. Так, наиболее высокие показатели отмечались в контрольной группе, в то же время во II и III группах уровень глюкозы был ниже, что, в свою очередь, может быть обусловлено недостаточным уровнем послеоперационного обезболивания в контрольной группе.
Повышение уровня продукции кортизола напрямую связано с операционным травмированием ткани. В контрольной группе показатели суточного кортизола мочи увеличивались в 3 раза по сравнению с нормальными значениями. В то же время во II группе исследования показатели кортизола суточной мочи в первые послеоперационные сутки превышали верхнюю границу нормы в 2,1 раза, а в III группе — в 2,2 раза. Увеличение экскреции суточного кортизола мочи в 2 раза и более в сравнении с исходной (до операции) величиной свидетельствует о наличии хирургического стресса в послеоперационном периоде. Это является физиологической адаптационной реакцией. Поэтому мы далеки от мысли, что повышение продукции кортизола отображает только неадекватность послеоперационного обезболивания.
Заключение
Подведя итоги вышеизложенного, можно сделать вывод, что у пациентов в послеоперационном периоде отмечается выраженная активизация симпатического отдела ВНС. Наиболее значимый стресс-ответ на хирургическое вмешательство наблюдается у пациентов контрольной группы. В группе ТАР-блока определяется умеренная активация симпатического отдела ВНС, что указывает на хороший уровень послеоперационной аналгезии и повышенный уровень мобилизирующего потенциала. В группе ЭДА изменения ВНС были наименее выражены и характеризовались незначительной активацией симпатического отдела и более выраженной активностью парасимпатического отдела вегетативной нервной системы.
Список литературы
1. Farragher R.A., Laffey J.G. Postoperative pain management following cesarean section // Postoperative pain management: an –evidence-based guide to practice: 1st ed. — Philadelphia, PA: Saunders Elsevier, 2006. — С. 225-38.
2. Stanley G. et al. Dose requirements, efficacy and side effects of morphine and pethidine delivered by patient-controlled analgesia after gynaecological surgery // British journal of anaesthesia. — 1996. — Т. 76, № 4. — С. 484-486.
3. Forero M. et al. Lumbar transversus abdominis plane block: the role of local anesthetic volume and concentration — a pilot, prospective, randomized, controlled trial // Pilot and Feasibility Studies. — 2015. — Т. 1, № 1. — С. 10.
4. Rafi A.N. Abdominal field block: a new approach via the lumbar triangle // Anaesthesia. — 2001 Oct. — 56(10). — 1024-1026.
5. Jankovic Z.B., Pollard S.G., Nachiappan M.M. Continuous transversus abdominis plane block for renal transplant recipients // Anesthesia & Analgesia. — 2009. — Т. 109, № 5. — С. 1710-1711.
6. Hebbard P.D., Barrington M.J., Vasey C. Ultrasound-guided continuous oblique subcostal transversus abdominis plane blockade: description of anatomy and clinical technique // Regional anesthesia and pain medicine. — 2010. — Т. 35, № 5. — С. 436-441.
7. Різник Л. Варіабельність серцевого ритму як індикатор вегетативного балансу та глибини наркозу. 20-річний досвід застосування в анестезіології. Варіабельність серцевого ритму та загальна анестезія. Чи на сьогодні реально можливо оцінити вегетативний баланс та глибину наркозу? // Біль, знеболювання і інтенсивна терапія. — 2005. — № 1. — С. 28-37.

/135-1.jpg)
/136-1.jpg)
/137-1.jpg)