Статья опубликована на с. 27-35
Циклооксигеназа: изоформы фермента и физиологическая роль
Циклооксигеназа (ЦОГ) — распространенное название гемсодержащего, связанного с клеточной мембраной фермента, официально известного (согласно классификации Международного союза биохимии и молекулярной биологии — International Union of Biochemistry and Molecular Biology) как простагландинэндопероксидсинтаза. ЦОГ ответственна за синтез простаноидов, включая тромбоксан и простагландины. В настоящее время признано существование 2 изоформ фермента — ЦОГ-1 и ЦОГ-2, которые незначительно отличаются по молекулярной массе. ЦОГ катализируют реакцию превращения арахидоновой кислоты в простагландин Н2(PGH2), предшественник остальных простагландинов, простациклина и тромбоксана А2 [1–3].
Простагландины (PG) — группа физиологически активных веществ, образующиxся в организме ферментативным путем из арахидоновой, гамма-линоленовой и эйкозапентаеновой жирных кислот и содержащих 20-членную углеродную цепь (эйкозаноиды). Простагландины являются медиаторами с выраженным физиологическим эффектом. Наиболее активны простациклин и простагландины PGE2 и PGF2α.
Простациклин (простагландин I2, PGI2) опосредует бронходилатацию, вазодилатацию и ингибирование агрегации тромбоцитов.
В зависимости от взаимодействия с различными рецепторами PGE2 способен вызывать: вазодилатацию, бронхоконстрикцию или бронходилатацию, сокращение или расслабление гладкой мускулатуры ЖКТ, снижение секреции кислоты и повышение секреции слизи желудком, гипералгезию, пирогенный эффект, сокращение матки, угнетение липолиза.
PGF2α стимулирует бронхоконстрикцию и сокращение матки.
Тромбоксан A2 (ТХА2) секретируется тромбоцитами, является артериальным констриктором и вызывает агрегацию тромбоцитов, способствуя развитию артериальной гипертонии и коагуляционных нарушений. Тромбоксан B2 является неактивным продуктом метаболизма тромбоксана A2 [4–6].
Эффекты продуктов функционирования ЦОГ в организме человека с учетом наибольшей важности в их осуществлении определенных биологически активных веществ представлены в табл. 1.
ЦОГ-1 осуществляет свои функции непрерывно и ингибируется неселективными нестероидными противовоспалительными средствами (НПВС), что обусловливает развитие значительного количества неблагоприятных эффектов: бронхоспазма, ульцерогенеза, появления боли в ушах, задержки воды в организме. ЦОГ-2 является индуцибельным ферментом, скорость синтеза которого изменяется в зависимости от условий существования организма, а регуляция осуществляется на генетическом уровне под действием индукторов, в роли которых выступают соответствующие субстраты и метаболиты, то есть начинает функционировать при определенных ситуациях, например при воспалении. ЦОГ-2 экспрессируется макрофагами, синовиоцитами, фибробластами, гладкой сосудистой мускулатурой, хондроцитами и эндотелиальными клетками после индуцирования их цитокинами или факторами роста. Ингибирование ЦОГ-2 рассматривается как один из основных механизмов противовоспалительной активности НПВС, так как при селективном ингибировании данной ЦОГ-2 можно значительно уменьшить количество побочных эффектов, сопутствующих ингибированию ЦОГ-1 [2, 3, 8]. Сравнение свойств изоформ ЦОГ представлено в табл. 2.
/28.jpg)
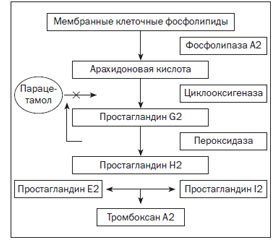
Неблагоприятные эффекты при назначении ингибиторов ЦОГ во многом обусловлены увеличением синтеза лейкотриенов, так как в этом случае начинает преобладать синтез продуктов липоксигеназного пути превращения арахидоновой кислоты (рис. 1).
Лейкотриены представляют семейство медиаторов воспаления, продуцируемых лейкоцитами из арахидоновой и эйкозапентаеновой жирных кислот. Наиболее важными являются LТА4, LТВ4, LТС4, LТD4, LТЕ4, LТF4.
Они могут реализовать свои эффекты через специальные рецепторы (CysLT- и LTB4-рецепторы). Лейкотриены опосредуют хемотаксис нейтрофилов, экссудацию плазмы, сокращение паренхимы легких, бронхоконстрикторные и вазоконстрикторные реакции, повышают тонус гладких мышц ЖКТ. Развитие аспириновой астмы как раз обусловлено гиперпродукцией лейкотриенов [4–6]. Другие неблагоприятные эффекты и осложнения обусловлены дефицитом самих простагландинов, участвующих в регуляции сосудистого тонуса, свертывающей системы крови, поддержании проходимости бронхов, почечного кровотока, водно-солевого обмена, защите слизистой желудочно-кишечного тракта и других физиологических процессах [10–12].
Изложенное выше представление о роли обеих изоформ ЦОГ в физиологии и патогенезе воспаления является наиболее распространенным. Однако в идеальную схему указанной концепции укладываются далеко не все факты. Показано, что в головном мозге, почках и костной ткани ЦОГ-2 продуцируется непрерывно, то есть в этих органах она представляет конститутивный фермент, а при патологии включается индуцированная работа фермента. Предполагается, что ЦОГ-2 является также конститутивной для органов женской репродуктивной системы. В настоящее время уже имеется достаточно большое количество новых научных данных, свидетельствующих о том, что в механизмах воспаления принимают участие обе изоформы ЦОГ. Начало воспалительного процесса нередко инициируется эффектами ЦОГ-1. А эффекты индукции ЦОГ-2 вступают в силу через несколько часов после реализации эффектов ЦОГ-1. Поэтому и ингибиторы ЦОГ-1, и ингибиторы ЦОГ-2 проявляют четкое противовоспалительное действие. Основная же роль в механизмах воспаления принадлежит ЦОГ-2. В частности, продукция провоспалительного PGE2 на 25 % обусловлена работой ЦОГ-1 и на 75 % — активацией ЦОГ-2 [13].
Также имеется большое количество данных о том, что на самом деле разделение продуктов работы ЦОГ на провоспалительные и противовоспалительные медиаторы также является весьма условным. У всех простагландинов обнаруживаются как одни, так и другие эффекты. Таким образом, продукция простаноидов представляется не только одним из механизмов патогенеза, но и обязательным компонентом защитно-приспособительных реакций, развивающихся в организме в результате действия патогенного фактора и функционирующих в нем в процессе болезни. Эффекты ЦОГ-2 в острой фазе заболевания имеют выраженную провоспалительную ориентацию, тогда как в фазе разрешения работа фермента в большей степени обеспечивает противовоспалительное действие. Поэтому назначение ингибиторов ЦОГ-2 в разрешительную стадию воспаления увеличивает его продолжительность [13–15].
Изоформы ЦОГ как мишень действия НПВС. Побочные эффекты при приеме НПВС
Факт угнетения воспаления аспирином посредством угнетения синтеза простаноидов был установлен в 1971 г. Джоном Робертом Вейном, тогда как чистая ЦОГ-2 получена только в 1988 г. С этого времени и началась работа над созданием НПВС с выраженной селективностью по отношению к ЦОГ-2.
Однако в лечебной практике продолжают широко использоваться НПВС с выраженной и умеренной селективностью действия по отношению к ЦОГ-1, а также препараты с равноценным антагонизмом к изоформам фермента [16–18]. Классификация НПВС по этому принципу с представлением наиболее часто используемых препаратов представлена в табл. 3.
Продолжение активного использования НПВС с тропностью к ЦОГ-1 обусловлено наличием у многих представителей этих групп выраженного противовоспалительного действия. С учетом силы этого действия НПВС целесообразно подразделить на препараты с выраженной и слабой активностью.
Представителями НПВС с выраженной противовоспалительной активностью являются: ацетилсалициловая кислота, лизинмоноацетилсалицилат, дифлунизал, фенилбутазон, клофезон, индометацин, сулиндак, этодолак, диклофенак, пироксикам, теноксикам, лорноксикам, мелоксикам, набуметон, ибупрофен, напроксен, флурбипрофен, кетопрофен, тиапрофеновая кислота, фенопрофен, целекоксиб.
К НПВС со слабой противовоспалительной активностью относятся: мефенамовая кислота, этофенамат, метамизол, аминофеназон, пропифеназон, кеторолак, парацетамол.
НПВС обеспечивают анальгетический, жаропонижающий и противовоспалительный эффекты. Другие эффекты, описанные в литературе, включающие изменение высвобождения и метаболизма брадикинина, гистамина, серотонина, стабилизацию лизосомальных мембран, не обусловлены взаимодействием НПВС с ЦОГ и непостоянны. Такие эффекты обнаруживаются у незначительной части препаратов [16–18].
Неблагоприятные эффекты, о которых предупреждает Food & Drug Administration США, включают:
1) серьезные побочные эффекты: сердечный приступ, инсульт, артериальную гипертензию, сердечную недостаточность с задержкой жидкости в организме, ренальную дисфункцию, включая ОПН, кровотечения из язв желудка и кишечника, анемию, угрожающие кожные реакции (синдромы Лайелла и Стивенса — Джонсона), печеночную дисфункцию, включая печеночную недостаточность, приступы бронхиальной астмы у страдающих астмой;
2) другие побочные эффекты: гастралгию, запоры, диарею, метеоризм, изжогу, тошноту, рвоту, головокружение и пространственную дезориентацию [11].
По современным представлениям, положительные терапевтические эффекты НПВС связаны с их способностью ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся побочные эффекты (поражение ЖКТ, почек, нарушение агрегации тромбоцитов и др.) — с подавлением активности ЦОГ-1. Действительно, среди наиболее широко используемых НПВС препараты, более селективные в отношении ЦОГ-2, чем ЦОГ-1, в 3–4 раза реже вызывают осложнения со стороны желудочно-кишечного тракта, чем менее селективные [19]. Однако практика применения селективных ингибиторов ЦОГ-2 вскрыла новые проблемы [20].
Использование в клинической практике коксибов (селективных блокаторов ЦОГ-2) показало, что их действие на организм ассоциировано с угнетением продукции простациклина (PGI2), который является антагонистом тромбоксана А2 (ТХА2), снижая агрегацию тромбоцитов, вызывая вазодилатацию и усиливая антикоагулянтное действие гепарина. В то же время продукция самого ТХА2 снижается незначительно, что и создает угрозу возникновения неблагоприятных кардиоваскулярных событий. Дефицит PGI2 определяет формирование эндотелиальной дисфункции [8, 21, 22].
В 2008 г. были опубликованы данные клинического исследования, включавшего 7636 пациентов, в котором изучался риск развития инсульта у принимавших неселективные и селективные ингибиторы ЦОГ. Отдел эпидемиологии и биологической статистики университета Эразма Роттердамского в Нидерландах выявил «значительное повышение риска развития инсульта (как ишемического, так и геморрагического) при приеме рофекоксиба» [23]. Эти данные были подтверждены в более масштабном исследовании во главе с C.L. Roumie (2008), где в результате анализа данных 336 906 лиц было выявлено, что прием рофекоксиба и вальдекоксиба достоверно увеличивал риск развития инсульта [24]. В 2009 г. C.L. Roumie и его коллеги выявили достоверное повышение частоты случаев проявления кардиоваскулярных заболеваний при приеме рофекоксиба и вальдекоксиба в сравнении с лицами, которые не употребляли НПВС, а также с теми, кто получал целекоксиб, ибупрофен, напроксен или диклофенак [25].
В обзоре Е. Dayani и K. Islam (International Drug Development Consultants Corporation, США, 2008) указывается, что на самом деле все ингибиторы ЦОГ обладают определенной кардиоваскулярной токсичностью. Ее проявления и последствия многообразны и включают развитие острого инфаркта миокарда, отеков, тромбозов и тромбоэмболических осложнений, дестабилизацию кровяного давления, а также смерть. Вероятность возникновения неблагоприятных кардиоваскулярных событий дозозависима, но разная для каждого из лекарственных препаратов. Так, низкие дозы аспирина уменьшают риск развития острого инфаркта миокарда и ишемического инсульта благодаря реализации антитромбоцитарного эффекта, но при увеличении дозы защитный эффект сменяется нарастанием риска развития инфаркта миокарда, нарушений сердечного ритма и проводимости. Риск развития повторного инфаркта миокарда и внезапной смерти при применении селективных и неселективных ингибиторов ЦОГ-2 увеличивается [26–28].
ЦОГ-3 и эффекты парацетамола. Какие НПВС достигнут головного мозга?
Современные представления об этом энзиме весьма противоречивы. В большинстве современных литературных источников ЦОГ-3 представляется в качестве энзима, продукция которого кодируется геном, ответственным за производство простагландинэндопероксидсинтазы-1 (ЦОГ-1). Официальная концепция, учитывающая наличие 2 изоформ ЦОГ, не объясняла аспекты иммунного ответа на лихорадку и воспаление, а также тот факт, что такой широко применяемый препарат, как парацетамол, оказывая обезболивающее и противолихорадочное действие, между тем не обладает противовоспалительным эффектом [29, 30].
В 1972 г. R. Flower и J. Vane обнаружили, что парацетамол ингибировал ЦОГ в гомогенатах головного мозга собаки более эффективно, чем в гомогенатах селезенки. Это послужило основанием гипотезы о наличии двух форм фермента, которые по-разному чувствительны к действию НПВС [31]. В 2000 г. R. Botting сообщила о результатах своих исследований, в которых было показано, что парацетамол угнетает синтез простагландинов в почках, но не угнетает его в тромбоцитах и слизистой желудка. В связи с тем, что парацетамол оказался очень слабым ингибитором известных изоформ ЦОГ (ЦОГ-1 и ЦОГ-2) in vitro, но проявлял активное действие в гомогенатах органов и тканей животных, было сделано предположение о существовании более чем 2 изоформ ЦОГ [32]. Впервые же в чистом виде вещество, которое считается ЦОГ-3, было выделено коллективом исследователей во главе с N. Chandrasekharan (2002), включая авторитетного специалиста в области биохимии и физиологических эффектов ЦОГ Даниэля Симмонса [30]. В процессе исследования была установлена чувствительность всех имеющихся изоформ ЦОГ к различным НПВС. Эти результаты приводятся в табл. 4.
/31.jpg)
При детальном рассмотрении табл. 4 обращает на себя внимание, что в большинстве случаев для угнетения функции ЦОГ-1 и ЦОГ-2 потребовалась концентрация НПВС, которая в 100–1000 раз превышала ту, которая была необходима для ингибирования ЦОГ-3. Следовательно, для достижения обезболивающего и противолихорадочного эффекта, обусловленного блокированием функции ЦОГ-3 в головном мозге, потребуются значительно меньшие дозы НПВС, чем в тех случаях, когда ставится задача получения противовоспалительного эффекта.
Однако указанные результаты представляют эффекты угнетения изоформ ЦОГ в условиях in vitro. В организме животных и человека способность НПВС ингибировать ЦОГ-3 в ЦНС значительно ограничена их способностью проникать через гематоэнцефалический барьер (ГЭБ). Известно, что карбоксилированные НПВС плохо проходят через ГЭБ [30, 33]. Это значит, что, например, при устранении центрогенной лихорадки для прохождения через ГЭБ потребуются значительно большие дозы таких препаратов, чем для достижения противовоспалительного действия «на периферии». Увеличение же дозы НПВС ассоциировано с ростом количества побочных эффектов.
К карбоксилированным НПВС относятся: ацетилсалициловая кислота, производные индолуксусной кислоты (индометацин, сулиндак), производные фенилуксусной кислоты (диклофенак), производные пропионовой кислоты (ибупрофен, кетопрофен, декскетопрофен, напроксен), производные гетероарилуксусной кислоты (кеторолак) [34–36].
Не содержат карбоксильных групп и хорошо проходят через ГЭБ: парацетамол, метамизол, оксикамы (пироксикам, лорноксикам, мелоксикам), производные сульфонамида — коксибы (целекоксиб) и сульфонанилида (нимесулид) [37–39].
Парацетамол обеспечивает развитие аналгезии за счет уменьшения продукции в головном мозге PGE2. Индуцированная парацетамолом гипотермия также обусловлена снижением синтеза PGE2. Этот эффект не отмечен у животных с отсутствием генов, отвечающих за продукцию ЦОГ-1, но не ЦОГ-2. В тестах стимуляции простациклиновых рецепторов с помощью интраперитонеального введения уксусной кислоты, индуцирующей высвобождение PGI2, так же как и при введении илопроста (синтетического аналога PGI2), диклофенак в обоих случаях оказывал более быстрое и продолжительное противовоспалительное действие, чем парацетамол. А синтез PGE2 в головном мозге эффективно блокировался парацетамолом, но не диклофенаком натрия. Таким образом, доказывают, что ни одна из известных изоформ ЦОГ (как ЦОГ-1, так и ЦОГ-2) не может быть главной мишенью фармакологического действия парацетамола. Концепция наличия ЦОГ-3 и ее высокой чувствительности к действию парацетамола является наиболее широко распространенной, но поддерживается далеко не всеми специалистами [40].
G.G. Graham и K.F. Scott (2005) указывают на то, что парацетамол, являясь относительно слабым ингибитором синтеза простагландинов в поврежденных тканях, между тем значительно угнетает их синтез в интактных тканях уже в небольших терапевтических концентрациях, где ЦОГ-2 может функционировать как конститутивный фермент. В то же время парацетамол обеспечивает фармакологические эффекты, сходные с действием селективных ингибиторов ЦОГ-2 (коксибов). Эти данные подтверждает группа исследователей во главе с B. Kis (2005). Они показали, что парацетамол эффективно блокировал воспалительный синтез PGE2, вызванный введением липополисахарида, который индуцирует активацию ЦОГ-2, но не –ЦОГ-1 и не ЦОГ-3. При рассмотрении этих результатов имеются основания полагать, что на самом деле парацетамол проявляет антагонизм по отношению к ЦОГ-2 [41, 42].
Преимущества и недостатки парацетамола
До сих пор парацетамол является наиболее часто назначаемым медикаментом во всем мире у пациентов всех возрастных групп и представляет первую ступень в этапах обеспечения обезболивания, рекомендованных экспертами ВОЗ. Это препарат первой линии для борьбы с болью и лихорадкой, играющий важную роль в обеспечении мультимодальной аналгезии [43–45]. Эффект аналгезии после внутривенного введения парацетамола появляется через 5 минут, достигает максимума через 40–60 минут и продолжается в течение 4–6 часов [46].
Превращение арахидоновой кислоты под влиянием ЦОГ в простаноиды представляет двухступенчатый процесс. Сначала под влиянием ЦОГ происходит образование очень нестабильного PGG2, который превращается в стабильный PGH2 под влиянием фермента пероксидазы. Парацетамол непрямым образом угнетает активность пероксидазы, и синтез простагландинов уменьшается. Чем слабее активность пероксидазы в данном органе (ткани), тем эффективнее сработает парацетамол. Поэтому препарат хорошо угнетает воспалительную реакцию в органах и тканях с низкой пероксидазной активностью и очень слабо угнетает воспаление там, где активность пероксидазы будет высокой. Наиболее низкая активность пероксидазы отмечается в головном мозге, поэтому здесь необходимый фармакологический эффект парацетамола будет лучше всего выражен. С учетом высокой проходимости через ГЭБ парацетамол особенно хорош для устранения центрогенной лихорадки (но не лихорадки, появляющейся в результате воспаления на периферии!) [46, 47]. Схема этих событий представлена на рис. 2.
/32.jpg)
Регуляция действия пероксидазы осуществляется с помощью ионов металлов — марганца, цинка, меди, кальция и др. Их присутствие влияет на соотношение собственно пероксидазной, оксидазной и оксигеназной активности. Ингибиторами пероксидазы являются цианиды и хелаты. С помощью хелатов, таких как ЭДТА, лимонная кислота и ее соли, можно предотвратить окислительные реакции, поэтому в их присутствии достигается усиление эффектов парацетамола [46–48].
Парацетамол демонстрирует аналогичную по качеству аналгезию в сравнении с эффектами других НПВС (включая ибупрофен, диклофенак, кеторолак и парекоксиб) при использовании последних в стандартных дозировках, а также не уступает умеренным дозам опиоидов (10 мг морфина внутривенно или 6,6 ± 1,2 мг/кг промедола в сутки) и не имеет их побочных эффектов (угнетение дыхания, тошнота, рвота, высвобождение гистамина, угнетение моторики ЖКТ, спазм сфинктера Одди, задержка мочи) [49–51].
Являясь средством для обезболивания первой линии, парацетамол, применяемый в комбинации с другими анальгетическими агентами (ибупрофен, кодеин, трамадол, кофеин), улучшает качество их действия с минимальным риском появления неблагоприятных реакций [47, 48].
Использование парацетамола для послеоперационного обезболивания ассоциировано с очень низкой стоимостью лечения при его высокой эффективности. В табл. 5 приводятся данные изучения стоимости, эффективности и коэффициента «стоимость/эффективность» при проведении периоперационного обезболивания с помощью различных медикаментов в университетской клинике Сан-Паоло.
Таким образом, парацетамол, обладая умеренной анальгетической активностью, имеет низкую стоимость. Применение парацетамола обеспечивает эффективное устранение боли и лихорадки и не создает риска развития побочных эффектов опиоидов:
— ухудшения функции сознания;
— депрессии функции внешнего дыхания;
— наркотической зависимости;
— тошноты и рвоты;
— бронхоспастических реакций;
— резкого снижения сосудистого тонуса;
— спазма сфинктера Одди и нарушения дренирования желчных путей;
— угнетения моторики кишечника;
— дизурических явлений (спазм сфинктера мочевого пузыря, мочеточников);
— усиления высвобождения гистамина и других НПВС:
— развития эрозий и язв желудка и двенадцатиперстной кишки с дальнейшим острым желудочно-кишечным кровотечением;
— бронхоспазма за счет увеличения продукции лейкотриенов (аспириновой астмы);
— нарушений свертывающей системы крови.
Парацетамол хорошо проходит через ГЭБ, поэтому может быть успешно использован у пациентов с повреждениями головного мозга различной этиологии для устранения центрогенной лихорадки, не индуцируя при этом манифестации судорожной активности. Следовательно, инфузии парацетамола могут быть показаны:
— пациентам с тяжелой черепно-мозговой травмой;
— больным с острыми нарушениями мозгового кровообращения;
— пациентам с инфекционными поражениями головного мозга и его оболочек;
— больным с тяжелыми проявлениями гипоксической энцефалопатии различного происхождения (после остановки сердца, на фоне осложнений эпилептического статуса, при поражении головного мозга электрическим током, на фоне последствий странгуляционной асфиксии, утопления и др.) — там, где имеет место формирование мезенцефального гиперметаболического синдрома.
Препарат давно широко используется для купирования приступов мигрени, а в настоящее время — в составе схем мультимодальной аналгезии [43, 47, 48].
Недостатком парацетамола является, прежде всего, гепатотоксичность. Она обусловлена действием его хиноновых метаболитов в условиях дефицита глутатиона. Гепатотоксичность парацетамола является главной причиной формирования синдрома острой печеночной недостаточности в США и Западной Европе. Причем около 300 000 случаев острой печеночной недостаточности в год приходится только на США. В 42 % случаев причиной манифестации гепатотоксичности парацетамола выступает его передозировка, поскольку парацетамол очень часто представляет один из компонентов комбинированных лекарственных препаратов, предназначенных для лечения простуды, гриппа, головной боли, мышечных болей, невралгий и другой патологии. В настоящее время FDA США ограничило содержание парацетамола в комбинированных препаратах до 325 мг на единицу [53–55].
Имеется серьезный риск поражения печени, если однократная суточная доза парацетамола составляет:
— 7500–10 000 мг у взрослых;
— 150 мг/кг у детей;
— 200 мг/кг у здоровых детей в возрасте 1–6 лет.
При подозрении на появление гепатотоксичности необходимо контролировать: функцию сознания, активность аминотрансфераз и щелочной фосфатазы в крови, концентрацию в плазме крови билирубина и его фракций, уровень протромбина, уровень гликемии, активность липазы и альфа-амилазы при наличии болей в животе, сывороточный хорионический гонадотропин (у женщин), уровень в плазме крови салицилатов (если они также назначались), концентрацию аммиака в плазме крови и показатели кислотно-основного состояния организма.
Для лечения больных с токсическими гепатитами, вызванными приемом парацетамола, используют первую ударную дозу N-ацетилцистеина внутривенно капельно 140 мг/кг. Затем используются 17 доз по 70 мг/кг. Инфузии проводятся каждые 4 часа. Общая продолжительность терапии обычно составляет 72 часа. Применение N-ацетилцистеина значительно уменьшает тяжесть течения гепатита и снижает летальность. N-ацетилцистеин может быть также использован для профилактики развития гепатотоксичности при лечении парацетамолом [53, 54, 56].
Рекомендованные дозы парацетамола составляют 325–650 мг каждые 4–6 часов при пероральном применении для взрослых (максимум 4000 мг в сутки и не более 2000 мг у пациентов с ожидаемым эффектом гепатотоксичности). Для детей: 10–15 мг/кг каждые 4–6 часов с максимальной суточной дозой 75 мг/кг [54]. FDA продолжает мониторирование результатов применения парацетамола.
Список литературы
1. Norregaard R. Physiology and pathophysiology of cyclooxygenase‑2 and prostaglandin E2 in the kidney / R. Norregaard, T.H. Kwon, J. Frokiaer // Kidney Research and Clinical Practice. — 2015. — Vol. 34. — P. 194-200.
2. Rouzer C.A. Cyclooxygenases: structural and functional insights / C.A. Rouzer, L.J. Marnett // Journal of Lipid Research. — 2008. — Vol. 50. — S. 29-34.
3. Simmons D.L. Cyclooxygenase Isozymes: The Biology of Prostaglandin Synthesis and Inhibition / D.L. Simmons, R.M. Botting, T. Hla // Pharmacological Reviews. — 2004. — Vol. 56, № 3. — P. 387-487.
4. Zreik T.G. The Prostaglandins: Basic Chemistry and Action / T.G. Zreik, H.R. Behrman / Glowm; A Free Resource for Medical Professionals [електронний ресурс] Update due 2016 / Режим доступу: http://www.glowm.com/section_view/heading/The%20Prostaglandins:%20Basic%20Chemistry%20and%20Action/item/312
5. King M.W. Introduction to the Eicosanoids / M.W. King / The Medical Biochemistry Page [електронний ресурс] Last modified: May 6, 2016 / Режим доступу: http://themedicalbiochemistrypage.org/eicosanoids.php
6. Serhan C.N. Pro-resolving lipid mediators are leads for resolution physiology / C.N. Serhan // Nature. — 2014. — Vol. 510, Issue 7503. — P. 92-101.
7. Claria J. Cyclooxygenase‑2 biology / J. Claria // Current Pharmaceutical Design. — 2003. — Vol. 9, № 27. — P. 2177-2190.
8. Roles of Cyclooxygenase (COX)-1 and COX‑2 in Prostanoid Production by Human Endothelial Cells: Selective Up-Regulation of Prostacyclin Synthesis by COX‑2 / G.E. Caughey, L.G. Cleland, P.S. Penglis [et al.] // Journal of Immunology. — 2001. — Vol. 167. — P. 2831-2838.
9. Cyclooxygenase and NSAIDs / University at Albany; State University of New York [електронний ресурс] / Режим доступу: http://www.albany.edu/faculty/cs812/bio366/Cyclooxygenase_ppt.pdf
10. Griffin R.M. Are Anti-Inflammatory Pain Relievers Safe for You? Here's help weighing the benefits and risks of NSAIDs, from aspirin to Celebrex / R.M. Griffin / WebMD [електронний ресурс] Medically updated August 2006 / Режим доступу: http://www.webmd.com/osteoarthritis/features/are-nsaids-safe-for-you
11. Medication Guide for Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) (See the end of this Medication Guide for a list of prescription NSAID/ Food & Drug AdministrationUSA [електронний ресурс] August 2007 / Режим доступу: http://www.fda.gov/downloads/Drugs/DrugSafety/ucm089162.pdf
12. Managing the Adverse Effects of Nonsteroidal Anti-inflammatory Drugs / P. Patrignani, S. Tacconelli, A. Bruno [et al.] // Expert Rev. Clin. Pharmacol. — 2011. — Vol. 4, № 5. — P. 605-621.
13. Ricciotti E. Prostaglandins and inflammation / E. Ricciotti, G.A. Fitzgerald // Arteriosclerosis, Thrombosis & Vascular Biology. — 2011. — Vol. 31, № 5. — P. 986-1000.
14. Anti-inflammatory effects of PGE2 in the lung: role of the EP4 receptor subtype / M.A. Birrell, S.A. Maher, B. Dekkak [et al.] // Thorax. — 2015. — Vol. 70, № 8. — P. 740-747.
15. Scher J.U. The anti-inflammatory effects of prostaglandins / J.U. Scher, M.H. Pillinger // Journal of Investigative Medicine. — 2009. — Vol. 57, № 6. — P. 703-708.
16. Non-Steroidal Anti-Inflammatory Drugs Comparison / eMed Expert [електронний ресурс] Last updated: April 01, 2016 / Режим доступу: http://www.emedexpert.com/compare/nsaids.shtml
17. Страчунский Л.С. Нестероидные противовоспалительные средства / Л.С. Страчунский, С.Н. Козлов / Смоленская государственная медицинская академия [електронний ресурс] / Режим доступу: http://www.antibiotic.ru/rus/all/metod/npvs/npvs.shtml
18. Cryer B. Cyclooxygenase‑1 and cyclooxygenase‑2 selectivity of widely used nonsteroidal anti-inflammatory drugs / B. Cryer, M. Feldman // American Journal of Medicine. — 1998. — Vol. 104, № 5. — P. 413-421.
19. Насонов Е.Л. Современное учение о селективных ингибиторах ЦОГ‑2: новые аспекты применения мелоксикама (Мовалиса) / Е.Л. Насонов // Научно-практическая ревматология. — 2003. — № 4 (68). — С. 87-91.
20. Solomon D.H. COX‑2 selective inhibitors: Adverse cardiovascular effects / D.H. Solomon / UpToDate [електронний ресурс] Literature review current through: May 2016 / Режим доступу: http://www.uptodate.com/contents/cox‑2-selective-inhibitors-adverse-cardiovascular-effects
21. Cardiovascularsafetyof non-steroidal anti-inflammatorydrugs: network meta-analysis / S. Trelle, S. Reichenbach, S. Wandel [et al.] // British Medical Journal. — 2011. — Vol. 342. — P. 7086.
22. Role of prostacyclin in the cardiovascular response to thromboxane A2 / Y. Cheng, S.C. Austin, B. Rocca [et al.] // Science. — 2002. — Vol. 296. — P. 539.
23. Cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs and risk of stroke / M.D. Haag, M.J. Bos, A. Hofman [et al.] // Arch. Intern. Med. — 2008. — Vol. 168, № 11. — P. 1219-1224.
24. Nonaspirin NSAIDs, cyclooxygenase 2 inhibitors, and the risk for stroke / C.L. Roumie, E.F. Mitchel, L. Kaltenbach [et al] // Stroke. — 2008. — Vol. 39, № 7. — P. 2037-2045.
25. Non-aspirin NSAIDs, cyclooxygenase‑2 inhibitors and risk for cardiovascular events-stroke, acute myocardial infarction, and death from coronary heart disease / C.L. Roumie, N.N. Choma, L. Kaltenbach [et al.] // Pharmacoepidemiology & Drug Safety. — 2009. — Vol. 18, № 11. — P. 1053-1063.
26. Dajani E.Z. Cardiovascular and gastrointestinal toxicity of selective cyclo-oxygenase‑2 inhibitors in man / E.Z. Dayani, K. Islam // Journal of Physiology & Pharmacology. — 2008. — Vol. 59, Suppl. 2. — P. 117-133.
27. Risk of death or reinfarction associated with the use of selective cyclooxygenase‑2 inhibitors and nonselective nonsteroidalantiinflammatory drugs after acute myocardial infarction / G.H. Gislason, S. Jacobsen, J.N. Rasmussen [et al.] // Circulation. — 2006. — Vol. 113, № 25. — P. 2906-2913.
28. Daily aspirin therapy: Understand the benefits and risks / Diseases and Conditions. Heart disease / Mayo Clinic [електронний ресурс] Nov. 03, 2015 / Режим доступу: http://www.mayoclinic.org/diseases-conditions/heart-disease/in-depth/daily-aspirin-therapy/art‑20046797
29. Kama P.C.A. COX‑3: uncertainties and controversies / P.C.A. Kama, A. Sob // South African Journal of Regional Anaesthesia, Pain. — 2011. — № 1 / SAJRAP [електронний ресурс] / Режим доступу: http://www.edoc.co.za/modules.php?name = News&file = article&sid = 3349
30. COX‑3, a cyclooxygenase‑1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression / N. Chandrasekharan, H. Dai, K. Roos [et al.] // Proc. Nat. Acad. Sci. USA. — 2002. — Vol. 99, № 21. — P. 13926-13931.
31. Flower R.J. Inhibition of Prostaglandin Synthetase in Brain explains the Anti-pyretic Activity of Paracetamol (4-Acetamidophenol) / R.J. Flower, J.R. Vane // Nature. — 1972. — Vol. 240. — P. 410-411.
32. Botting R.M. Mechanism of action of acetaminophen: is there a cyclooxygenase 3? / R.M. Botting // Clin. Infect. Dis. — 2000. — Vol. 31, Suppl. 5. — S. 202-210.
33. Bovill J.G. Mechanisms of actions of opioids and non-steroidal anti-inflammatory drugs / J.G. Bovill // Eur. J. Anaesthesiol. — 1997. — P. 9-15.
34. Effect of aminophylline on aspirin penetration into the central nervous system in rats / V. Vasovic, B. Banic, V. Jakovljevic [et al.] // Eur. J. Drug. Metab. Pharmacokinet. — 2008. — Vol. 33. — P. 23-30.
35. Mannila A.H. Central Nervous System Permeation of Ibuprofen, Ketoprofen and Indomethacin. In Vivo and In Situ Studies in Rats and Clinical Trials in Children / Doctoral dissertation [електронний ресурс] 2009 / Faculty of Pharmacy of the University of Kuopio / Режим доступу: http://epublications.uef.fi/pub/urn_isbn_978-951-27-1147-5/urn_isbn_978-951-27-1147-5.pdf
36. How readily does ketorolac penetrate cerebrospinal fluid in children? / E. Kumpulainen, H. Kokki, M. Laisalmi [et al.] // J. Clin. Pharmacol. — 2008. — Vol. 48, № 4. — P. 495-501.
37. Acetaminophen distribution in the rat central nervous system / J.P. Courad, D. Besse, C. Delchambre [et al.] // Life Sci. — 2001. — Vol. 69. — P. 1455-1464.
38. Cerebrospinal fluid and plasma concentrations of dipyrone metabolites after a single oral dose of dipyrone / O. Cohen, E. Zylber-Katz, Y. Caraco [et al.] // Eur. J. Clin. Pharmacol. — 1998. — Vol. 54, № 7. — P. 549-553.
39. Bernareggi A. The pharmacokinetic profile of nimesulide in healthy volunteers / A. Bernareggi // Drugs. — 1993. — Vol. 46. — P. 64-72.
40. Botting R. COX‑3 and the mechanism of action of paracetamol / R. Botting, S. Ayoub // Prostaglandins Leukotrienes and Essential Fatty Acids. — 2005. — Vol. 72, № 2. — P. 85-87.
41. Graham G.G. Mechanism of action of paracetamol / G.G. Graham, K.F. Scott // Am. J. Ther. — 2005. — Vol. 12. — P. 46-55.
42. Kis B. Acetaminophen and the Cyclooxygenase‑3 Puzzle: Sorting out Facts, Fictions, and Uncertainties / B. Kis, J.A. Snipes, D.W. Busija // Journal of Pharmacology & Experimental Therapeutics. — 2005. — Vol. 315. — P. 1-7.
43. Sharma C.V. Paracetamol: mechanisms and updates / C.V. Sharma / Continuing Education in Anaesthesia, Critical Care & Pain (2013) [електронний ресурс] / Режим доступу: http://ceaccp.oxfordjournals.org/content/early/2013/10/10/bjaceaccp.mkt049.full
44. Mattia C. What anesthesiologists should know about paracetamol (acetaminophen) / C. Mattia, F. Coluzzi // Minerva Anestesiol. — 2009. — Vol. 75. — P. 644-653.
45. Jahr J.S. Intravenous acetaminophen: a review of pharmacoeconomic science for perioperative use / J.S. Jahr, P. Filocamo, S. Singh // Am. J. Ther. — 2013. — Vol. 20. — P. 189-199.
46. Onset of acetaminophen analgesia: comparison of oral and intravenous routes after third molar surgery / P.L. Moller, S. Sindet-Pedersen, C.T. Petersen [et al.] // British Journal of Anaesthesia. — 2005. — Vol. 94. — P. 642-648.
47. Smith H.S. Potential analgesic mechanism of acetaminophen / H.S. Smith // Pain Physician. — 2009. — Vol. 12. — P. 269-320.
48. Paracetamol: new vistas of an old drug / A. Bertolini, A. Ferrari, A. Ottani [et al.] // CNS Drug Rev. — 2006. — Vol. 12. — P. 250-275.
48. Пероксидаза / Лекции по ферментам / Joomla! Open Source Content Management [електронний ресурс] / Режим доступу: http://food-chem.ru/lektsii-po-fermentam/27-peroksidaza.html
49. Randomised comparison of intravenous paracetamol and intravenous morphine for acute traumatic limb pain in the emergency department / M. Craig, R. Jeavons, J. Probert [et al.] // Emerg. Med. J. — 2012. — Vol. 29. — P. 37-39.
50. Intravenous acetaminophen reduces postoperative nausea and vomitting: a systematic review and meta-analysis / C.C. Arfel, A. Turan, K. Souza [et al.] // Pain. — 2013. — Vol. 154. — P. 677-689.
51. Георгиянц М.А. Опыт использования внутривенного парацетамола после ортопедических оперативных вмешательств / М.А. Георгиянц, Н.И. Волошин, В.И. Кривобок // Травма. — 2012. — Т. 13, № 4. — С. 77-80.
52. Secoli S.R. Cost-effectiveness analysis of the analgesic therapy of postoperative pain / S.R. Secoli, K.G. Padilha, J. Litvoc // Revista Latino-Americana de Enfermagem. — 2008. — Vol. 16, № 1 / SciFLOBrasil [електронний ресурс] / Режим доступу: http://www.scielo.br/scielo.php?script = sci_arttext&pid = S0104-11692008000100007
53. O’Malley G.F. Acetaminophen Poisoning / G.F. O’Malley, R. O’Malley / Merck Manual. Professional Version [електронний ресурс] Last full review/revision May 2015 / Режим доступу: http://www.merckmanuals.com/professional/injuries-poisoning/poisoning/acetaminophen-poisoning
54. Lancaster E.M. Acetaminophen hepatotoxicity: an updated review / E.M. Lancaster, J.R. Hiatt, A. Zarrinpar // Arch. Toxicol. — 2015. — Vol. 89, Issue 2. — P. 193-199.
55. FDA Drug Safety Communication: Prescription Acetaminophen Products to be Limited to 325 mg Per Dosage Unit; Boxed War–ning Will Highlight Potential for Severe Liver Failure / FDA, U.S. Food & Drug Administration [електронний ресурс] / Режим доступу: http://www.fda.gov/Drugs/DrugSafety/ucm239821.htm
56. Farrell S.E. AcetaminophenToxicity / S.E. Farrell / Medscape [електронний ресурс] Updated: May 18, 2016 / Режим доступу: http://emedicine.medscape.com/article/820200-overview
/29.jpg)
/32.jpg)

/28.jpg)
/30.jpg)
/31.jpg)
/33.jpg)