Журнал «Медицина неотложных состояний» 6 (77) 2016
Вернуться к номеру
Динаміка маркерів запалення у хворих після протезування клапанів серця
Авторы: Клигуненко О.М. - ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна; Яровенко В.В. - КЗ «Дніпропетровський обласний клінічний центр кардіології та кардіохірургії» ДОР, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
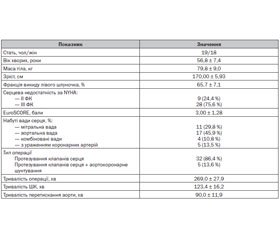
Мета: оцінити вплив штучного кровообігу на рівні маркерів запалення та виявити їх діагностичну значущість щодо перебігу раннього післяопераційного періоду у дорослих пацієнтів, яким проводилися кардіохірургічні операції. Матеріал та методи. У дослідження, що проводилося за відкритим дизайном, було включено 37 хворих із патологією клапанів серця, які були оперовані в умовах штучного кровообігу. На автоматичному гематологічному аналізаторі виконували кількісний підрахунок клітин крові. Лейкоцитарний індекс інтоксикації розраховували за формулою Кальф-Каліфа. Рівень цитокінів (інтерлейкін (IL) 1α, IL-6, фактор некрозу пухлини α, IL-10) у сироватці крові визначали методом імуноферментного аналізу. Точки контролю: до операції; після закінчення штучного кровообігу; 24 години після операції. Результати. Штучний кровообіг та операційна травма активують системну запальну відповідь, що проявляється у вигляді лейкоцитозу, підвищення рівнів цитокінів IL-6, IL-10 та IL-1α. Встановлено позитивний взаємозв’язок між кількістю лейкоцитів після штучного кровообігу та летальністю, концентрацією IL-6 у сироватці крові та часом перетискання аорти, індексом IL-6/IL-10 та тривалістю штучного кровообігу.
Цель: оценить влияние искусственного кровообращения на уровни маркеров воспаления и выявить их диагностическую значимость в отношении течения раннего послеоперационного периода у взрослых пациентов, которым проводились кардиохирургические операции. Материал и методы. В исследование, которое проводилось в открытом дизайне, были включены 37 больных с патологией клапанов сердца, которые были прооперированы в условиях искусственного кровообращения. На автоматическом гематологическом анализаторе выполняли количественный подсчет клеток крови. Лейкоцитарный индекс интоксикации рассчитывали по формуле Кальф-Калифа. Уровень цитокинов (интерлейкин (IL) 1α, IL-6, фактор некроза опухоли α, IL-10) в сыворотке крови определяли методом иммуноферментного анализа. Точки контроля: до операции; после окончания искусственного кровообращения; 24 часа после операции. Результаты. Искусственное кровообращение и операционная травма активируют системный воспалительный ответ, что проявляется в виде лейкоцитоза, повышения уровня цитокинов IL-6, IL-10 и IL-1α. Установлена положительная взаимосвязь между количеством лейкоцитов после искусственного кровообращения и летальностью, концентрацией IL-6 в сыворотке крови и временем пережатия аорты, индексом IL-6/IL-10 и продолжительностью искусственного кровообращения.
Aim: to assess the effects of cardiopulmonary bypass on the levels of inflammatory markers and identify their diagnostic value for the early postoperative period in adult patients after cardiac surgery. Material and methods. The study, designed as an open one included 37 patients with abnormal heart valves, which were operated under cardiopulmonary bypass. The automatic hematology analyzer was used to count blood. Intoxication leukocyte index was calculated by the formula of Kalf-Caliph. Cytokine levels (IL-1α, IL-6, TNF-α, IL-10) in serum were determined by enzyme immunoassay control points: before surgery; after cardiopulmonary bypass; 24 hours after surgery. Results. Extracorporeal circulation and operative trauma activate a systemic inflammatory response that manifests as leukocytosis, increased levels of cytokines IL-6, IL-10 and IL-1α. There was determined the positive correlation between the amount of white blood cells after cardiopulmonary bypass and mortality, blood serum concentration of IL-6 and aortic cross-clamping time, the index IL-6/IL-10 and duration of cardiopulmonary bypass.
штучний кровообіг, операції на серці, цитокіни, системна запальна відповідь.
искусственное кровообращение, операции на сердце, цитокины, системный воспалительный ответ.
cardiopulmonary bypass, cardiac surgery, cytokines, systemic inflammatory response.
Статтю опубліковано на с. 76-80
Вступ
Матеріал та методи дослідження
Результати та обговорення
Висновки
1. Гандзюк В.А. // Вісник соціальної гігієни та організації охорони здоров’я України. — 2014. — № 2(60). — С. 74-78.
2. Коваленко В.М., Корнацький В.М. Регіональні особливості рівня здоров’я народу України: Аналітично-статистичний посібник. — К., 2011. — 166 с.
3. AHA/ACC2014 Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. — 2014. — Vol. 63, I. 22. — Р. 2438-2488. — doi: 10.1016/j.jacc.2014.02.537.
4. Hаll R. Identification of Inflammatory Mediators and Their Modulation by Strategies for the Management of the Systemic Inflammatory Response During Cardiac Surgery // Journal of Cardiothoracic and Vascular Anesthesia. — 2013. — Vol. 27, I. 5. — Р. 983-1033.
5. Warren O.J., Smith A.J., Alexiou C. The inflammatory response to cardiopulmonary bypass: part 1 — mechanisms of pathogenesis // J. of Cardiothoracic and Vascular Anesthesia. — 2009. — Vol. 23, I. 2. — Р. 223-231.
6. Nearman H., Klick J., Eisenberg P., Pesa N. Perioperative Complications of Cardiac Surgery and Postoperative Care // Crit. Care Clin. — 2014. — Vol. 30, I. 3. — Р. 527-555.
7. Oikonomou E., Tousoulis D., Siasos G., Zaromitidou M., Papavassiliou A.G., Stefanadis Ch. The Role of Inflammation in Heart Failure: New Therapeutic Approaches // Hellenic J. Cardiol. — 2011. — Vol. 52. — Р. 30-40.
8. Jaffer U., Wade R.G. Cytokines in the systemic inflammatory response syndrome: a review // HSR Proc. Intensive Care Cardiovasc. Anesth. — 2010. — Vol. 2, I. 3. — Р. 161-175.
9. Warren O.J., Watret A.L., Alexiou C., Vinsent C. The inflammatory response to cardiopulmonary bypass: part 2 — anti-inflammatory therapeutic strategies // J. of Cardiothoracic and Vascular Anesthesia. — 2009. — Vol. 23, I. 3. — Р. 384-393.
10. Sabata R., Grützc G., Warszawskaa K., Kirscha S., Wittea E., Wolka K. Biology of interleukin‑10 // Cytokine & Growth Factor Reviews. — 2010. — Vol. 21, I. 5. — Р. 331-344.
11. Бабаев М.А., Еременко А.А., Винницкий Л.И., Бунятян К.А. Причины возникновения полиорганной недостаточности при кардиохирургических операциях в условиях искусственного кровообращения // Общая реаниматология. — 2010. — № VI(3). — С. 76-81.
12. Ng C.S., Arifi A.А., Wan S., Ho A.M., Wan I.Y., Wong E.M., Yim A.P. Ventilation During Cardiopulmonary Bypass: Impact on Cytokine Response and Cardiopulmonary Function // Ann. Thorac. Surg. — 2008. — Vol. 85. — P. 154-162.
13. Chen C.J., Kono H., Golenbock D. Identification of a key pathway required for the sterile inflammatory response triggered by dying cells // Nat. Med. — 2007. — Vol. 13, I. 7. — P. 851-856.

/77.jpg)
/78.jpg)