Статья опубликована на с. 95-97
Актуальность
Согласно данным МЗ Украины, частота первичной асфиксии новорожденных приближается к 10 %, а у 1 % детей встречается ее тяжелая форма [4]. Гипоксическое поражение центральной нервной системы (ЦНС) вследствие асфиксии является ведущей причиной высокой смертности и инвалидности новорожденных детей [1–3]. Однако в настоящее время отсутствуют объективные диагностические маркеры тяжести, глубины поражения ЦНС и определения возможного прогноза заболевания.
Одним из общепринятых диагностических критериев апоптоза, развивающегося на фоне гипоксического поражения ЦНС, является количество циркулирующей внеклеточной ДНК [5–7]. Данный показатель у новорожденных детей с гипоксическим поражением ЦНС остается малоизученным.
Материалы и методы исследования
Изучен уровень фрагментированной циркулирующей ДНК в крови у 86 новорожденных с перинатальным гипоксическим поражением головного мозга, гестационный возраст которых составил от 36 до 41 недели. Контрольную группу составили 20 здоровых доношенных детей.
Для определения групп и степени тяжести гипоксического поражения центральной нервной системы мы использовали анамнез заболевания, шкалу Апгар, клинические критерии, классификацию неврологического статуса по Н.П. Шабалову [2], а также инструментальные методы диагностики (нейросонографию).
I группа — 36 доношенных новорожденных детей с перинатальным гипоксическим поражением ЦНС легкой степени (оценка по шкале Апгар на 1-й минуте не ниже 6 баллов. Неврологический статус: возбуждение и/или угнетение ЦНС не более 5–7 суток);
II группа — 24 ребенка с перинатальным гипоксическим поражением ЦНС средней и тяжелой степени (оценка по шкале Апгар на 1-й минуте 1–5 баллов. Неврологический статус: возбуждение и/или угнетение ЦНС более 7 суток, кома, декортикация, децеребрация, прогрессирующая внутричерепная гипертензия, судороги);
III группа — 12 новорожденных с внутрижелудочковым кровоизлиянием (оценка по шкале Апгар на 1-й минуте 1–5 баллов. Неврологический статус: угнетение ЦНС, кома, внутричерепная гипертензия, судороги, апноэ);
IV группа — 14 новорожденных с сочетанным ишемически-геморрагическим поражением мозга (оценка по шкале Апгар на 1-й минуте 1–5 баллов. Клиническая картина и тяжесть состояния определялись ведущим типом поражения и локализацией).
Этапы исследования новорожденных — первые, третьи и седьмые сутки.
Для определения циркулирующей фрагментированной ДНК мы использовали метод, основанный на цветной реакции с дифениламиновым реагентом в модификации И.А. Комаревцевой и соавт. (выделение проводится сразу в лизис-буфере рН = 8).
Результаты
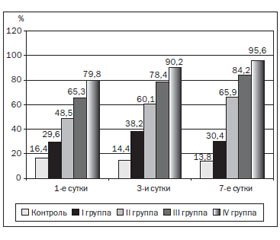
У всех новорожденных с гипоксическим поражением центральной нервной системы на всех этапах наблюдения начиная с первых суток регистрировалось увеличение количества циркулирующей фрагментированной ДНК (рис. 1).
Наиболее выраженные изменения отмечались в IV группе новорожденных с сочетанным ишемически-геморрагическим поражением мозга. В 1-е сутки наблюдения исследуемый показатель составлял 79,8 ± 5,2 %, что в 4,9 раза превышало данные контрольной группы.
При динамическом наблюдении на 3-й и 7-й день отмечались разнонаправленные изменения изучаемого показателя в зависимости от тяжести гипоксического поражения ЦНС новорожденных (рис. 2).
Уровень циркулирующей фрагментированной ДНК у здоровых новорожденных контрольной группы (рис. 2) снижался на 7-е сутки неонатального периода.
У детей с гипоксическим поражением ЦНС легкой степени (рис. 2) на 3-й день наблюдения отмечался максимальный рост циркулирующей фрагментированной ДНК, который превышал исходный уровень на 8,6 % с тенденцией к снижению и возвращению к первоначальным цифрам. В остальных группах на всех этапах исследования наблюдалось увеличение исходного показателя. Так, максимальный уровень апоптоза, согласно показателям фрагментированной ДНК, во II, III и IV группах наблюдался на 7-м этапе исследования. У новорожденных с перинатальным гипоксическим поражением ЦНС средней и тяжелой степени разница с исходным уровнем на последнем этапе исследования составляла 17,4 %. У пациентов с внутрижелудочковым кровоизлиянием изучаемый показатель на 7-е сутки по сравнению с исходным уровнем данной группы увеличивался в 1,3 раза. Наиболее выраженные изменения циркулирующей фрагментированной ДНК на 7-й день наблюдения отмечались у детей IV группы. По сравнению со здоровыми новорожденными исследуемый показатель возрастал в 6,9 раза, а с исходным уровнем данной группы — на 15,8 %.
Обсуждение
У новорожденных с перинатальным гипоксическим поражением ЦНС легкой степени ухудшение неврологического статуса на 3-и сутки совпадало с увеличением апоптоза. На следующем этапе наблюдения отмечалась положительная динамика, проявляющаяся уменьшением интенсивности апоптоза. Это соответствовало уменьшению уровня циркулирующей фрагментированной ДНК к 7-му дню наблюдения до 30,4 ± 3,3 %. По сравнению с исходными данными контрольный показатель был выше на 0,8 %.
У пациентов II группы тяжесть поражения головного мозга клинически проявлялась угнетением сознания вплоть до ступора или комы. Это сопровождалось нерегулярным дыханием, частыми апноэ. В клинической картине наблюдались диффузная гипотония мышц и выраженное снижение сухожильных рефлексов, отсутствие рефлексов новорожденных (сосательного, глотательного, хватательного, Моро), широкие зрачки, которые не реагировали или слабо реагировали на свет. У всех новорожденных детей данной группы отмечались судороги генерализованного характера. Такие дети нуждались в проведении искусственной вентиляции легких. При нейросонографическом исследовании наблюдались диффузное повышение эхогенности мозговой паренхимы, сужение боковых желудочков. Также отмечались признаки атрофии больших полушарий головного мозга с пассивным расширением желудочков. В нашем исследовании это проявлялось в постоянном увеличении уровня циркулирующей фрагментированной ДНК на всех этапах наблюдения. К 7-м суткам контрольный показатель возрастал в 4,8 раза по сравнению со здоровыми новорожденными.
У детей с внутрижелудочковым кровоизлиянием тяжесть поражения ЦНС наиболее часто проявлялась угнетением сознания вплоть до комы, судорогами, мышечной атонией, арефлексией, эпизодами апноэ. Также наблюдались бледность кожных покровов и видимых слизистых оболочек, цианоз, метаболический ацидоз. Большой родничок был напряженным и выбухал. Эти новорожденные находились на искусственной вентиляции легких. Нейросонографически выявлялись появление гиперэхогенных зон, вентрикуломегалия и деформация бокового желудочка в результате формирования кистозной полости, окклюзионная гидроцефалия. В просвете желудочков часто визуализировались тромбы (эхопозитивные образования). По мере прогрессирования последствий перинатального гипоксического поражения ЦНС уровень апоптоза возрастал. Мы наблюдали увеличение циркулирующей фрагментированной ДНК в кровеносном русле у новорожденных III группы на 3-м этапе исследования на 64 % по сравнению с референтной группой.
Наиболее выраженные неврологические изменения регистрировались в IV группе с сочетанным ишемически-геморрагическим поражением мозга. Клиническая картина зависела от ведущего типа поражения ЦНС (ишемия или кровоизлияние), а также от его тяжести и локализации. Данный вид повреждений головного мозга наиболее тяжелый, что проявлялось в возрастании уровня циркулирующей фрагментированной ДНК на 3-й день до 90,2 %, а к 7-му этапу исследования изучаемый показатель увеличивался в 6,9 раза по сравнению со здоровыми детьми. Это свидетельствует о том, что самые активные явления апоптоза наблюдались в IV группе новорожденных детей.
Выводы
Уровень циркулирующей фрагментированной ДНК в крови отражает тяжесть поражения ЦНС у новорожденных детей с гипоксическим поражением центральной нервной системы как гипоксически-ишемического, так и гипоксически-геморрагического типа. При уровне циркулирующей фрагментированной ДНК у новорожденных с перенесенной асфиксией выше 60 % заболевание имеет неблагоприятное течение.
Список литературы
1. Неонатология: Национальное руководство / Н.Н. Володин, ред. — М.: ГЭОТАР-Медиа, 2013. — 896 с.
2. Пальчик А.Б., Шабалов Н.П. Гипоксически-ишемическая энцефалопатия новорожденных. — 4-е изд., испр. и доп. — М.: МЕДпресс-информ, 2013. — 288 с.
3. Пальчик А.Б. Лекции по неврологии развития. — 2-е изд. — М.: МЕДпреcс-информ, 2013. — 368 с.
4. Приказ МЗ Украины № 225 от 28.03.2014 г. «Начальная, реанимационная и послереанимационная помощь новорожденным в Украине».
5. Тамкович С.Н., Власов В.В., Лактионов П.П. Циркулирующие ДНК крови и их использование в медицинской диагностике // Молекулярная биология. — 2008. — 42. — 1. — С. 12-23.
6. Rainer T.H., Wong L.K.S., Lam W., Yuen E., Lam N.Y.L., Metrewel C. et al. Prognostic use of circulating plasma nucleic acid concentrations in patients with acute stroke // Clin. Chem. — 2003. — 49. — 562-9.
7. Williams G.R., Jiang J.G., Matchar D.B., Samsa G.P. Incidence and occurrence of total (first-ever and recurrent) stroke // Stroke. — 1999. — 30. — 2523-8.

/96.jpg)