Статтю опубліковано на с. 124-131
Шаг за шагом процесс изучения роли инфузионных растворов в медицине критических состояний неумолимо движется вперед. Проблема устранения дефицита объема циркулирующей крови решена путем внутривенного введения солевых растворов после того, как в журнале The Lancet была опубликована статья Thomas Latta (1832), в которой описан опыт внутривенной инфузии больным с холерным обезвоживанием раствора, содержащего «...two to three drachms of muriate of soda two scruples of the subcarbonate of soda six pints of water...». В 1881 году A. Landerer впервые применил 0,9% раствор поваренной соли. В 1882 году S. Ringer модифицировал 0,9% раствор поваренной соли и с целью обес–печения большей физиологичности раствора ввел в рецептуру Ландерера хлориды калия и кальция, уменьшив содержание хлорида натрия. И наконец, A.F. Hartmann (1932) отметил, что использование физиологического раствора у детей с диабетом усиливает ацидоз и ухудшает прогноз. С целью нивелирования этого эффекта Hartmann ввел в раствор Рингера лактат в качестве носителя резервной щелочности [26, 27].
В настоящее время активно решается проблема коррекции гипоксии тканей с использованием сбалансированных растворов, что более всего актуально для пострадавшего головного мозга (нейропротекция) и миокарда (прекондиционирование). Но каков должен быть сбалансированный по электролитному составу инфузионный раствор и какой химический состав будет определять его физиологичность?
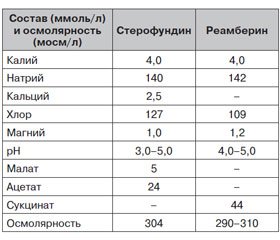
Сбалансированный электролитный раствор должен иметь физиологическую ионную структуру, аналогичную плазме по содержанию натрия, калия, кальция, магния, хлора, быть изотоничным по отношению к плазме и достигать физиологического кислотно-основного баланса с бикарбонатными или метаболизирующимися анионами [23]. Инфузия такого сбалансированного раствора избавляет от риска ятрогенных нарушений. За исключением, конечно, возможности перегрузки системы кровообращения объемом вводимой жидкости. Сбалансированный раствор должен быть максимально приближен к плазме крови по ионному составу. Для сравнения рассмотрим состав двух растворов кристаллоидов (табл. 1). Конечно, трудно сразу разобраться в преимуществах и недостатках, но тем не менее попробуем.
Сразу бросается в глаза присутствие в составах сравниваемых растворов малата, ацетата и сукцината. Включение в состав «пионеров» инфузионных растворов (раствор Рингера) дополнительного щелочного буфера продиктовано разумной целью ранней коррекции ацидоза при критических состояниях [26]. В дальнейшем в качестве носителей резервной щелочности стали использовать ацетат (уксусная кислота), лактат (молочная кислота), глюконат (глюкуроновая кислота), малат (яблочная кислота) и цитрат (лимонная кислота).
/124-131/125-1.jpg)
Суть присутствия указанных анионов в растворах для инфузионной терапии заключается в том, что, поглощая в процессе метаболизма ионы водорода и кислород, эти анионы метаболизируются с образованием HCO3–. При нормальных значениях pH угольная кислота является единственным источником ионов водорода для организма [12]. Следовательно, HCO3– высвобождается в эквимолярных количествах. Из каждого моля окисленного ацетата, глюконата или лактата получается один моль бикарбоната, тогда как при окислении каждого моля малата или цитрата получается 2 или 3 моля бикарбоната соответственно, а при окислении сукцината аналогично 2–3 моля важного анионного субстрата. Таким образом, растворы, содержащие сукцинат, более продуктивны относительно HCO3–, ведь количество молей сукцината, например, в реамберине вдвое больше, чем в стерофундине. И это не единственное преимущество сукцинатов.
Оказывается, что преимущество сукцинатов используется для увеличения сроков хранения крови. Например, сущность изобретения (патент РФ № 2410103 от 27.01.2011) заключается в том, что для консервирования донорской крови в состав гемоконсерванта (глюгицир) дополнительно вводят 3-окси-6-метил-2-этилпиридина сукцинат из расчета 0,25 мг на 1 мл 3-окси-6-метил-2-этилпиридина. Сукцинат оказывает корригирующее влияние на основные процессы структурно-функциональной дезорганизации клеточных мембран эритроцитов, чем уменьшает степень их повреждения, которое прямо связано с усилением перекисного окисления липидов и свободнорадикального окисления при длительном хранении компонентов донорской крови [10]. Предлагаемое решение дает возможность пролонгировать сроки хранения донорских эритроцитов в донорской эритроцитной массе до 30 суток, снизить уровень деструктивных процессов в хранящихся эритроцитах до момента востребования и повысить антиоксидантный статус эритроцитов. Это позволяет защитить клеточные мембраны от повреждающего действия токсичных свободнорадикальных продуктов, не только препятствует образованию новых радикалов в процессе хранения гемкомпонента, но и дает возможность использовать указанное свойство при диализирующих процедурах, что превращает наиболее реакционноспособные радикалы в менее активные [9, 16]. Возможно, с этим фактом связано и положительное влияние реамберина на реологические свойства крови [2, 3].
Кстати, именно ценность сукцината обеспечивает в большей степени волемический эффект гелофузина, известного сукцинилированного желатина, который не содержит кальций (натрия хлорид 5,382 г, магния хлорида гексагидрат 0,305 г, калия хлорид 0,373 г, натрия лактата раствор 3,360 г). Оказывается, что сукцинилированный желатин — это раствор желатина, обработанный ангидридом янтарной кислоты. Реакция сукцинилирования — способ выделения белков и нуклеиновых кислот из белково-нуклеиновых смесей, предложенная еще в 1981 году в СССР в виде реакции Барбье — Локкена — Виланда [11]. Отрицательные заряды, возникающие в молекуле в результате сукцинилирования, способствуют увеличению молекулы в размерах (при сохранении исходной молекулярной массы), таким образом формируются более объемные белковые цепи, чем несукцинилированные. Для предотвращения миграции молекул гелофузина через капиллярную мембрану протеиновым цепочкам придается выраженный отрицательный заряд, обусловленный реакцией с сукцинилированным ангидридом. Отрицательно заряженные молекулы гелофузина отталкиваются от эндотелиальной мембраны капилляра, также имеющей отрицательный заряд. Процесс сукцинилирования и формирования отрицательного заряда приводит к вытягиванию протеиновых цепочек, в результате чего занимаемый ими объем значительно увеличивается [11]. Вполне уместен вопрос: будет ли протекать реакция сукцинилирования без сукцината? Конечно, нет! Значит, любые растворы, содержащие сукцинат (ремаксол, реамберин), будут потенцировать реакцию сукцинилирования и обладать волемическим эффектом, ведь в плазме крови присутствуют белковые субстанции.
Очень важно, что содержание электролитов в инфузионных средах должно учитывать и содержание (отрицательный или положительный баланс) вышеназванных электролитов не только в плазме, но и в интра- и, главное, в экстрацеллюлярных секторах в период критического состояния, где он далек от физиологического баланса [21, 38]. Указанный баланс крайне неустойчив, и его благополучие, как известно, — энергозатратный процесс. Более того, все активные химические элементы, как всегда, конкурируют между собой. Касаясь сравниваемых растворов, нужно отметить, что наличие явных конкурентов (кальция и магния) в одной инфузионной среде — это только желание обес–печить некую зеркальность в отношении состава плазмы крови. Конкуренция сохраняется везде и всегда. В плазме крови — за связь с белковыми субстанциями в процессе активного всасывания и за «место под солнцем» в составе клетки, которая с учетом механизма апоптоза сама определяет приоритет для некоторых химических веществ в зависимости от вклада каждого элемента в ее жизне–деятельность.
Особое значение для любого инфузируемого раствора имеет его влияние на функцию Na+-К+-насоса, результатом которого является превышение концентрации ионов К+ внутри клетки приблизительно в 20–30 раз по сравнению с внеклеточной [35]. Соответственно этому концентрация ионов Na+ внутри клетки приблизительно в десять раз меньше, чем снаружи. Натрий оказывает наиболее значительное влияние на внеклеточный объем жидкости и, таким образом, автоматически и на циркулирующий объем крови или внутрисосудистый объем жидкости. Если концентрация натрия в сбалансированном инфузионном растворе находится в пределах от 138 до 146 ммоль/л, то он может адекватно поддерживать нормальную концентрацию натрия в плазме 142 ммоль/л [35]. Повреждение Na+-К+-насоса вызывает высвобождение ионов К+ из клетки и накопление в ней ионов Na+, что характерно для гипоксических состояний, токсических повреждений клетки, аллергии [32].
Калий является преобладающим катионом во внутриклеточном пространстве и играет ведущую роль, особенно при сердечных аритмиях, а также очень важен для функции почек [32]. Нормальная концентрация калия в плазме составляет 4,5 ммоль/л, следовательно, концентрация калия в сбалансированном растворе должна находиться в пределах от 4 до 5 ммоль/л.
Магний влияет на нейромышечную стимуляцию, нормализует деятельность мышцы сердца и его кровоснабжение, управляет процессами возбудимости и проводимости нервных элементов (нервная ткань, проводящая система сердца). Все энергетические процессы в организме проходят при обязательном участии магния. Магний обладает антиспастическим и сосудорасширяющим действием, стимулирует моторику кишечника и желчеотделение, способствует выведению холестерина, снижает свертываемость крови и риск камнеобразования в мочевых путях. При критических состояниях (табл. 2), с учетом разнообразных функций магния в организме, возможно, чаще всего имеет место гипомагниемия [36]. Являясь естественным антагонистом кальция, магний участвует в процессах мембранного транспорта, способствует торможению сократительной активности гладких и поперечнополосатых мышц за счет расслабления отдельных клеток (миоцитов) путем блокады кальцийзависимого взаимодействия сократительных белков. Способствуя фиксации калия в клетке, магний стимулирует поляризацию клеточных мембран. Он улучшает метаболизм витамина С и энергетическое превращение углеводов. Восполняя относительный дефицит дофамина, ослабляет беспокойство и раздражительность [44]. В последние годы возрос интерес к роли магния в генезе нарушений ритма сердца. С гипомагниемией некоторые авторы связывают увеличение показателя интервала QT, который рассматривается как один из важнейших предикторов возникновения нарушений ритма сердца [44]. Недостаток магния резко повышает риск инсульта и инфаркта миокарда. Согласно результатам ряда исследований, у больных, умерших от инфаркта миокарда, содержание магния в сердечной мышце было на 50 % ниже нормы, сниженное содержание этого микроэлемента обнаруживали также у больных гипертонической болезнью [44]. Будет ли восполняться дефицит магния в присутствии кальция? Трудно сказать.
/124-131/126-1.jpg)
Много вопросов возникает относительно участия кальция в сбалансированных электролитных растворах. Кальций — важный электролит, отвечающий за нейронную возбудимость и электромеханическое взаимодействие мышечных клеток, концентрация которого в нормальных условиях в цитозоле не превышает 0,1 мкМ [49]. Являясь важным регулятором многих обменных процессов, ионы кальция могут оказывать и нежелательное действие, поскольку значительное повышение его внутриклеточной концентрации запускает механизмы клеточной гибели, участвуя в некробиозе и апоптозе [18]. Внутри клеток концентрация кальция в 10 000–100 000 раз меньше, чем снаружи, поэтому уровень кальция вне и внутри клеток подлежит особому контролю, а при попадании в цитозоль кальций немедленно секвестрируется митохондриями, приводя к расстройствам фосфорилирования [41].
Активирование внутриклеточных процессов, в которых принимают участие ионы кальция, сопровождается увеличением его содержания в цитозоле до 0,6–2,0 мкМ [45]. Практически во всех клетках обнаружен кальцийзависимый активатор фосфодиэстеразы циклических нуклеотидов — белок с молекулярной массой 16,7 кДа — кальмодулин [22]. Избыточное активирование системы «кальций — кальмодулин» сопровождается усилением деструктивных процессов в клетке при воспалении [20, 49]. Возможно, это послужило поводом для оценки роли кальция при системной воспалительной реакции и сепсисе и обусловило появление прокальцитонинового теста.
Интегральное выражение нарушений в обмене кальция хорошо показано на примере гипоксии миокарда, которая прежде всего проявляется патологией митохондрий [20, 24]. Следует отметить, что повреждение мембран митохондрий является ключом к любому клеточному повреждению [20]. В его прогрессировании важная роль принадлежит нарушению контроля уровня кальция в цитоплазме. Ишемическое повреждение митохондрий приводит к нарушению функции Na+-К+-АТФазного насоса, постепенному накоплению в клетке натрия и потере ею калия, что в совокупности ведет к вытеснению Са2+ из митохондрий [22]. В результате повышается уровень ионизированного кальция в цитоплазме и увеличивается его связь с кальмодулином, что, в свою очередь, приводит к расхождению клеточных стыков, активации фосфолипаз. Эндоплазматическая сеть накапливает воду и ионы, следствием чего является развитие гидропической дистрофии. Усиление гликолиза сопровождается истощением гликогена, накоплением лактата и снижением рН [20, 24]. Таким образом, накопление Са2+ в клетке можно считать универсальным механизмом клеточной деструкции [46]. В данном случае совершенно логично встает вопрос: нужен ли кальций в растворах для программ интенсивной терапии критических состояний? При этом странно, что поступление ионов и катионов через мембрану клетки и в митохондрии ни у кого не вызывает сомнений, а проникновение через мембрану митохондрии молекулы сукцината вызывает всеобщее сомнение! Ведь каким-то образом она там продуцируется в физиологических условиях?
Уровень свободного кальция, являющегося универсальным внутриклеточным мессенджером, в клетках низок и контролируется специальными транспортными системами [44]. Поступление этого катиона в цитоплазму осуществляется по градиенту концентрации через селективные каналы из внеклеточного пространства и внутриклеточных депо (саркоплазматического и эндоплазматического ретикулума, а также митохондрий) [22, 44]. Практически всегда при гиперергическом течении воспалительного процесса наблюдается значительное увеличение содержания кальция в цитозоле и повышение концентрации комплекса «кальций — кальмодулин» [20, 46, 49]. В связи с вышеизложенным совершенно логично возникает сомнение в обоснованности присутствия кальция в растворах для инфузионной терапии, и с учетом данных табл. 1 можно констатировать некоторое преимущество реамберина. Если сравнивать состав растворов, можно сказать, что преимуществ в плане влияния на ионный состав плазмы у стерофундина нет, а по количеству анионов, метаболизирующихся до HCO3–, у реамберина явное преимущество.
Как уже отмечено, проблема коррекции гипо–ксии на уровне тканей решается с учетом понимания механизмов каскада событий, происходящих на фоне расстройства кровообращения и сниженной доставки кислорода. Каскад (или поступательность) биохимических трансформаций, обусловливающих логический порядок цепи патофизиологических событий, выглядит следующим образом: гипоксия на уровне тканей (как следствие гипоперфузии и сниженной доставки кислорода); развитие клеточного энергетического дефицита (как следствие активации анаэробного гликолиза); расстройства окислительного фосфорилирования (как следствие дефицита энергетического субстрата для окисления); ацидоз (как следствие накопления кислых продуктов и отсутствия путей их выведения) и как финал — клеточная деструкция [8].
При критических состояниях (например, шок) решение вопроса доставки кислорода за счет восполнения объема циркулирующей крови, увеличения числа носителей (эритроцитов), увеличения содержания и напряжения кислорода в крови (ИВЛ, ГБО) не решает проблему в целом, так как для усвоения кислорода на уровне дыхательной цепи митохондрий нужна энергия. При критических состояниях дефицит клеточной энергии крайне высок, так как практически полностью истощен и нет резервов для его компенсации [43]. Энергетический резерв нейронов обеспечивает нормальное функционирование чуть больше минуты, а энергетический резерв миокарда — еще меньше [46]. Каков энергетический дефицит на уровне клетки, например, при септическом шоке, сказать трудно, но можно предположить, так как процессы жизнедеятельности бактериальной флоры — это тоже энергозависимые процессы. И чем выше вирулентность микроорганизма, тем выше его энергетический потенциал, а на вершине — бактерия чумы.
Без кислорода не будет энергии, но и без энергии не усвоится кислород. Почему? Потому что развитие гипоксии, по современному взгляду на этот патофизиологический процесс, начинается с активации индуцируемого гипоксией фактора (hypoxia inducible factor, HIF), которая происходит только в ответ на дефицит энергетического субстрата в виде сигнальной молекулы сукцината, основного субстрата II комплекса дыхательной цепи митохондрий [37, 43]. Таким образом, гипо–ксия — это энергозависимое состояние. С 2004 года это аксиома из области фундаментальных наук, но именно она оспаривается чаще всего.
Исследования показали, что глобальная и тканеспецифическая доставка кислорода сохраняется в период гипоксии, в частности за счет увеличения системного поиска и потребления кислорода [31]. Этот механизм очень важен для органов с высоким базальным извлечением кислорода, таких как сердце и мозг, и больше зависит от увеличения притока крови в соответствии с повышенным потреблением кислорода во время гипоксии. Экспериментально установлено, что извлечение резервов кислорода в головном мозге увеличивается примерно с 30 % на начальном этапе до 50 % с прогрессированием гипоксии [31].
Но интенсивное извлечение кислорода зависит от трех важных факторов. Во-первых, при гипо–ксии происходит сдвиг вправо кривой диссоциации оксигемоглобина с целью снизить сродство гемоглобина к кислороду в условиях низкого рН, увеличенного синтеза 2,3-дифосфоглицерата (2,3-ДФГ) и NO-опосредованных сигнальных событий [5]. Во-вторых, повышение скорости кровотока в тканях способствует увеличению диффузии кислорода [5]. И в-третьих, при гипоксии увеличивается сеть капилляров, что позволяет сократить путь кислорода до клетки [5]. Основная цель сочетания этих трудоемких механизмов — облегчение диффузии кислорода из микроциркуляторного русла в тканях для поддержания митохондриального окислительного фосфорилирования (аэробного дыхания). Нам на первом курсе рассказывают о цикле Кребса, мы в него свято верим, но после шестого курса мы ему не доверяем! HIF тесно связан с работой цикла Кребса, и это еще одна аксиома: при любой гипоксии всегда есть дефицит сукцината.
Таким образом, если ацетат, малат, фумарат в составе сбалансированных инфузионных растворов смогут способствовать решению всех трех вышеозначенных задач путем устранения гиповолемии и ацидоза, то цель не будет достигнута, так как проблема гипоксии не может быть решена без обес–печения энергетического субстрата, способного вернуть процессы окисления в клетке на привычный аэробный путь. Все дело в том, что ни ацетат, ни малат, ни фумарат не заменят сукцинат в цикле Кребса, тем более в виде субстрата II комплекса дыхательной цепи митохондрий [5].
Восстановление привычного аэробного окисления так или иначе происходит путем реперфузии и реоксигенации, и обойти эти процессы у пациентов в критическом состоянии просто невозможно [4, 6]. Парадоксы реперфузии (кислородный, ионный, кальциевый) требуют своевременной коррекции. В том случае, если кислородный и ионный баланс могут быть скорригированы стерофундином, кальциевый будет прогрессировать, а значит, клетки (в первую очередь нейроны и миокардиоциты) будут перегружаться кальцием [22, 45]. При восстановлении кровотока кальций входит в клетку и оказывает разрушающее действие на рибосомы, при этом нарушается продукция белка и АТФ [30]. Кальций способствует возникновению вазоспазма, активирует образование медиаторов, что приводит к еще большим расстройствам микроциркуляции (гипоксия прогрессирует), нарушает проницаемость мембран [48]. Перегрузка кардиомиоцитов ионами кальция в значительной степени ответственна за повреждение митохондрий в ишемизированном миокарде. Снижение количества кальция, поступающего к сократительной системе, приводит к уменьшению расщепления АТФ, расхода энергии на сокращение и потребности миокарда в кислороде. В условиях ишемии и гипоксии миокарда показано назначение блокаторов кальциевых каналов (клетке не нужен кальций), которые, предотвращая перегрузку кальцием, оказывают защитное действие на миокард — предупреждают функциональные и структурные повреждения кардиомиоцитов [25]. Таким образом, вновь возникают сомнения в целесообразности включения кальция в состав инфузионных растворов.
Но очень важно, что кислородный парадокс тесно связан с кальциевым парадоксом, поскольку захват ионов кальция митохондриями происходит с участием кислорода [5, 6]. В период реперфузии поступающий в ишемизированный миокард молекулярный кислород окисляется с образованием таких мощных оксидантов, как супероксидные анионы, гидроксильные радикалы и пероксинитрит, способных приводить к развитию повреждений кардиомиоцитов [25]. Образовавшиеся свободные радикалы, вступая в реакции с полиненасыщенными жирными кислотами, приводят к возникновению перекисей и гидроперекисей липидов, которые, в свою очередь, вызывают повреждения сарколеммы и нарушают функцию трансмембранных ионных каналов, ответственных за формирование потенциалов покоя и действия кардиомиоцитов [20, 46]. В экспериментальных работах показано, что репер–фузионные повреждения клеточных мембран, обу–словленные свободными радикалами, возникают через 5–10 минут после начала реперфузии [13, 30, 48]. Решает ли эту проблему стерофундин? Вряд ли, так как он содержит кальций.
В отличие от стерофундина реамберин и ремаксол кальций не содержат. Возможно, это и обу–словливает достаточный уровень кардиопротекции, гепатопротекции, подтвержденный большим числом как экспериментальных, так и клинических исследований [1], чего, к сожалению, нельзя сказать о стерофундине, так как о его кардио- или гепатопротекции данных в доступной литературе нет.
К сожалению, в настоящее время цикл трикарбоновых кислот не рассматривается в качестве главного пути энергопродукции в критических состояниях. Даже умеренная «рабочая» функциональная гипоксия блокирует возможность высвобождения водорода в НАД-зависимых ферментах. При дальнейших усилиях в этом плане биоэнергетика не только не возрастает, но даже блокирует всю цепь цикла трикарбоновых кислот и ведет к активации процессов гликолиза. Только окисление янтарной кислоты в дыхательной цепи цикла трикарбоновых кислот не находится в зависимости от посредника НАД-зависимых ферментов. Исследование активности ключевых ферментов клеточного энергетического обмена — НАДН-дегидрогеназ электрон-транспортных цепей и сукцинатдегидрогеназы — в разных структурах головного мозга у животных показало, что находящийся в разном физиологическом состоянии (норма и стресс) стресслимитирующий эффект обнаруживается по показателю активности сукцинатдегидрогеназы [1, 43]. Есть субстрат — будет работать и фермент!
При стресс-реакциях и при разного рода экстремальных состояниях в организме возникают определенные условия нейрохимической регуляции, которые позволяют янтарной кислоте монополизировать дыхательную цепь по отношению к другим НАД-зависимым субстратам окисления [7, 13]. При этом массированный выброс адренергических гормонов-медиаторов обеспечивает мощное усиление эффективности функционирования дыхательной цепи, которое более чем на порядок может превосходить окисление субстратов в цикле трикарбоновых кислот, но при значительно меньших потребностях в кислороде [14, 17].
Практически каждый номер любого зарубежного биохимического журнала включает статью о дефиците при различной патологии (особенно онкологии) сукцинатдегидрогеназы (на сегодня более 15 тысяч публикаций) — фермента, катализирующего синтез энергии [39]. Есть различные варианты обеспечения фермента субстратом (мексикор, фасудил, рибофлавин, метапролола суксинат, токоферола сукцинат), чтобы он функционировал в физиологических рамках, и один из них — введение чистого субстрата при его дефиците, что делается и за рубежом [19, 28, 31]. В противном случае не избежать мутации фермента, то есть перестройки функционирования в новых условиях, о чем в последнее время много пишут в зарубежных журналах [29, 33, 34, 40, 42]. И это совершенно ясно: фермент найдет себе деятельность в новых условиях.
В заключение можно констатировать, что нормальная жизнедеятельность человека зиждется на функционировании цикла трикарбоновых кислот, который обеспечивает организм необходимым количеством энергии в присутствии достаточного количества кислорода. И если в условиях гипоперфузии и гипоксии создается дефицит энергетического потенциала в клетке, которая тратит субстрат для энергии в больших количествах, то неким элементом протезирования энергетического дефицита при любом критическом состоянии должно являться введение сукцината для нормального функционирования цикла Кребса. Да, наука реаниматология — вещь очень консервативная, и на данном этапе многие специалисты недооценивают роль энергокоррекции. Когда возникает острая дыхательная недостаточность, мы переводим пациента на искусственную вентиляцию легких, но когда у него развивается энергодефицит, мы его не корригируем. Мы вводим энергетические субстраты (парентеральное и энтеральное питание), но забываем, что для усвоения введенных жиров, белков и углеводов тоже нужно затратить энергию. Но где ее взять, вот в чем вопрос. Вышеизложенные размышления и данные фундаментальных исследований дают право утверждать, что энергопротекция — это прогрессивное направление и за сукцинатами будущее.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Афанасьев В.В. Клиническая фармакология реамберина [электронный ресурс]. Реамберин. Реальная реанимация. Сбалансированная активная детоксикация. http://www.reambenn.ru/index. php?p = v_3-1-1#3.
2. Гаин Ю.М., Алексеев С.А., Шахрай С.В., Богдан В.Г. Реамберин в комплексном лечении больных с тяжелой интраабдоминальной инфекцией // Вестник СПбГМА им. И.И. Мечникова. — 2005. — № 1. — С. 145-150.
3. Галушка С.В., Назаров Б.Ф., Власенко А.В. Применение растворов гидроксиэтилкрахмала и реамберина в комплексном лечении тяжелого гестоза // Анестезиол. и реаниматол. — 2004. — № 6. — С. 44-47.
4. Голубев А.М., Мороз В.В., Кузовлев А.Н., Сундуков Д.В. Значение ишемии-реперфузии в развитии острого повреждения легких (обзор) // Общ. реаниматол. — 2007. — Т. 3, № 3. — С. 107-113.
5. Зайчик А.Ш., Чурилов Л.П. Основы патохимии: Учебник для студентов медицинских вузов. — СПб.: ЭЛБИ, 2001. — 677 с.
6. Зильбер А.П. Этюды критической медицины. Книга 1. Общие проблемы. Медицина критических состояний. — Петро–заводск, 1995. — 360 с.
7. Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г. Реамберин в терапии критических состояний: Руководство для врачей. — СПб.: Минимакс, 2001. — 156 с.
8. Лукьянова Л.Д. Современные проблемы адаптации к гипоксии. Сигнальные механизмы и их роль в системной регуляции // Патол. физиол. и эксперим. терапия. — 2011. — № 1. — С. 3-19.
9. Македонская О.Г., Зорькина А.В., Бякин С.П. Способ получения гемодиализирующего раствора для бикарбонатного гемодиализа. Патент РФ на изобретение № 2435567 от 16.02.2010 г.
10. Македонская О.Г., Зорькина А.В., Бякин С.П. Способ консервирования донорской крови. Патент РФ № 2410103 от 27.01.2011.
11. Мамцис А.М., Николаева В.В., Андреев С.М. и соавт. Способ выделения белков и нуклеиновых кислот из белково-нуклеиновых смесей. Патент № 888909. Гос. комитет СССР по делам изобретений и открытий. 15.12.81.
12. Мартинов А.В., Черних В.П. Хiмічна модифiкацiя високомолекулярних лікарських засобiв — продуктів бiотехнологій як iнструмент тонкого впливу на фармакологічнi властивостi // Клін. фармація. — 2002. — Т. 6, № 3. — С. 3-8.
13. Мартынюк В.C., Ислямов Р.И. Влияние комбинированного действия слабого низкочастотного магнитного поля и гипокинезии на активность НАДН-дегидрогеназы в различных отделах головного мозга крыс // Физика живого. — 2009. — Т. 17, № 2. — С. 89-93.
14. Рогаткин С.О., Людковская Е.В., Володин Н.Н. Лечение детей, перенесших перинатальную гипоксию в периоде ранней адаптации // Вопр. гинекол., акушерства и перинатол. — 2005. — Т. 3, № 10. — С. 37-43.
15. Романцов М.Г., Коваленко А.Л. Реамберин в клинической практике: Метод. рек. — СПб., 2008.
16. Смирнов А.В., Нестерова О.Б., Голубев Р.В. и соавт. Кардиопротективные эффекты сукцинатсодержащего диализирующего раствора // Нефрология. — 2012. — Т. 16, № 2. — С. 69-78.
17. Сухоруков В.С., Николаева Е.А. Нарушения клеточного энергообмена у детей. — М.: АТЕS medica soft, 2004. — 79 с.
18. Anastasopoulos D., Kefaliakos A., Michalopoulos A. Is plasma calcium concentration implicated in the development of critical illness polyneuropathy and myopathy? // Crit. Care. — 2011. — Vol. 15 (5). — P. R247.
19. Attali V., Parnes M., Ariav Y. et al. Regulation of insulin secretion and proinsulin biosynthesis by succinate // Endocrino–logy. — 2006. — Vol. 147 (11). — P. 5110-5118.
20. Ayoub I.M., Radhakrishnan J., Gazmuri R.J. Targeting mitochondria for resuscitation from cardiac arrest // Crit. Care Med. — 2008. — Vol. 36 (11 Suppl.). — P. S440-S446.
21. Bayer O., Reinhart K., Kohl M. et al. Effects of fluid resuscitation with synthetic colloids or crystalloids alone on shock reversal, fluid balance, and patient outcomes in patients with severe sepsis: a prospective sequential analysis // Crit. Care. Med. — 2012. — Vol. 40 (9). — P. 2543-2551.
22. C'ioffii D.L., Stevens T. Regulation of endothelial cell barrier function by store-operated calcium entry 11 // Microcirculation. — 2006. — Vol. 13 (8). — P. 709-723.
23. De Lutio O., Quarta A. Sterofundin R I as a plasma substitute // Arch. Ortop. — 1958. — Vol. 71 (3). — P. 354-367.
24. Duncan D.J., Yang Z., Hopkins P.M. et al. TNF-alpha and IL-1beta increase Ca2+ leak from the sarcoplasmic reticulum and susceptibility to arrhythmia in rat ventricular myocytes // Cell. Calcium. — 2010. — Vol. 47 (4). — P. 378-386.
25. Ferrari R. Major difference among three classes of cal–cium antagonists // Eur. Heart J. — 1997. — Vol. 18 (Suppl. A). — P. A56-A70.
26. Hartmann A.F., Erganian J. Treatment of diabetic acidosis // J. Pediatr. — 1947. — Vol. 31 (3). — P. 274-299.
27. Hartmann A.F., Senn M.J. Studies in the metabolism of sodium r-lactate. Response of normal human subjects to the intra venous injection of sodium r-lactate // J. Clin. Invest. — 1932. — Vol. 11 (2). — P. 327-335.
28. http://www.ncbi.nlm.nih.gov/pubmed.
29. Jain-Ghai S., Cameron J.M., Al Maawali A. et al. Comp–lex II deficiency — a case report and review of the lite–rature // Am. J. Med. Genet. A. — 2013. — Vol. 161A (2). — P. 285-294.
30. Khanna А. Intestinal and hemodynamic impairment following mesenteric ischemia-reperfusion // J. Surg. Res. — 2001. — Vol. 99 (1). — P. 114-117.
31. Koivunen P., Hirsila M., Remes A.M. Inhibition of hypoxia-inducible factor (HIF) hydroxylases by citric acid cycle intermediates: possible links between cell metabolism and stabilization of HIF // J. Biol. Chem. — 2007. — Vol. 282 (7). — P. 4524-4532.
32. Lang F., Hoffmann E.K. Role of ion transport in control of apoptotic cell death // Compr. Physiol. — 2012. — Vol. 2 (3). — P. 2037-2061.
33. Liu Y.P., Ma Y.Y., Wu T.F. et al. Mitochondrial respiratory chain complex I deficiency due to 10191T > C mutation in ND3 gene // Zhongguo Dang Dai Er Ke Za Zhi. — 2012. — Vol. 14 (8). — P. 561-566.
34. Ma Y.Y. Two compound frame-shift mutations in succinate dehydrogenase gene of a Chinese boy with encephalopathy // Brain Dev. — 2013 Jul 9. pii: S0387-7604 (13) 00193-9. doi: 10.1016/j. braindev.2013.06.003. [Epub ahead of print].
35. Magier Z., Jarzyna R. The role of glucose transporters in human metabolic regulation // Postepy Biochem. — 2013. — Vol. 59 (1). — P. 70-82.
36. Montupil J., Vincent J.L. Magnesium in critical care and anesthesiology // Rev. Med. Brux. — 2012. — Vol. 33 (5). — P. 466-474.
37. Nikam A., Patankar J.V., Lackner C. et al. Transition between acute and chronic hepatotoxicity in mice is associated with impaired energy metabolism and induction of mitochondrial heme oxygenase-1 // PLoS One. — 2013. — Vol. 8 (6). — P. e66094.
38. Perel P., Roberts I., Ker K. Colloids versus crystalloids for fluid resuscitation in critically ill patients // Cochrane Database Syst. Rev. — 2013 Feb. 28. — 2: CD000567.
39. Pistollato F., Abbadi S., Rampazzo E. et al. Hypoxia and succinate antagonize 2-deox-yglucose effects on glioblastoma // Biochem. Pharmacol. — 2010. — Vol. 80 (10). — P. 1517-1527.
40. Rudiger A., Singer M. The heart in sepsis: from basic mechanisms to clinical management // Curr. Vasc. Pharmacol. — 2013. — Vol. 11 (2). — P. 187-195.
41. Samapati R., Yang Y., Yin J. et al. Lung endothelial Ca2+ and permeability response to platelet-activating factor is mediated by acid sphingomyelinase and transient receptor potential classical 6 // Am. J. Respir. Crit. Care Med. — 2012. — Vol. 185 (2). — P. 160-170.
42. Singhvi G., Ukawala R., Dhoot H., Jain S. Design and characterization of controlled release tablet of metoprolol // J. Pharm. Bio-allied. Sci. — 2012. — Vol. 4 (Suppl 1). — P. S90-S91.
43. Tannahill G.M., Curtis A.M., Adamik J. et al. Succinate is an inflammatory signal that induces IL-1e through HIF-1a // Nature. — 2013. — Vol. 496 (7444). — P. 238-242.
44. Tong G.M., Rude R.K. Magnesium deficiency in critical illness // J. Intensive Care Med. — 2005. — Vol. 20 (1). — P. 3-17.
45. Wei H., Xie Z. Anesthesia, calcium homeostasis and Alzheimer's disease // Curr. Alzheimer Res. — 2009. — Vol. 6 (1). — P. 30-35.
46. White D.J., Maass D.L., Sanders B., Horton J.W. Cardiomyocyte intracellular calcium and cardiac dysfunction after burn trauma // Crit. Care Med. — 2002. — Vol. 30 (1). — P. 14-22.
47. Xia M., Liu H., Li Y. et al. The mechanism of Na (+) / K (+) selectivity in mammalian voltage-gated sodium channels based on molecular dynamics simulation // Biophys. J. — 2013. — Vol. 104 (11). — P. 2401-2409.
48. Yang J.C. Multiple organ injury at early stage of intestinal and hepatic ischemia-reperfusion in rats // Di. Yi. Jun. Xue. Xue. Bac. — 2004. — Vol. 24 (2). — P. 198-200.
49. Zhu X., Bernecker O.Y., Manohar N.S. et al. Increased leakage of sarcoplasmic reticulum Ca2+ contributes to abnormal myocyte Ca2+ handling and shortening in sepsis // Crit. Care Med. — 2005. — Vol. 33 (3). — P. 598-604.

/124-131/125-1.jpg)
/124-131/126-1.jpg)