Боль как неприятное ощущение с негативными эмоциональными переживаниями в своей жизни испытывал практически каждый человек. Часто она выполняет сигнальную функцию, предупреждает организм об опасности и защищает его от возможных чрезмерных повреждений. Такую боль называют физиологической. Восприятие, проведение и анализ болевых сигналов в организме обеспечивают специальные нейрональные структуры ноцицептивной системы, входящие в состав соматосенсорного анализатора, поэтому боль можно рассматривать как одну из сенсорных модальностей, необходимую для нормальной жизнедеятельности, предупреждающую нас об агрессивных воздействиях.
Существует и другая боль, которая имеет патогенное значение для организма, приводит к нетрудоспособности, снижает активность, вызывает психоэмоциональные расстройства, регионарные и системные нарушения микроциркуляции, является причиной вторичных иммунных депрессий и нарушений деятельности висцеральных систем. Такую боль называют патологической. В биологическом смысле она представляет опасность для организма, вызывая целый комплекс дезадаптивных реакций [1].
Боль всегда субъективна, ее конечная оценка определяется местом и характером нарушения, природой повреждающего фактора, психологическим состоянием человека и его индивидуальным жизненным опытом. Боль — одна из самых распространенных жалоб, заставляющая больного обращаться к врачу и почти всегда свидетельствующая о наличии патологического процесса. Согласно определению Международной ассоциации по исследованию боли (IASP — International Association for the Study of Pain), боль — это неприятное ощущение и эмоциональное переживание, связанное с текущим или потенциальным тканевым повреждением или описываемое в терминах такого повреждения [2].
Традиционно по временным параметрам боль разделяют на острую и хроническую. Острая боль связана с активацией болевых рецепторов (ноцицепторов) после тканевого повреждения, соответствует степени тканевого повреждения и длительности действия повреждающих факторов, полностью регрессируя после заживления. В противоположность острым болям неприятные сенсорные ощущения могут сохраняться или появляться после заживления, не неся в этом случае защитной функции, а являясь причиной страдания. Появление таких болей обычно связано с поражением периферической или центральной нервной системы, и они относятся к хроническим. Хроническая боль рассматривается как боль, которая «оторвалась» от основного заболевания и приобрела «надорганный» характер. Международная ассоциация по изучению боли определяет хроническую боль как «боль, которая продолжается сверх нормального периода заживления», со сроком существования не менее 3 месяцев [3]. Статистические данные, предоставленные IASP (2005), свидетельствуют, что более 20 % взрослого населения Европы испытывает хроническую боль. При этом 19 % больных отмечают, что хронический болевой синдром существенно нарушает их обычную жизнь, приводит к снижению или утрате работоспособности. Около 35 % пациентов испытывают боль ежедневно, а у 16 % она настолько сильна, что вызывает появление суицидальных мыслей [6].
Место нестероидных противовоспалительных препаратов в лечении острой и контроле хронической боли
Наиболее популярной группой лекарственных средств, применяемых в качестве анальгетиков, особенно в тех ситуациях, когда патогенез боли определяется повреждением или воспалением ткани, являются нестероидные противовоспалительные препараты (НПВП). Хорошо доказанная эффективность, предсказуемость фармакологического действия, удобство применения и финансовая доступность НПВП по достоинству оценены современной медициной [7, 8].
НПВП широко используются во всех сферах медицины. Без них не обходится купирование острой боли в хирургической практике, травматологии, при лор-заболеваниях; они являются средством выбора для купирования желчной и почечной колики, головной и зубной боли, облегчения дисменореи [7, 8].
Однако данной группе препаратов свойственны недостатки, снижающие их терапевтические достоинства, — это опасность развития класс-специфических побочных эффектов. И в первую очередь — патологии верхних отделов желудочно-кишечного тракта (ЖКТ), характеризующейся наличием эрозий, язв и гастроинтестинальных катастроф — кровотечения и перфорации (НПВП-гастропатия). Риск появления данных осложнений у лиц, регулярно принимающих НПВП, возрастает по сравнению с популяцией более чем в 4 раза и составляет примерно 0,5–1 эпизод на 100 пациентов в год. Пациенты, регулярно принимающие НПВП, погибают от подобных осложнений в 2–3 раза чаще, чем люди, не получающие каких-либо НПВП [9, 10].
Второй проблемой, связанной с использованием НПВП, является опасность развития класс-специфических осложнений со стороны сердечно-сосудистой системы. К ним относятся дестабилизация артериальной гипертензии (АГ), прогрессирование сердечной недостаточности и повышение риска кардиоваскулярных катастроф, прежде всего инфаркта миокарда и ишемического инсульта [10].
К сожалению, использование новых НПВП — селективных ингибиторов циклооксигеназы-2 (ЦОГ-2), демонстрирующих существенно лучшую переносимость в отношении ЖКТ, не позволяет уменьшить опасность осложнений со стороны сердечно-сосудистой системы [10]. Так, в настоящее время не вызывает сомнений, что прием как неселективных, так и селективных НПВП может приводить к дестабилизации имеющейся АГ [10–12]. A. Johnson и соавт. [12], проведя метаанализ 50 исследований, показали, что прием НПВП приводит к повышению АД в среднем на 5 мм рт.ст. Этот эффект был более выражен у больных, страдающих АГ [12]. Результаты рандомизированных клинических исследований (РКИ) показывают, что индометацин, пироксикам и напроксен в средних дозах и ибупрофен в высокой дозе способны снижать эффективность β-блокаторов, диуретиков, ингибиторов ангиотензинпревращающего фермента (АПФ). В меньшей степени они влияют на лечебный потенциал антагонистов кальция [10, 13]. Важно отметить, что селективные НПВП также негативно влияют на АГ. По данным метаанализа T-J. Aw [14], высокоселективные НПВП (коксибы) повышают систолическое и диастолическое артериальное давление (АД), так же как и традиционные препараты.
Также коксибы, селективно блокируя ЦОГ-2, способны нарушать баланс факторов, влияющих на свертывание крови, — синтез тромбоксана А2 и простациклина, что определяет их протромботический эффект. У пациентов с болезнями сердечно-сосудистой системы это чревато повышением риска тромбоэмболических осложнений, таких как инфаркт миокарда и ишемический инсульт [8].
Эта проблема возродила интерес практикующих врачей к традиционным НПВП, применение которых ассоциируется с существенно меньшей опасностью кардиоваскулярных осложнений.
Кетопрофен: рацемическая смесь R- и S-изомеров. Особенности фармакокинетики и фармакодинамики
Кетопрофен — нестероидный противовоспалительный препарат из группы производных пропионовой кислоты, обладающий обезболивающим, противовоспалительным и жаропонижающим эффектом. Он представляет собой рацемическую смесь R- и S-изомеров. Одно время считалось, что анальгезирующим эффектом обладает только правовращающий S-изомер, тогда как левовращающий изомер — просто бесполезный компонент, который можно устранить без последствий для эффективности средства. Однако в последующем в ходе крупных исследований (Veys E.M., 1991) было установлено, что R-изомер усиливает обезболивающее действие S-изомера [47].
Известно, что фактор некроза опухоли (TNF) и интерлейкин-8 (IL-8) индуцируют боль посредством ЦОГ-независимых механизмов. В исследовании, проведенном в 1998 г. P. Ghezzi и соавт., была изучена способность R- и S-изомеров кетопрофена модулировать уровень провоспалительных цитокинов. В результате установлено, что правовращающий изомер эффективно уменьшал отек, вызываемый введением каррагинана, но при этом усиливал выделение провоспалительных цитокинов TNF и IL-1. В свою очередь, усиление продукции последних ослабляет обезболивающий эффект S-кетопрофена и повышает риск повреждения слизистой оболочки желудка. Тогда как R-изомер не провоцирует синтез провоспалительных цитокинов и усиливает противовоспалительную активность рацемата [47].
О собственной анальгезирующей активности левовращающего стереоизомера кетопрофена свидетельствуют и результаты двойного слепого рандомизированного исследования, проведенного S. A. Cooper (1998) с участием 177 пациентов [47]. В нем сравнивалась анальгетическая эффективность и безопасность левовращающего изомера кетопрофена (25 мг), левовращающего изомера кетопрофена (100 мг), парацетамола (1000 мг) и плацебо при их однократном пероральном применении в случае умеренной или выраженной боли, возникшей после удаления третьих моляров. И левовращающий изомер кетопрофена в дозе 100 мг, и парацетамол в дозе 1000 мг по всем показателям анальгезирующей активности статистически значимо превысили плацебо. Авторы пришли к выводу, что результативность приема левовращающего изомера кетопрофена (100 мг) и парацетамола (1000 мг) была статистически сопоставима. То есть оба изомера кетопрофена вносят вклад в эффективность препарата.
Что касается профиля безопасности этих изомеров, то в проведенном Т. Р. Jerussi (1998) рандомизированном плацебо-контролируемом исследовании с участием 72 здоровых добровольцев было показано, что S-кетопрофен, использовавшийся в той же дозе, что и рацемическая смесь кетопрофена (100 мг 2 р/день), чаще вызывал кровоизлияния и эрозии в гастродуоденальной зоне [47]. Полученные результаты позволяют предположить, что повышенный риск повреждения слизистой оболочки желудка и двенадцатиперстной кишки, установленный для рацемической смеси кетопрофена, обусловлен именно S-изомером — декскетопрофеном.
Систематический обзор исследований с кетопрофеном и декскетопрофеном, проведенный экспертами Кокрановского сотрудничества в 2009 г., выявил преимущество рацемического препарата в отношении такого важного показателя, как NNT (number need to treat). А объяснение этим результатам было получено еще в 1990-х годах в исследованиях, показавших, что R-изомер (левокетопрофен) является не балластом, а фармакологически активным компонентом рацемического препарата, обладающим собственным мощным обезболивающим действием и при этом не вызывающим нежелательного повышения уровней других, не связанных с ЦОГ провоспалительных цитокинов [47].
Таким образом, именно наличие двух изомеров –обеспечивает не только высокую эффективность кетопрофена, но и ЖКТ-безопасность.
Анальгетическое действие кетопрофена проявляется уже через 30 мин после первого приема (статистически значимое по сравнению с плацебо) и продолжается до 6 часов, что экономически выгодно при непродолжительных хирургических вмешательствах [51]. Он обладает очень коротким Т1/2 (1–2 часа) и быстро выводится из организма. Это снижает риск его аккумуляции даже у больных пожилого возраста с нарушением функции печени и почек. Действительно, в специальных исследованиях не было обнаружено выраженных фармакокинетических различий при назначении кетопрофена больным с заболеваниями суставов молодого и пожилого возраста, а его хорошая переносимость лицами пожилого возраста подтверждена в серии специальных клинических исследований [17, 18].
Важное значение имеет тот факт, что кетопрофен не оказывает существенного влияния на синтез протеогликана хондроцитами кролика и человека in vitro и in vivo и, следовательно, может рассматриваться как хондронейтральный препарат [19]. Это свидетельствует о том, что применение кетопрофена у больных дегенеративными заболеваниями суставов более предпочтительно, чем некоторых других НПВП. Кетопрофен не обнаруживает значимых лекарственных взаимодействий с антацидами и блокаторами Н2-рецепторов, непрямыми антикоагулянтами, антидиабетическими средствами и метотрексатом. Особый интерес представляет исследование кетопрофена R.M. van Solingen et al. (2001), в котором было показано отсутствие у данного препарата ингибирующего действия на аспиринзависимое подавление агрегации тромбоцитов [20], что свидетельствует об определенном кардиопротективном эффекте и низком риске кардиоваскулярных осложнений [21].
Основной механизм обезболивающего действия кетопрофена — ингибиция циклооксигеназы, а значит, снижение выработки простагландина Е2 (ПГЕ2). Помимо своего воздействия на ЦОГ кетопрофен ингибирует липооксигеназный путь прохождения каскада арахидоновой кислоты, ведущий к снижению синтеза лейкотриенов. Стоит отметить, что кетопрофен оказывает как периферическое, так и центральное действие [15] благодаря ингибиции биосинтеза ПГЕ2. При этом происходит ингибиция и синтазы оксида азота, и ЦОГ в головном мозге. Таким образом, кетопрофен легко и быстро проникает в центральную нервную систему, проходя гематоэнцефалический барьер в течение 15 мин (благодаря высокому уровню липофильности). Недавно специалисты продемонстрировали, что кетопрофен взаимодействует с системой 5-НТ-рецепторов, препятствуя их раздражению алгогенными веществами, что является одним из объяснений более высокой эффективности данного препарата по сравнению с остальными НПВП [15].
Все эти свойства позволяют оценить кетопрофен как эффективный препарат для уменьшения симптомов боли при воспалении мышечно-скелетной системы, возникающих в условиях и острого, и хронического заболевания [20]. Это мощное и высокоэффективное средство для уменьшения боли при травмах, ортопедических и ревматических патологиях, послеоперационной боли. Кетопрофен включен во все европейские рекомендации и протоколы послеоперационного обез-боливания [54], лечения хронической тазовой боли, болей, вызванных метастазами опухолей [21].
Кетопрофен — препарат, появившийся в Европе в 1971 г. и с успехом применяющийся до настоящего времени, что объясняется благоприятным терапевтическим профилем и низкой частотой осложнений, даже у лиц пожилого возраста с кардиоваскулярными факторами риска, что подтверждено данными Комитета по контролю за безопасностью препаратов в Великобритании (1986) и США (1997) [23]. Среди других НПВП кетопрофен занимает третье место по общей безопасности и второе по наименьшей частоте смертельных побочных эффектов и поражений ЖКТ [24]. Эффективность препарата подтверждается огромной базой исследований, широким спектром показаний (по сути, все патологические процессы, сопровождающиеся ноцицептивной болью) и хорошей репутацией среди врачей [15].
Интерес к кетопрофену можно оценить по росту количества его назначений в странах Европы. Так, M. Venegoni и соавт. показали, что на фоне небольшого, но явного снижения общих продаж рецептурных НПВП в Италии за период с 2006 по 2009 г. популярность кетопрофена выросла почти в 2 раза (на 93 %). Если в 2006 г. кетопрофен приобрели 263 897 жителей этой страны, то в 2009 г. — уже 508 699 [25].
Опыт клинического применения кетопрофена для пре- и постоперационного обезболивания, в том числе после проведения ортопедических операций
В 2009 г. были опубликованы данные метаанализа Cochrane, оценивающего результаты однократного приема кетопрофена в дозе 25–100 мг при острой послеоперационной боли. Были проанализированы данные 14 рандомизированных контролируемых исследований (968 больных, получавших кетопрофен, 520 — плацебо), а основным критерием оценки было снижение боли > 50 % на срок от 4 до 6 часов. Исследователи использовали индекс NNT (number need to treat), показывающий число больных, которых необходимо пролечить для достижения значимого отличия от плацебо. Этот индекс составил 2,4–3,3, что показывает достаточно высокую эффективность препарата [26].
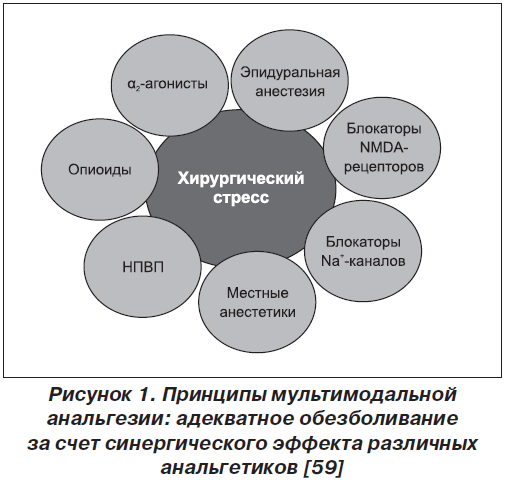
С 1971 г. кетопрофен успешно применяется в схемах сбалансированной пери- и послеоперационной мультимодальной анальгезии при проведении хирургических операций. Следует отметить, что основной задачей мультимодальной анальгезии является достижение адекватного обезболивания за счет синергического эффекта различных анальгетиков (рис. 1 [59]), что позволяет назначать их в минимальных дозах и снижать частоту проявления их побочных эффектов [46].
Рядом исследований показано, что при оперативных вмешательствах малой травматичности оптимальное обезболивание в 94,3 % случаев достигается монотерапией кетопрофеном в дозе 100 мг 2–3 раза в сутки, при операциях средней травматичности только в 20 % случаев на фоне анальгезии кетопрофеном была необходимость дополнительного применения трамадола. При оперативных вмешательствах высокой травматичности применение кетопрофена позволяло уменьшить дозу наркотических анальгетиков [22].
Работа S. Karvonen и соавт. является примером успешного применения кетопрофена в ортопедической хирургии. Здесь кетопрофен в дозе 300 мг/сут был использован у 60 больных, перенесших ортопедические операции. Контроль составили пациенты, получавшие плацебо или парацетамол 4 г/сутки. Критерием эффективности, кроме снижения выраженности боли, была оценка опиоидсберегающего действия, которое определялось при сравнении необходимой для стойкой анальгезии дозы фентанила. Этот эффект был отмечен лишь в группе кетопрофена: средняя доза фентанила здесь оказалась на 22 % меньше по сравнению с группой плацебо и на 28 % меньше в сравнении с группой парацетамола [27].
В исследовании Castagnera et al. (1988) у 60 пациентов, перенесших различные ортопедические операции (на позвоночнике, тазобедренном, коленном и голеностопном суставах), внутривенные инъекции кетопрофена в дозе 2,5 мг/кг начинали в момент появления болевых ощущений. Интенсивность боли оценивали по визуальной и вербальной аналоговым шкалам. Через 15 мин после введения препарата отмечалась редукция боли более чем на 50 %, а через 2 и 3 ч — на 85 % от исходных оценок по шкалам (р < 0,001). Пик противоболевого действия отмечался на 120-й минуте у пациентов, перенесших операции на коленном или тазобедренном суставах, и на 180-й минуте в подгруппах вертебральной хирургии и вмешательств на голеностопных суставах. Длительность анальгезии была сравнимой во всех группах — 8,5 ± 1,5 ч. Авторы исследования заключили, что кетопрофен эффективно и безопасно купирует послеоперационную боль при ортопедических вмешательствах за счет оптимального сочетания периферического и центрального компонентов анальгетического действия [15].
Manani et al. (1992) в плацебо-контролируемом исследовании с участием 75 пациентов, перенесших ортопедические вмешательства, сравнивали эффективность послеоперационного обезболивания внутримышечными инъекциями кетопрофена и напроксена в течение первых 4 ч от появления болевых ощущений. При неэффективности двух последовательных доз НПВП пациентам вводили морфин. В результате кетопрофен обеспечил более эффективную анальгезию, чем напроксен. В группе кетопрофена меньшей была потребность в повторном введении препарата и использовании морфина [15].
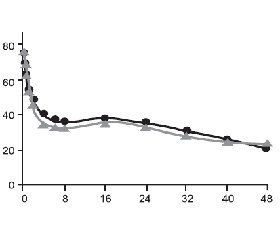
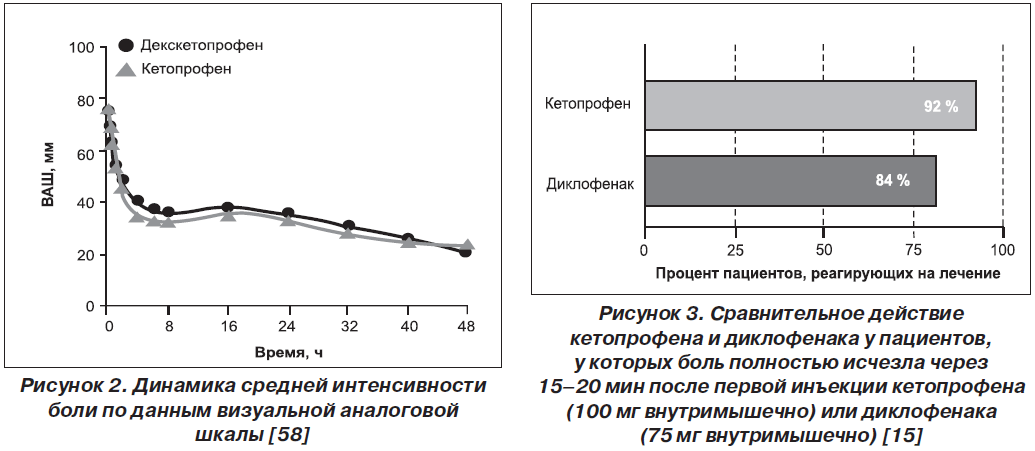
В рандомизированном двойном слепом параллельном исследовании, проведенном H. Zippel et al. (2006), оценивалась эффективность 100 мг кетопрофена и 50 мг декскетопрофена, вводимых внутривенно капельно на протяжении 2 дней 252 пациентам с послеоперационной болью после протезирования коленных и тазобедренных суставов. В качестве дополнительного средства облегчения боли использовали морфин или парацетамол. Оба режима терапии показали эквивалентную анальгетическую активность (рис. 2 [58]), требовали практически одинакового назначения резервных препаратов (в 81,3 и 87,1 % случаев соответственно) и имели идентичное количество нежелательных явлений [58].
В другом исследовании (Shah et al., 2003) сравнивались внутримышечные инъекции кетопрофена (100 мг 2 раза в сутки) и диклофенака (75 мг 2 раза в сутки). Обезболивающий эффект кетопрофена наступал раньше: через 15–20 мин у 92 % пациентов в сравнении с 84 % пациентов группы диклофенака. По длительности анальгезии кетопрофен также продемонстрировал преимущество перед диклофенаком, эффект одной дозы длился до 12 ч. Кроме того, в группе кетопрофена для достижения полного обезболивания реже требовалось присоединение морфина (рис. 3 [15]).
Хорошо зарекомендовал себя кетопрофен для предупреждающей анальгезии (preemptive) у больных, перенесших оперативное лечение варикозной болезни нижних конечностей [29]. Перед операцией пациенты получали 100 мг препарата внутримышечно, после операции в первые сутки — еще дважды по 100 мг, на вторые и третьи сутки — в суточной дозе 300 мг. Было показано, что болевой синдром при оценке по ВАШ через 4 часа после операции составил 2,38 ± 0,47 см, через 12 часов — 2,25 ± 0,43 см, через 48 часов —
1,50 ± 0,26 см [29].
Об эффективности применения кетопрофена по принципу предупреждающей анальгезии говорит и работа G. Boccara, который в 2005 г. на модели лапароскопической холецистэктомии показал, что пред-операционное введение кетопрофена обеспечивает лучшую анальгезию по сравнению с парацетамолом [30].
Кетопрофен как средство для пре- и постоперационного обезболивания включен в рекомендации по ведению постоперационной боли 2014 года [55].
Эффективность кетопрофена в травматологии
В двойном слепом клиническом исследовании по изучению воздействия кетопрофена в сравнении с плацебо [52], проведенном Fatti et al. (1991), приняли участие 120 пациентов с заболеваниями мягких тканей (тендинит, бурсит и периартрит). Результаты исследования показали значительное уменьшение ограничений, связанных с болью, функциональных нарушений и болезненной чувствительности к любому прикосновению, а также быстрое и выраженное уменьшение самой боли при назначении кетопрофена. Его обезболивающее действие стало значительным уже через 30 мин после приема (рис. 3 [15]). Также авторами была отмечена хорошая переносимость и безопасность препарата, эквивалентная плацебо.
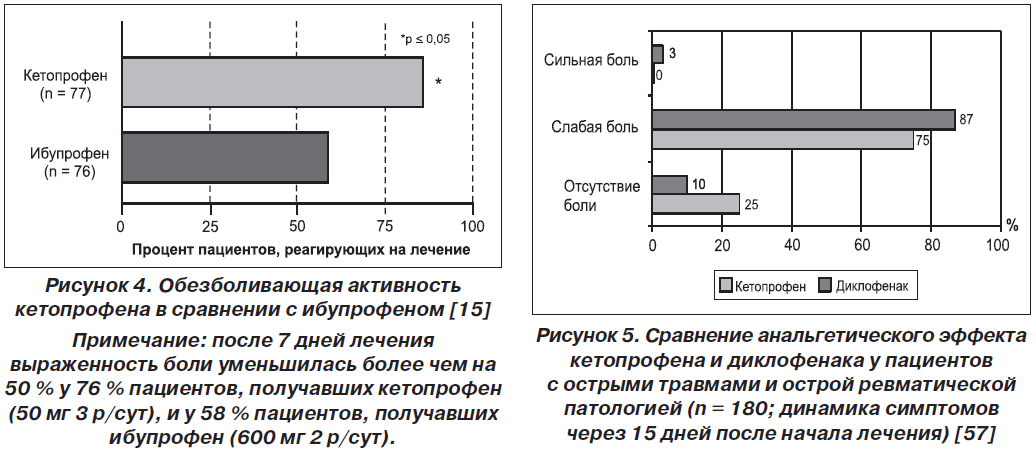
Сравнение обезболивающего эффекта кетопрофена и ибупрофена было проведено D. Robbins et al. (1990) в многоцентровом двойном слепом исследовании с участием 165 пациентов со спортивными травмами. У этих пациентов полученные травмы вызвали ряд болезненных поражений, таких как тендинит или теносиновит, эпикондилит, травматический бурсит, растяжение связок или ушиб.
Полученные результаты показали, что уже после первого приема кетопрофен значительно быстрее уменьшает боль (на 1,1 часа) по сравнению с ибупрофеном. Также было выяснено, что максимальный балл снижения боли у кетопрофена первосходит препарат сравнения [40].
В течение 6 ч у 76 % пациентов, принимавших кетопрофен, отмечено снижение боли, тогда как этот показатель для ибупрофена составил 58 % (p < 0,05). Максимальная степень снижения боли при приеме кетопрофена также достигалась быстрее, чем при приеме ибупрофена (рис. 4 [15]).
В исследовании В.Ю. Пиковского и соавт. (2006) кетопрофен применялся на догоспитальном этапе [55] у пострадавших с различными скелетными травмами внутримышечно в дозе 200 мг. Начало обезболивающего эффекта было отмечено через 8,5 ± 2,7 мин. Уменьшение выраженности боли по ВАШ составило 3,4 ± 1,2 балла. Авторами был сделан вывод о том, что применение кетопрофена на догоспитальном этапе в дозе 200 мг внутримышечно позволяет полноценно купировать болевой синдром при нетяжелой скелетной травме, а при тяжелых травматических повреждениях значительно уменьшить выраженность болевого синдрома, не вызывая нарушений витальных функций.
Интересно исследование Vastel et al. (2005), в котором сравнивалось не обезболивающее действие кетопрофена и целекоксиба, а возможность их применения для профилактики патологической кальцификации у пациентов, перенесших эндопротезирование тазобедренного сустава. Степень кальцификации классифицировалась по Brooker (стадии 0–4) и подтверждалась рентгенологически. НПВП назначались сразу после операции на 7-е сутки. По завершении курса профилактики в обеих группах отмечалась достоверно меньшая степень кальцификации по сравнению с контрольной группой (р = 0,014). Между группами кетопрофена и целекоксиба достоверные различия не зафиксированы, таким образом, оба НПВП могут применяться для профилактики гетеротопической кальцификации у данной категории больных [15].
Обезболивающая эффективность кетопрофена при ревматологической патологии
В исследовании I. Jokhio и соавт. [31] кетопрофен сравнивали с диклофенаком у 180 пациентов, испытывающих выраженные боли (среднее значение по ВАШ ~70 мм) вследствие травмы или острой патологии мягких тканей ревматической природы. При этом была использована ступенчатая терапия: в первый день НПВП применяли в виде в/м инъекций, а затем перорально. Соответственно, половина пациентов получила две инъекции кетопрофена по 100 мг, а затем принимала этот препарат по 100 мг 2 раза в день. Вторая группа больных получила две инъекции диклофенака по 75 мг, а в дальнейшем принимала его по 50 мг 3 раза в день внутрь. Курс лечения составил 2 недели. К концу периода наблюдения кетопрофен демонстрировал лучшие результаты. При этом 72 % больных, получавших кетопрофен, оценили его переносимость как хорошую или отличную; такую оценку диклофенаку дали лишь 50 % пациентов (рис. 5 [57]).
Высокая анальгетическая эффективность кетопрофена была продемонстрирована в работе итальянских ученых P. Sarzi-Puttini и соавт., проведших метаанализ 13 РКИ (n = 898), в которых сравнивалось действие кетопрофена 50–200 мг/сут с ибупрофеном 600–
1800 мг/сут или диклофенаком 75–100 мг/сут у больных с разными ревматическими заболеваниями. Кетопрофен показал достоверное превосходство над препаратами сравнения в 9 из 13 РКИ. При этом вероятность достижения благоприятного эффекта при назначении кетопрофена была почти в 2 раза выше (ОШ 0,459; 95% ДИ 0,33–0,58; p = 0,000) [32].
Важным доказательством достоинств кетопрофена стало европейское проспективное открытое исследование, охватившее около 20 тыс. больных с различной ревматической патологией, в основном остеоартрозом (ОА). Через 1 месяц более 70 % пациентов, принимавших кетопрофен в дозе 200 мг/сут, отметили хороший или превосходный результат; при этом ЖКТ-осложнения суммарно возникли у 13,5 %, а язвы и кровотечения — всего у 0,03 % [32].
Работа M. Schattenkirchner и соавт. показала хорошую переносимость кетопрофена при длительном использовании. В их исследовании 823 больных ОА и ревматоидным артритом получали кетопрофен в течение года. На фоне лечения осложнения со стороны ЖКТ возникли у 28 % пациентов (лишь у 1,7 % серьезные), а со стороны сердечно-сосудистой системы — у 3,2 %, что относительно немного, учитывая преимущественно пожилой возраст пациентов и тяжелый коморбидный фон [33].
Удачные результаты были получены при использовании кетопрофена у больных анкилозирующим спондилоартритом (АС). При АС НПВП играют роль основного терапевтического агента, позволяющего контролировать развитие болезни. В исследовании M. Dougados и соавт. 246 больных АС в течение 6 недель принимали целекоксиб 200 мг, кетопрофен 200 мг или плацебо. Достоверной разницы по обезболивающему действию обоих НПВП не было, при этом они существенно превосходили плацебо. Особый интерес представляет влияние НПВП на такие симптомы, как ночная боль и утренняя скованность, которые в большей степени отражают противовоспалительный эффект. Действие кетопрофена и целекоксиба практически не различалось: уменьшение ночных болей составило в среднем 21 и 27 мм по ВАШ (в группе плацебо увеличилось на 13 мм), утренняя скованность уменьшилась на 16 и 17 минут (в группе плацебо не изменилась). Таким образом, кетопрофен оказывает четкое противовоспалительное действие при АС. Интересно, что число ЖКТ-осложнений на фоне приема коксиба и кетопрофена не различалось: они возникли у 13 и 14 % больных (8 % на плацебо) [34].
Обезболивающая эффективность и безопасность применения кетопрофена в гинекологии и онкологии
В акушерстве и гинекологии кетопрофен применяется при лечении дисменореи, послеродовых и после-операционных болей.
В исследовании Н.В. Болдаревой (2003) было показано, что для купирования симптомов предменструального синдрома кетопрофен следует назначать за 1–2 дня до его появления. При наличии дисменореи и менструальной мигрени необходимо продолжить его прием на протяжении 2 дней менструации, причем эффективную дозу и режим применения препарата следует подбирать индивидуально [36].
По данным М. Potarius и соавт. (1993), введение кетопрофена (200 мг/день внутривенно) позволяет на 40 % снизить потребность в опиоидах после операции кесарева сечения. В исследовании, проведенном Э.К. Айламазян и соавт. (2002), было показано, что применение кетопрофена в гинекологической практике после эндоскопических вмешательств было более эффективно, чем использование традиционного обезболивания 50% раствором анальгина с 1% раствором димедрола [37].
В исследовании В.Н. Прилепской и соавт. (2001) приняли участие 110 пациенток после произведенных операций: гистероскопии (58), мини-абортов (27), абортов (11) и ножевой биопсии шейки матки (14). В послеоперационном периоде для обезболивания 59 больным назначали кетопрофен в дозе 150–200 мг в сутки. Структуру болевого синдрома анализировали на 2-e сутки после операции с помощью анкеты, включающей 8 признаков боли: локализация, вид, интенсивность, глубина расположения, время возникновения, характер, иррадиация боли и сопутствующие ощущения. Было выявлено, что успокоение боли через 1 ч после применения кетопрофена наступало у 94 % больных, что свидетельствует о больших перспективах его использования для анестезиологического обеспечения гинекологических операций в амбулаторно-поликлинических условиях [38].
В исследовании С.Б. Ходаковского и соавт. (2008) участвовали 147 пациенток, находящихся в гинекологическом стационаре по поводу разнообразной патологии органов репродуктивной системы: 63 — после операции артифициального аборта, 39 — стромальной опухоли матки, 23 — с острыми и хроническими воспалительными заболеваниями органов малого таза и 23 — с дисменореей. Всем женщинам назначался кетопрофен в различных дозировках, вводимый внутримышечно, с последующим переходом на пероральную форму.
В ходе исследования был сделан вывод о высокой терапевтической эффективности и переносимости кетопрофена, применяемого при разнообразной гинекологической патологии. Также был отмечен значительный противовоспалительный и антипиретический эффект. У пациенток после аборта применение кетопрофена позволило отказаться от превентивного назначения антибактериальных препаратов, что поз-волило избежать дисбиотического воздействия на
организм, а в группе пациенток после операции по
поводу стромальной опухоли матки температура тела не превышала 37,3 °С, что свидетельствовало о выраженном противовоспалительном действии и уменьшении выраженности воспалительной реакции [39].
Высокая эффективность и лучшая переносимость кетопрофена по сравнению с индометацином и диклофенаком отмечены также при лечении болевого синдрома у больных со злокачественными новообразованиями [40].
ЖКТ- и кардиоваскулярная безопасность кетопрофена
Следует отметить, что в мире накоплен большой опыт применения кетопрофена. При этом был проведен ряд клинических исследований, результаты которых показали не только хороший терапевтический потенциал этого препарата, но и низкую частоту –осложнений после его применения [24, 25].
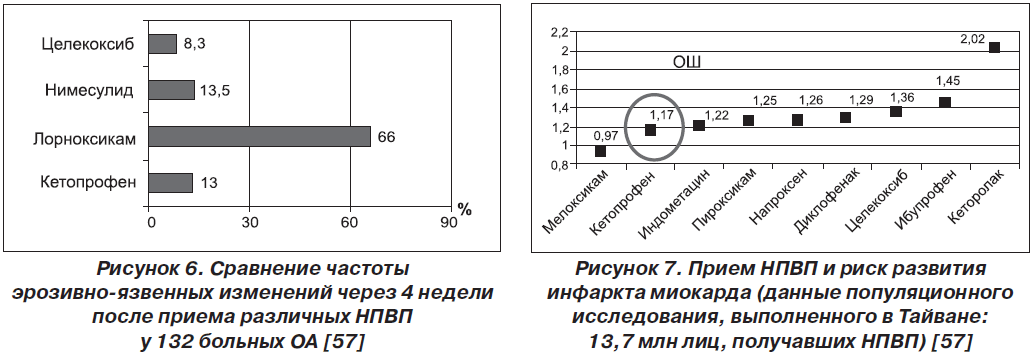
Среди них следует выделить работу Л.Б. Лазебника и соавт., в которой проводилось 3-месячное сравнение 4 НПВП: лорноксикама, нимесулида, целекоксиба и кетопрофена — у 132 больных ОА. Авторы изучали риск осложнений со стороны ЖКТ, суточную динамику артериального давления. Кетопрофен демонстрировал хорошую переносимость: число больных с эрозиями и язвами после использования лорноксикама составило 66 % (!), нимесулида — 13,5 %, кетопрофена — 13,0 %, целекоксиба — 8,3 %. Повышение АД свыше 130/90 мм рт.ст. было отмечено лишь у 2 % больных, получавших кетопрофен. В отношении лорноксикама и нимесулида ситуация оказалась совсем иной: повышение АД было отмечено у 11 и 13 % пациентов, принимавших эти препараты [35]. Эта работа показывает одно из наиболее ценных преимуществ кетопрофена — относительно низкий риск осложнений со стороны сердечно-сосудистой системы (рис. 6 [57]).
В одном из наиболее крупных популяционных исследований кетопрофена был показан относительно низкий риск ЖКТ-осложнений при его применении. Эта работа финских ученых A. Helin-Salmivaara и соавт. основана на оценке причин 9191 случая ЖКТ-кровотечения, язв и перфорации, отмеченных с 2000 по 2004 г. Контроль составили 41 780 лиц, соответствующих по полу и возрасту. Риск ЖКТ-осложнений при использовании кетопрофена оказался ниже в сравнении с диклофенаком: ОШ 3,7 и 4,2 соответственно. Интересен тот факт, что кетопрофен демонстрировал аналогичный или даже меньший риск развития патологии ЖКТ, чем более селективные НПВП (за исключением целекоксиба). Так, ОШ для мелоксикама, нимесулида и эторикоксиба составило 3,4, 4,0 и 4,4 соответственно [41].
Низкий риск кардиоваскулярных осложнений для кетопрофена был показан в популяционном исследовании A. Helin-Salmivaara и соавт. (2006). Работа была основана на сопоставлении данных о приеме НПВП у 33 309 лиц, перенесших инфаркт миокарда, и 138 949 здоровых людей. Оказалось, что прием кетопрофена фактически не увеличивал опасность развития кардиоваскулярных катастроф (ОШ 1,11) [42].
В 2012 г. была опубликована масштабная работа ученых из Тайваня (Shau W. et al.) [43], изучавших кардиоваскулярный риск при использовании различных НПВП в собственной популяции. Исследуемый материал был получен с использованием данных национальной системы здравоохранения, где имелась информация о 13,7 млн лиц, использовавших НПВП, из которых 8354 перенесли инфаркт миокарда. Пероральный кетопрофен демонстрировал минимальный уровень риска (ОШ 1,17). Он оказался более безопасным, чем подавляющее большинство других НПВП (рис. 7 [57]).
Заключение
Таким образом, кетопрофен — нестероидный противовоспалительный препарат из группы производных пропионовой кислоты, обладающий выраженным обез-
боливающим, противовоспалительным и жаропонижающим эффектом.
Кетопрофен представляет собой рацемическую смесь R- и S-изомеров, каждый из которых обладает собственной обезболивающей активностью. Именно наличие левовращающего изомера (R-) в молекуле кетопрофена усиливает противовоспалительную активность рацемата и уменьшает риск гастропатий, что доказано рядом крупных исследований. При этом R-изомер не провоцирует синтез провоспалительных цитокинов Кетопрофен оказывает как периферическое, так и центральное действие, легко и быстро проникает в центральную нервную систему, проходя гематоэнцефалический барьер в течение 15 мин; взаимодействует с системой 5-НТ, что обеспечивает его более высокую эффективность по сравнению с остальными НПВП.
Кетопрофен обладает выраженной обезболивающей и противовоспалительной активностью, что позволяет назначать его практически при всех видах острой и хронической боли, для послеоперационного обезболивания, что доказано многочисленными клиническими исследованиями.
Кетопрофен обладает очень коротким Т1/2 (1–2 часа) и быстро выводится из организма, что снижает риск его аккумуляции даже у больных пожилого возраста, а также у пациентов с нарушением функции печени и почек.
Кетопрофен хондронейтрален, что обеспечивает безопасность его применения у пациентов с дегенеративными заболеваниями суставов.
Данные многочисленных мультицентровых исследований свидетельствуют о его высокой ЖКТ- и кардиоваскулярной безопасности, в том числе при длительном применении у пожилых больных с кардиоваскулярным риском.
Кетопрофен не обнаруживает значимых лекарственных взаимодействий с антацидами и блокаторами
Н2-рецепторов, непрямыми антикоагулянтами, антидиабетическими средствами и метотрексатом.
Препарат не оказывает ингибирующего действия на аспиринзависимое подавление агрегации тромбоцитов, что свидетельствует об определенном кардиопротективном эффекте и низком риске кардиоваскулярных осложнений.
В 2016 г. на фармацевтическом рынке Украины появился кетопрофен европейского производства (Румыния, заявитель World Medicine, Великобритания) — препарат Артрокол, обладающий высокой анальгетической, противовоспалительной активностью с минимальным риском побочных эффектов и доступной ценой. Артрокол имеет 2 формы выпуска — раствор для инъекций и гель для местного применения, что дает возможность ступенчатой терапии и применения при экстренной помощи (раствор) и в амбулаторной практике (раствор, гель).
Подготовила Татьяна Чистик
Список литературы
1. Багдасаров С.Р. Болевой синдром в практике врача //Health-ua.org.
2. Кукушкин М.Л. Хронический болевой синдром: механизмы развития // Боль. Суставы. Позвоночник. — 2011. — 1 (01).
3. Баринов А.Н. Лечение хронической боли // Лечащий врач. — 2005.
4. Levine J.A., Neitlich J., Verga M., Dalrymple N., Smith R.C. Ureteral calculi in patients with flank pain: correlation of plain radiography with unenhanced helical CT // Radio-logy. — 1997. — Vol. 204 (1). — Р. 27-31.
5. Кукушкин М.Л., Табеева Г.Р., Подчуфарова Е.В. Болевой синдром: патогенез, клиника, лечение: Клинические рекомендации / Под ред. акад. РАМН Н.Н. Яхно. — М.: Има-пресс, 2011. — 79 с.
6. Романенко В.И., Романенко И.В., Романенко И.Ю. Особенности психовегетативных нарушений при хроническом болевом синдроме // Український журнал болю. — 2016. — № 1 (5).
7. Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). — М.: Анко, 2000.
8. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов: Клинические рекомендации. — М.: ИМА-пресс, 2009.
9. Каратеев А.Е., Насонова В.А. Развитие и рецидивирование язв желудка и двенадцатиперстной кишки у больных, принимающих нестероидные противовоспалительные препараты: влияние стандартных факторов риска // Тер. арх. — 2008. — № 5. — С. 62-66.
10. Применение нестероидных противовоспалительных препаратов: Клинические рекомендации / Насонов Е.Л., Лазебник Л.Б., Беленков Ю.Н. и др. — М.: Алмаз, 2006.
11. Gurwitz J., Avonn J., Bohn R. et al. Initiation of antihypertensive treatment deny nonsteroidal anti-inflammatory therapy // JAMA. — 1994. — Vol. 272. — P. 781-786.
12. Johnson A., Nguyen T., Day R. Do nonsteroidal anti-inflammatory drugs affect blood pressure? A meta-analysis // Ann. Intern. Med. — 1994. — Vol. 121. — P. 289-300.
13. Polуnia J., Boaventura I., Gama G. et al. Influence of non-steroidal anti-inflammatory drugs on renal function and 24 h ambulatory blood pressure-reducing effects of enalapril and nifedipine gastrointestinal therapeutic system in hypertensive patients // J. Hypertens. — 1995. — Vol. 13, № 8. — P. 925-31.
14. Aw T.-J., Haas S., Liew D. Meta-analysis of cyclooxygenase-2 inhibitors and their effects on blood pressure // Arch. Intern. Med. — 2005. — Vol. 165. — P. 490-496.
15. Sarzi-Puttini P., Atzeni F., Lanata L. et al. Боль и кетопрофен: роль в клинической практике: Пер. с англ. // Reumatisma. — 2010. — 62 (3). — 172-188.
16. Williams R.L., Upton R.A. The clinical pharmacology of ketoprofen // J.Clin. Pharnacol. — 1988. — 28. — 13-22.
17. Schattenkirchner M. Longterm safety of ketoprofen in an eldery population of arthritis patients // Scand. J. Rheumatol. — 1991. — 91. — 27-36.
18. Аrone S. Long term study of ketoprofen SR in eldery patients // Scand. J. Rheumatol. — 1989. — 83. — 15-19.
19. Huber Bruning O., Willbrinck B., Vanroy J.L.A.M., Vanderveen M.J. Potential influences of ketoprofen on human healthy and osteoarthritic cartilage in vitro // Scand. J. Rheumatol. — 1989. — 18. — 29-32.
20. Van Solingen R.M., Rosenstein E.D., Mihailescu G. et al. Comparison of the effects of ketoprofen on platelet function in the presence and absence of aspirin // Am. J. Med. — 2001. — 111. — 285-289.
21. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике // Научно-медицинский журнал GenMed.ru.
22. Кириенко П.И. Использование кетопрофена в клинической практике: обзор // Вестник интенсивной терапии. — 2006. — № 3. — С. 46-49.
23. Adams S.S. Nonsteroidal antiinflammatory drugs, plasma halflife and adverse reactions // Lancet. — 1987. — 2. — 1204-1205.
24. Singh G., Terry R., Ramey D.R. et al. Comparative GI toxicity of NSAIDs // Arthritis Rheum. — 1997. — 40 (Suppl.). — S115.
25. Venegoni M., Da Cas R., Menniti-Ippolito F., Traversa G. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy // Ann. Ist. Super –Sanita. — 2010. — 46 (2). — 153-157.
26. Barden J., Derry S., McQuay H., Moore R. Single dose oral ketoprofen and dexketoprofen for acute postoperative pain in adults // Cochrane Database Syst. Rev. — 2009. — 4. CD007355.
27. Karvonen S., Salomäki T., Olkkola K. Efficacy of oral paracetamol and ketoprofen for pain management after major orthopedic surgery // Methods Find Exp. Clin. Pharmacol. — 2008. — 30 (9). — 703-706.
28. Olson N., Otero A., Marrero I. et al. Onset of analgesia for liquigel ibuprofen 400 mg, acetaminophen 1000 mg, ketoprofen 25 mg, and placebo in the treatment of postoperative dental pain // Clin. Pharmacol. — 2001. — 41 (11). — 1238-1247.
29. Кириенко П.А., Гельфанд Б.Р., Гриненко Т.Ф., Борзенко А.Г. Предупреждающая аналгезия в хирургии вен нижних конечностей // Consilium medicum, приложение. — 2001. — Выпуск 2. — С. 48.
30. Boccara G. et al. The preoperative administration of ketoprofen improves analgesia after laparoscopic cholecystectomy in comparison with propacetamol or postoperative ketoprofen // British Journal of Anaesthesia. — 2005. — V. 94, № 3. — Р. 347-51.
31. Jokhio I., Siddiqui K., Waraich T. et al. Study of efficacy and tolerance of ketoprofen and diclofenac sodium in the treatment of acute rheumatic and traumatic conditions // J. Pak. Med. Assoc. — 1998. — 48. — 373-376.
32. Sarzi-Puttini P., Atzeni F., Lanata L., Bagnasco M. Efficacy of ketoprofen vs. ibuprofen and diclofenac: a systematic review of the literature and meta-analysis // Clin. Exp. Rheumatol. — 2013. — 31 (5). — 731-8. Epub 2013 May 17.
33. Schattenkirchner M. Long-term safety of ketoprofen in an elderly population of arthritic patients // Scand. J. Rheumatol. (Suppl.). — 1991. — 91. — 27-36.
34. Dougados M., Béhier J., Jolchine I. et al. Efficacy of celecoxib, a cyclooxygenase 2-specific inhibitor, in the treatment of ankylosing spondylitis: a six-week controlled study with comparison against placebo and against a conventional nonsteroidal antiinflammatory drug // Arthritis Rheum. — 2001. — 44 (1). — 180-185.
35. Лазебник Л.Б., Дроздов В.Н., Коломиец Е.В. Сравнительная эффективность и безопасность применения кетопрофена, лорноксикама, нимесулида и целекоксиба у больных остеоартрозом // РМЖ. — 2004. — 12 (14). — 844-847.
36. Болдарева Н.В. Предменструальный синдром // Consilium Medicum. — 2003. — Т. 01, № 2.
37. Айламазян Э.К., Ниаури Д.А., Зиятдинова Г.М. Клинико-экономическое обоснование применения кетонала с целью обезболивания после эндоскопических вмешательств в гинекологии // Российский вестник акушера-гинеколога. — 2002. — № 6. — С. 51-53.
38. Прилепская В.Н., Куземин А.А. Малые хирургические операции в амбулаторных условиях и вопросы обезболивания // Consilium Medicum. — 2001. — Т. 3, № 6.
39. Ходаковский С.Б., Гура А.Н., Захаренко Н.А. Опыт применения кетопрофена (Кетонала) в практике гинекологического отделения // Жіночий лікар. — 2008. — № 2. — С. 38.
40. Новиков Г.А., Вайсман М.А., Прохоров Б.М. и др. Кетонал в лечении болевого синдрома у пациентов с распространенными формами злокачественных новообразований // Паллиативная медицина и реабилитация. — 2002. — № 3. — С. 48-51.
41. Helin-Salmivaara A., Saarelainen S., Gronroos J. et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population // Scan. J. Gastroenterol. — 2007. — 42. — 923-932.
42. Helin-Salmivaara A., Virtanen A., Vesalainen R. et al. NSAID use and the risk of hospatalisation for first myocardial infarction in the general population: a national case-control study from Finland // Eur. Heart J. — 2006. — 27. — 1657-1663.
43. Shau W., Chen H., Chen S. et al. Risk of new acute myocardial infarction hospitalization associated with use of oral and parenteral non-steroidal anti-inflammation drugs (NSAIDs): a case-crossover study of Taiwan’s National Health Insurance claims database and review of current evidence // BMC Cardiovasc Disord. — 2012. — 12, 4. doi: 10.1186/1471-2261-12-4.
44. Barbanoj M.J., Antonijoan R.M., Gich I. Clinical pharmacokinetics of dexketoprofen // Clin. Pharmacokinet. — 2001. — Vol. 40. — P. 245-262.
45. Cabre F., Fernandez M.F. et al. Analgesic, antiinflammatory, and antipyretic effects of S(+)-ketoprofen in vivo // J. Clin. Pharmacol. — 1998. — Vol. 38. — P. 3S-10S.
46. Kehlet H. et al. // Anesth Analg. — 1993. — 77. — 1048-56.
47. Maмчур В.И. Современные возможности концепции эффективного обезболивания // Медицинский портал «Здоровье Украины». — 2016.
48. Natale et al. Studio in soggetti volontari sani della biodisponibilita relativa e della farmacocinetica di ketoprofen dopo somministrazione per via orale sotto forma di sale di lisina in formulazione bustine di granulato (dose singola e ripetuta) e in forma di ketoprofen acido formulato in capsule. Data on file 1991.
49. Rusca et al. Two way crossover, randomised, single dose comparative bioavailability study of ketoprofen lysine salt after oral administration to healthy volunteers of both sexes. (IPAS-KETO-025-94), data on file 1994.
50. D’arienzo M., Pennisi M., Zanolo G., Borsa M. Ketoprofen lysine: ketoprofen serum levels and analgesic activity // Drugs. Exp. Clin. Res. — 1984. — Vol. 10. — P. 863-866.
51. Veys E.M. 20 Years’ Experience with ketoprofen // Scan. J. Rheumatol. — 1991. — Vol. 90. — P. 3-44.
52. Fatti et al. Valutazione dell’efficacia e tollerabilita di ketoprofen sale di lisina in formulazione in bustine per uso orale in pazienti con affezioni flogistiche dell’apparato muscolo-scheletrico (Reumatismo extra articolare) studio doppio cieco comparativo a placebo. Data on file, 1991. Evaluation of the effectiveness and tolerability of ketoprofen lysine salt formulation in sachets for oral use in patients with inflammatory diseases of the musculo-skeletal system, double-blind study compared with placebo.
53. Robbins D., Taylor M.A.H., Brown M.D., McIlwain H. Ketoprofen versus ibuprofen for acute sports injuries: are there differences between nonsteroidal anti-inflammatory drugs? // Curr. Ther. Res. — 1990. — Vol. 48. — P. 780-789.
54. Михайличенко В.Ю. Современные принципы обезболивания в хирургии // Новости медицины и фармации. — 2008. — 10 (245).
55. Пиковский В.Ю., Сильвестров В.Д. Использование нестероидного противовоспалительного препарата кетонал (кетопрофен) при травматических повреждениях на догоспитальном этапе // Медицина неотложных состояний. — 2006. — 3 (4).
56. Misiołek H., Cettler M., Woroń J. et al. The 2014 guidelines for post-operative pain management // Anaesthesiology Intensive Therapy. — 2014. — Vol. 46, № 4. — P. 221-244.
57. Каратеев А.Е. Кетопрофен при лечении острой и хронической боли: обзор литературных данных // Лечащий врач. — 2014.
58. Zippel H., Wagenitz A. Сравнение эффективности и безопасности декскетопрофена, трометамола и кетопрофена при их внутривенном введении с целью обезболивания после ортопедических вмешательств // Травма. — 2011. — 4 (12).
59. Овечкин А.М. Послеоперационная боль и обезболивание: современное состояние проблемы // Медицина неотложных состояний. — 2011. — 6 (37).