Вступ
Вивчення впливу порушень серцевого ритму та провідності на когнітивну функцію має особливе значення у кардіоневрології, оскільки саме ці розлади відіграють суттєву роль у розвитку когнітивного дефіциту. Особлива увага в літературі приділяється ролі фібриляції передсердь (ФП), яку діагностують у 1 % дорослого населення [18]. Більше 6 мільйонів європейців страждають від цієї аритмії. Поширеність ФП, за попередніми оцінками, зросте у 2 рази впродовж наступних 50 років. За своєю медико-соціальною значимістю ФП суттєво випереджає інші види кардіальних аритмій, що пов’язано не лише з її поширеністю, але й з тяжкістю обумовлених нею органних ускладнень, асоційованих зі значними моральними та матеріальними витратами. Розвиток хронічної серцевої недостатності, збільшення ризику раптової серцевої смерті, емболічні церебральні ускладнення, погіршення перебігу постінсультного періоду, стійка інвалідизація, низька виживаність — усе перераховане є наслідком втрати синусового ритму [6]. ФП дає п’ятиразове збільшення ризику інсульту, і один із кожних п’яти інсультів пов’язаний із цією аритмією. Ішемічні інсульти при ФП часто закінчуються смертельним наслідком, а пацієнти, які вижили, мають вищий відсоток інвалідизації та частіше страждають від рецидивів, ніж пацієнти з іншими причинами інсульту. Разом із тим сама специфіка хвороби (клінічні прояви, наслідки, характер лікування) визначає її істотний вплив на актуальну життєву ситуацію, інтелект та систему особистісних стосунків хворого [1]. ФП вважається чинником, пов’язаним із когнітивними розладами (КР), що розвиваються у результаті перенесеного інсульту, так і не пов’язаним із гострими порушеннями мозкового кровообігу [15, 24, 28].
Питання генетичної залежності розвитку когнітивних розладів активно розробляються останніми роками і найбільш вивчені для хвороби Альцгеймера (ХА). На думку деяких дослідників, так звані спорадичні випадки, до яких належить переважна більшість випадків діагностованої ХА, можуть бути обумовлені мутаціями або поліморфізмом в генах, однак патогенна експресія генетичної аномалії у них знаходиться під впливом інших генів та/або факторів навколишнього середовища [4, 27]. Встановленим геном, пов’язаним із розвитком спорадичної ХА з пізнім початком, на сьогодні є ген аполіпопротеїну E (АРОЕ) [11, 12]. Механізми синтезу і біотрансформації білків, що знаходяться під впливом пресенілінів, гена білка-попередника амілоїду АРР або АРОЕ, на даний час вивчені недостатньо. Тим не менш не викликає сумніву те, що всі вивчені генетичні аномалії так чи інакше впливають на процеси, пов’язані з порушеннями в амілоїдних перетвореннях, які призводять до утворення нейротоксичних амілоїдних бляшок (АБ).
APOE — білок із численними функціями, який експресується в гліальних клітинах. Ген АРОЕ локалізується на 19-й хромосомі, його екзони кодують утворення білка з 299-амінокислотним залишком. Існує кілька ізоформ гена відповідно до локалізації певних амінокислот на двохнуклеотидних послідовностях. Найбільш поширена форма АРОЕ — це ε3, що містить цистеїн на позиції 112 нуклеотиду і аргінін — на 158. На відміну від цього ізоформи гена ε2 і ε4 містять на обох цих позиціях тільки цистеїн або тільки аргінін відповідно. У літературі наводяться дані, що АРОЕ3 і АРОЕ2 кодують переважно утворення ліпопротеїдів високої щільності, у той час як АРОЕ4 пов’язаний з індукцією синтезу ліпопротеїдів дуже низької щільності [21].
APOE бере участь у процесах регенерації при ураженнях центральної нервової системи. Доведена участь АРОЕ в компенсаторному холінергічному синаптогенезі. Є відомості про вплив патологічних ізоформ АРОЕ на стан синаптичної передачі та NMDA-рецептори шляхом їх фосфорилювання з подальшим розвитком глутаматергічних порушень. Показано взаємозв’язок генотипу АРОЕ і холінергічного дефіциту при ХА: зниження активності ацетилхолінтрансферази в гіпокампі і скроневій корі обернено пропорційно кількості копій алелі ε4 гена АРОЕ [4].
Носійство алелі ε4 гена АРОЕ пов’язане з підвищеним ризиком розвитку ХА, а також більш раннім віком виникнення КР. Взаємозв’язок між APOEε4 і β-амілоїдом обумовлює утворення АБ, а зв’язок з тау-білком пояснює утворення нейрофібрилярних клубків.
У дослідженні, проведеному в Каліфорнійському університеті в 2009 р., було показано, що алель APOEε4 набагато частіше зустрічається у пацієнтів із помірними КР (ПКР) амнестичного типу порівняно з ПКР неамнестического типу (у 48,96 % із 153 обстежених; p = 0,02). Крім того, за наявності генотипу АРОЕ4 об’єм гіпокампу за даними морфометрії був вірогідно менше [17]. У зв’язку з цим деякими авторами висловлюється припущення, що швидкість прогресування КР при ХА значно вище у носіїв двох алелей — ε4/ε4 [14, 16]. Тим не менш генотип ε4/ε4 зустрічається в середньому тільки у 1 % осіб європеоїдної раси. Цікавим є і той факт, що жінки — носії ε4/ε4-генотипу мають 45% ймовірність розвитку ХА віком до 73 років [25], тоді як у чоловіків — лише 25% ймовірність ризику захворіти на ХА до цього віку. За наявності однієї алелі ε4 50 % жінок і чоловіків ризикують захворіти до 87 років [10]. Більш докладний метааналіз досліджень показав, що серед пацієнтів різної расово-територіальної належності з ХА азіати і жителі Середземномор’я значно рідше були носіями ε4 (37 та 43 % відповідно), ніж хворі європеоїдного населення Північної Америки і Північної Європи (58 і 64 % відповідно; відмінності вірогідні між усіма групами; p < 0,05) [13].
В австралійському дослідженні 2013 р. аналізувався взаємозв’язок КР і відкладення амілоїду за даними позитронно-емісійної томографії (ПЕТ) у носіїв АРОЕ4. Було обстежено 158 здорових літніх особи з проведенням ПЕТ з PiB (пітсбурзьким лігандом β-амілоїду), генетичного тестування і комплексного нейропсихологічного обстеження. Було показано, що у носіїв АРОЕ4 існує сильний негативний кореляційний взаємозв’язок між короткочасною вербальною пам’яттю і накопиченням амілоїдного білка [19]. Крім того, у носіїв АРОЕ4 атрофія гіпокампа з перебігом хвороби розвивається швидше.
Генотип АРОЕ4 пов’язаний не тільки з високим ризиком розвитку ХА, але також і з гіршим клінічним результатом наслідків черепно-мозкової травми і перенесеного інсульту [20]. Особливий інтерес являють результати нечисленних досліджень про зв’язок цереброваскулярної патології та АРОЕ на розвиток та прогресування КР. В одному з досліджень 216 пацієнтів із ХА перебували під спостереженням протягом 3,3 року. Носії алелі ε були не тільки більшою мірою схильні до розвитку ХА з пізнім початком, але й до системного атеросклерозу, ішемічної хвороби серця та інфаркту міокарда, артеріальної гіпертензії [9, 23]. Носійство патологічних ізоформ гена АРОЕ може порушувати ліпідний обмін, сприяючи пошкодженню церебральних артерій і прогресуванню цереброваскулярної хвороби. Було показано, що хворі з наявністю генотипу ε4, артеріальної гіпертензії, а також після перенесеного інсульту при вже діагностованій ХА характеризувалися більш істотним прогресуванням КР [2, 22].
Крім того, активність ферментів, що розщеплюють білок-попередник амілоїду, варіабельна і залежить від стану середовища. Середовище з високим вмістом холестерину створює умови для активації β- і γ-секретаз, що викликають утворення нерозчинних форм амілоїду. Дані механізми нарівні з деякими іншими патогенетичними реакціями можуть пояснити тісний зв’язок нейродегенеративного і судинного процесу, які не просто співіснують, а й мають виражений взаємообтяжуючий ефект. Взаємозв’язок цереброваскулярного і нейродегенеративного (альцгеймерівського) процесу на даний час активно вивчається і обговорюється, у тому числі і в генетичному аспекті.
Таким чином, на сьогодні в літературі досить широко описані питання нейрогенетики розвитку ХА. Одним із факторів ризику розвитку і прогресування спорадичної форми захворювання є носійство гена АРОЕ4, при цьому ризик істотно збільшується при генотипі ε4/ε4. У той же час існують відомості про наявність взаємозв’язку між генотипом АРОЕ і прогресуванням деменції при судинних КР [2], а також нечисленні, але дуже важливі дані про те, що АРОЕ4 не тільки є фактором, що сприяє розвитку деменції, але й суттєво впливає на частоту виникнення серцево-судинних захворювань. Такі дані можуть розглядатися як генетичне підтвердження концепції змішаної альцгеймерівсько-судинної деменції, при якій істотний внесок у прогресування КР роблять загальні фактори ризику, модульовані носійством алелі ε4 гена АРОЕ.
Мета дослідження: оцінити зв’язок носійства алелі ε4 гена АРОЕ зі станом когнітивних функцій і атрофічними змінами головного мозку у хворих із фібриляцією передсердь.
Матеріали і методи
Усього обстежений 61 пацієнт (43 чоловіки та 18 жінок віком від 40 до 75 років; середній вік — 64,8 ± 8,2 року) із КР різної вираженості при ФП. Вибір груп пацієнтів був обумовлений широко наведеними літературними відомостями про вплив генотипу АРОЕ не тільки на стан когнітивних функцій, але й на судинні фактори ризику. Для комплексного обстеження було відібрано 38 пацієнтів із персистуючою (пароксизмальною) формою ФП (26 чоловіків та 12 жінок; середній вік — 64,8 ± 7,2 року), 23 пацієнти — з постійною формою ФП (17 чоловіків і 6 жінок; середній вік — 64,7 ± 8,3 року). Групи пацієнтів не відрізнялися за віком та супутньою патологією. Контрольну групу для проведення математично-статистичного аналізу становили пацієнти, у яких під час генетичного дослідження не було виявлено патологічної ізоформи алелі ε4.
У групах були відсутні пацієнти, які перенесли інсульт. Пацієнти з КР були розділені на групи відповідно до домінуючого патерну інтелектуально-мнестичних розладів за результатами клініко-нейропсихологічного дослідження.
Усім хворим виконано аналіз поліморфізму гена АРОЕ з виділенням ДНК з ядер периферичних лейкоцитів і проведенням полімеразної ланцюгової реакції фрагмента гена АРОЕ з наступним аналізом довжини рестрикційних продуктів шляхом електрофорезу в 6% поліакриламідному гелі. Візуалізація результатів гель-електрофорезу здійснювалася шляхом перегляду і фотографування у прохідному ультрафіолетовому світлі на трансілюмінаторі. За результатами визначали наявність алелей ε2, ε3 або ε4 і можливий генотип пацієнта (ε2/ε2, ε2/ε 3, ε3/ε3, ε2/ε4, ε3/ε4, ε4/ε4).
Усім хворим було проведене лабораторне дослідження, що включало аналіз ліпідного спектра крові.
Аналіз результатів усіх досліджень проводився в два етапи. На першому етапі всім хворим виконувалось нейропсихологічне дослідження, спрямоване на комплексну оцінку когнітивних функцій. Застосовували методики: вільне і асоційоване селективне розпізнавання (FCSRT, Hybridversion, Grober E., Buschke H., 1988), коротка шкала оцінки психічного статусу (MMSE, Folstein M.F., 1975), батарея методик для оцінки лобної дисфункції (FAB, Dubois B. еt al., 2000), тест малювання годинника (ТМГ, Sunderland T. et al., 1989), символьно-цифровий тест (СЦТ, Wechsler D., 1945), відтворення літеральних (ЛА) і категоріальних (КА) асоціацій (Kazdin A., 1982), тест стеження (Trail Making Test, Reitan R., 1955), повторення цифр у прямому і зворотному порядку (Wechsler D., 1945), Монреальська методика оцінки когнітивних функцій (МоСА, Nasreddine Z., 2005), клінічна рейтингова шкала деменції (CDR), шкала деменції Маттіса (ШДМ, Mattis S., 1976). Відповідно до критеріїв, запропонованих Н.Н. Яхно [7, 8], за тяжкістю КР поділяли на легкі (ЛКР), помірні (ПКР) і тяжкі (ТКР). Оцінку некогнітивних нервово-психічних розладів проводили за допомогою госпітальної шкали тривоги і депресії (ГШТД).
На другому етапі в рамках комплексного дослідження всім пацієнтам із вивченим генотипом АРОЕ провели аналіз морфометричних характеристик шляхом комп’ютерної томографії (КТ) головного мозку. На аксіальних зрізах комп’ютерних томограм вимірювали ширину субарахноїдальних просторів (САП) на рівні полюса лобних часток і сільвієвої борозни. Оцінювали вираженість розширення шлуночкової системи (максимальний розмір ІІІ шлуночка, індекс передніх рогів, біфронтальний індекс, бікаудальний індекс, індекс тіл шлуночків), атрофію скроневих часток (мінімальна товщина середньої скроневої звивини, міжункальна відстань) і гіпокампа (за шкалою Шелтенса) [3, 5]. Як показник норми брали середнє популяційне значення з урахуванням вікового фактора [26].
Статистична обробка отриманих результатів проводилась з використанням програмно-математичного комплексу для MS Excel 2000. Дані в табл. 1 наведені як середнє арифметичне і його стандартна похибка (M ± m). Різниця вважалась вірогідною при p < 0,05.
Результати та обговорення
Відповідно до даних нейропсихологічного тестування, у 31,1 % пацієнтів діагностували ЛКР, у 54,1 % — ПКР, у 14,8 % — ТКР. Скарги на когнітивну сферу активно висували 75,4 % пацієнтів. Зв’язок між ФП та порушеннями пам’яті відзначили 34 (65,6 %) хворі. При цьому у 55,7 % пацієнтів із ЛКР, 26,2 % із ПКР і 9,8 % із ТКР суб’єктивні скарги були відсутні. Відсутність скарг на КР корелювала з їх тяжкістю (r = 0,263; p = 0,004), вираженістю їх дисрегуляторних порушень (FAB, r = –0,268; p = 0,007), апатії (r = 0,217; p = 0,017), імпульсивності (r = 0,228; p = 0,009), зловживанням алкоголем в анамнезі (r = 0,338; p < 0,001). Тяжкість КР корелювала з віком (r = 0,324; p < 0,001) пацієнтів і тривалістю освіти в ранньому періоді життя (r = –0,367; p < 0,001).
Тяжкість КР мала взаємозв’язок із вираженістю багатьох некогнітивних нервово-психічних розладів. Найбільш значущі кореляції відзначили між тяжкістю КР і вираженістю апатії (r = 0,487; р < 0,001) і депресії (r = 0,329; p < 0,001). Результати аналізу нейропсихологічних характеристик за наявності клінічно значущих нервово-психічних розладів показали, що для пацієнтів з депресією були характерні більше низькі бали за MMSE (р = 0,04), більша вираженість нейродинамічних і дисрегуляторних порушень (тест літеральних асоціацій; р = 0,01; символьно-цифровий тест; р = 0,028). Різниця за іншими нейропсихологічними тестами не була статистично значущою. Наявність клінічно значущої апатії суттєво впливала на результати всіх тестів.
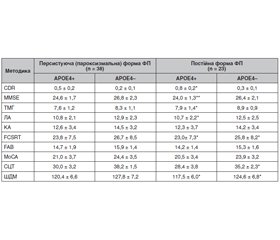
За результатами проведеного ДНК-дослідження вдалося встановити 28 носіїв як мінімум однієї алелі ε4, з яких 4 мали генотип ε4/ε4. Інші пацієнти мали генотипи ε2/ε2, ε2/ε3, ε3/ε3, які за більшістю літературних відомостей не є факторами ризику нейродегенеративної патології. Таким чином, контрольну групу становили 33 пацієнти. У результаті проведеного комплексного нейропсихологічного дослідження було об’єктивізовано стан когнітивних функцій у пацієнтів різних груп залежно від наявності генотипу АРОE4 (табл. 1).
У цілому пацієнти — носії АРОE4 мали більш виражені КР різної модальності. Для таких хворих із постійною формою ФП було більшою мірою характерно погіршення за шкалами MMSE і FCSRT, що характеризувало в першу чергу мнестичний дефіцит. У пацієнтів із персистуючою або пароксизмальною формами ФП частіше знижувався загальний бал в тесті малювання годинника за рахунок дисрегуляторних порушень.
У пацієнтів — носіїв двох алелей ε4 у всіх діагностичних підгрупах рівень холестерину в плазмі крові і ліпопротеїдів дуже низької щільності був вірогідно вище, ніж у носіїв одної алелі (p < 0,02 та p < 0,05 відповідно) та при відсутності генотипу АРОE4 (p < 0,01 для обох порівнянь). Такі результати, можливо, підтверджують гіпотезу деяких дослідників про вплив АРОE4 на синтез ліпопротеїдів дуже низької щільності [21]. Вірогідно частіше в нашому дослідженні у носіїв ε4 виявлялися ознаки загального та церебрального атеросклерозу, що також відповідало припущенням інших дослідників про вплив АРОE4 на судинні фактори ризику [9, 23]. Разом із тим відмінностей за частотою і ступенем вираженості артеріальної гіпертензії у осіб із різним генотипом виявлено не було.
За даними нейровізуалізаційного дослідження, у пацієнтів із ФП і вивченим генотипом АРОE порівняно з нормою вірогідно вище були значення показників, які характеризували стан бокових шлуночків. Розмір III шлуночка перевищував норму в 1,97 раза (p < 0,01). Розширення шлуночкової системи вплинуло на значення морфометричних індексів і мало місце в обох групах. Значення маркерів підкіркової атрофії дещо відрізнялись: біфронтальний і бікаудальний індекси були вірогідно вище за норму (р < 0,01). Наявність кіркового атрофічного процесу підтверджується і вимірюванням САП: на рівні полюса лобної частки їх ширина перевищувала норму в 3,7 раза, на рівні сільвієвої борозни — у 3,6 раза. У 13,1 % випадків САП були розширені на рівні полюса лобної частки, у 18,0 % — на рівні сільвієвої борозни і у 27,9 % — рівномірно розширені. Група пацієнтів АРОE4+ характеризувалася вірогідно більш вираженою атрофією скроневих часток і гіпокампів. Для пацієнтів АРОE4+ було характерно більш значне розширення передніх рогів бокових шлуночків (табл. 2). Таким чином, аналізуючи морфометричні характеристики, встановлено, що у 70,5 % пацієнтів із ФП та вивченим генотипом АРОE когнітивні розлади розвивалися на тлі атрофічного процесу головного мозку.
/92.jpg)
Встановлені вірогідні відмінності (р < 0,05) між показниками ширини САП на рівні полюса лобних часток в обох досліджуваних групах: 0,59 ± 0,05 см проти 0,42 ± 0,07 см відповідно. У групі АРОЕ4+ розмір ІІІ шлуночка становив 0,69 ± 0,08 см, АРОЕ4– — 0,57 ± 0,10 см, але ці відмінності були невірогідні. Проте в групі АРОЕ4+ більш ніж в 1,5 раза частіше (у 46,0 % випадків) діагностували внутрішню церебральну атрофію (легка — у 11,5 %, помірна — у 27,9 %, виражена — у 6,6 %), у групі АРОЕ4– цей показник становив 27,9 % (13,1 % — легкого і 14,8 % — помірного ступеня). Таким чином, у групі пацієнтів АРОЕ4+ переважав фокальний тип зовнішньої церебральної атрофії, і в 1,5 раза частіше, ніж в групі пацієнтів АРОЕ4–, діагностували морфометричні ознаки внутрішньої церебральної атрофії.
Для пацієнтів групи АРОЕ4+ характерна більш висока частота «німих» інфарктів головного мозку. Це вказує на важливе значення «безсимптомного» судинного ураження головного мозку у розвитку КР.
Збільшення розміру ІІІ шлуночка і САП простору на рівні полюса лобної частки супроводжувалося погіршенням загального бала з тесту вільного асоційованого селективного розпізнавання (FCSRT) (r = 0,81), за шкалою MoCA (r = 0,7), відстроченого відтворення тесту «10 слів» (r = 0,77), шкалою деменції Маттіса (r = 0,7). Збільшення розмірів індексів передніх рогів і тіл шлуночків було пов’язане із зменшенням бала FCSRT (r = 0,88), загального бала за шкалою MoCA (r = 0,75). Збільшення індексу Шелтенса і мінімальної товщини середньої скроневої звивини супроводжувалося зниженням результату за тестом «10 слів» у його різних повтореннях (з 1-го по 3-тє) з r = 0,78–0,85. Суттєвим є відсутність подібних кореляційних закономірностей у осіб, які не є носіями ε4.
Висновки
При безпосередньому зіставленні результатів нейропсихологічного дослідження у групах пацієнтів з АРОЕ4 були виявлені більш виражені когнітивні порушення, хоча статистично значущі відмінності виявлені не у всіх випадках. Кореляційний аналіз дозволив показати, що носійство ε4 є важливим чинником для виникнення залежності між нейропсихологічними і нейровізуалізаційними показниками. За відсутності генотипу АРОЕ4 такі закономірності не відмічали. Проведене дослідження підтвердило істотну роль даного генотипу у розвитку КР при фібриляції передсердь. Носійство АРОЕ4 впливає на тяжкість КР в цілому, а також на погіршення короткочасної вербальної пам’яті зокрема, що підтверджується сильними кореляційними зв’язками.
Встановлені залежності між носійством алелі ε4 і рівнем ліпопротеїдів дуже низької щільності, вираженістю загального та церебрального атеросклерозу, безумовно, підтверджують вплив відповідного генотипу на судинні фактори ризику.
У групі пацієнтів АРОЕ4+ переважав фокальний тип зовнішньої церебральної атрофії, і в 1,5 раза частіше, ніж в групі пацієнтів АРОЕ4–, діагностували морфометричні ознаки внутрішньої церебральної атрофії. Встановлені кореляційні зв’язки між рівнем когнітивних функцій і морфометричними маркерами підкіркової атрофії у групах пацієнтів з АРОЕ4, що підтверджує провідну роль останньої у розвитку і прогресуванні когнітивного дефіциту.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Алехин А.Н. Психологические проблемы в аритмологии (на модели фибрилляции предсердий) / А.Н. Алехин, Е.А. Трифонова, Д.С. Лебедев // Вестник аритмологии. — 2011. — № 63. — С. 45-54.
2. Емелин А.Ю. Когнитивные нарушения при цереброваскулярной болезни: Автореф. дис… д-ра мед. наук. — СПб., 2010. — 37 с.
3. Меллер Т.Б., Райф Э. Норма при КТ- и МРТ-исследованиях: Пер. с англ. / Под общ. ред. Г.Е. Труфанова, Н.В. Марченко. — М.: МЕДпресс-информ, 2008. — 256 с.
4. Рогаев Е.И. Молекулярные механизмы болезни Альцгеймера: генетический подход // Болезнь Альцгеймера и старение: от нейробиологии к терапии / Е.И. Рогаев. — М.: НЦПЗ РАМН, 1999. — С. 83-86.
5. Салий М.И. Некоторые особенности морфометрических характеристик головного мозга у больных c лакунарным инсультом / М.И. Салий, З.В. Салий, С.И. Шкробот // Журнал неврологии и психиатрии. — 2014. — № 12. — С. 33-37.
6. Cуслина З.А. Практическая кардионеврология / З.А. Cуслина, А.В. Фонякин, Л.А. Гераскина, В.Вл. Машин, Е.С. Трунова, В.В. Машин, М.В. Глебов. — М.: ИМА-ПРЕСС, 2010. — С. 205-207.
7. Яхно Н.Н. Нейрохимические маркеры нейродегенерации в ранней диагностике болезни Альцгеймера, сосудистой и смешанной деменции / Н.Н. Яхно, Н.Н. Белушкина, О.В. Успенская // Журнал неврологии и психиатрии. — 2010. — № 8. — С. 36-40.
8. Яхно Н.Н. Деменции / Н.Н. Яхно, В.В. Захаров, А.Б. Локшина, Н.Н. Коберская, Э.А. Каптарян. — М.: Медпресс-информ; 2010.
9. Anand S.S. Genetic variants associated with myocardial infarction riskfactorsin over 8000 individuals from five ethnic groups: The INTERHEART Genetics Study / S.S. Anand, C. Xie, G. Pare // Circ. Cardiovasc. Genet. — 2009. — Vol. 2. — P. 16-25.
10. Breitner J.C. APOE-epsilon4 count predicts age when prevalence of AD increases, then declines: the Cache County Study / J.C. Breitner, B.W. Wyse, J.C. Anthony // Neurology. — 1999. — Vol. 53, № 2. — P. 321-331.
11. Coon K.D. A high-density whole-genome association study reveals that APOE is the major susceptibility gene for sporadic late-onset Alzheimer’s disease / K.D. Coon, A.J. Myers, D.W. Craig // J. Clin. Psychiatry. — 2007. — Vol. 68, № 4. — P. 613-618.
12. Couzin J. Genetics. Once shunned, test for Alzheimer’s risk headed to market / J. Couzin // Science. — 2008. — Vol. 319, № 5866. — P. 1022-1023.
13. Crean S. Apolipoprotein E ε4 prevalence in Alzheimer’s disease patients varies across global populations: a systematic literature review and meta-analysis / S. Crean, A. Ward, C. Mercaldi // Dement. Geriatr. Cogn. Disord. — 2011. — Vol. 31. — P. 20-30.
14. De Carli C. Alzheimer’s disease cooperative study group. Qualitative estimates of medial temporal atrophy as a predictor of progression from mild cognitive impairment to dementia / C. De Carli, G.B. Frisoni, C.M. Clark // Arch. Neurol. — 2007. — Vol. 64, № 1. — P. 108-115.
15. Elias P.K. Blood pressure-related cognitive decline: does age a make difference? / P.K. Elias, M.F. Elias, M.A. Robbins, M.M. Budge // Hypertension. — 2004. — Vol. 44. — P. 631-636.
16. Farlow M. Differential qualitative responses to rivastigmine in APOE epsilon 4 carriers and noncarriers / M. Farlow, R. Lane, S. Kudaravalli, Y. He // Pharmacogenomics J. — 2004. — Vol. 4, № 5. — P. 332-335.
17. He J. Differences of brain volume, hippocampal volume, cerebrovascular risk factors and APOE4 among MCI subtypes / J. He, S. Farias, O. Martinez // Arch. Neurol. — 2009. — Vol. 66, № 11. — P. 1393-1399.
18. Kannel W.B. Prevalence, incidence, prognosis and predisposing conditions for atrial fibrillation: population-based estimates / W.B. Kannel, Р.А. Wolf, Е.J. Benjamin // Am. J. Cardiol. — 1998. — Vol. 82(8A). — P. 2-9.
19. Lim Y.Y. A-beta amyloid, cognition and APOE genotype in healthy older adults / Y.Y. Lim, K.A. Ellis, D. Ames // Alzheimer’s and Dementia. — 2013. — № 9. — P. 538-545.
20. Liu Y. Apolipoprotein E polymorphism and acute ischemic stroke, a diffusion and perfusion-weighted magnetic resonance imaging study / Y. Liu, M.P. Laakso, J.O. Karonen // J. Cereb. Blood Flow Metab. — 2002. — Vol. 22, № 11. — P. 1336-1342.
21. Mahley R.W. Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer’s disease / R.W. Mahley, K.H. Weisgraber, Y. Huang // Proc. Natl. Acad. Sci. —2006. — Vol. 103, № 15. — P. 5644-5651.
22. Mielke M.M. Interaction between vascular factors and the APOE E4 allele in predicting rate of progression in Alzheimer’s dementia / M.M. Mielke, J.-M. Leoutsakos, J.T. Tschanz // J. Alzheimer’s Dis. — 2011. — Vol. 26, № 1. — P. 127-134.
23. Niu W. The relationship between apolipoprotein E epsilon2/epsilon3/epsilon4 polymorphysms and hypertension: a meta-analysis of six studies comprising 1812 cases and 1762 controls / W. Niu, Y. Qi, Y. Qian // Hypertens. Res. — 2009. — Vol. 32. — P. 1060-1066.
24. Ott A. Atrial fibrillation and dementia in a population-based study. The Rotterdam Study / А. Ott, М.М. Breteler, М.С. de Bruyne, F. van Harskamp, D.E. Grobbee, А. Hofman // Stroke. — 1997. — Vol. 28(2). — Р. 316-321.
25. Payami H. Gender difference in apolipoprotein E-associated risk for familiar Alzheimer disease: a possible clue to the higher incidence of Alzheimer disease in women / H. Payami, S. Zareparsi, K.R. Montee // Amer. J. Hum. Genet. — 1996. — Vol. 58, № 4. — P. 803-811.
26. Prassopoulos P. The Size of the Intra- And Extraventricular Cerebrospinal Fluid Compartments in Children With Idiopathic Benign Widening of the Frontal Subarachnoid Space / P. Prassopoulos, D. Cavouras, S. Golfinopoulos // Neuroradiology. — 1995. — Vol. 37. — P. 418-421.
27. Roses A.D. On the discovery of the genetic association of Apolipoprotein E genotypes and common late-onset Alzheimer disease / A.D. Roses // J. Alzheimer’s Dis. — 2006. — Vol. 9, № 3. — P. 361-366.
28. Sabatini T. Regarding atrial fibrillation and cognitive function in older people / Т. Sabatini, G.B. Frisoni, P. Barbisoni, G. Bellelli, R. Rozzini, M. Trabucchi // J. Am. Geriatr. Soc. — 2000. — Vol. 48. — P. 387-390.

/91.jpg)
/92.jpg)