Введение
Рабдомиолиз (синонимы: краш-синдром, синдром длительного раздавливания) представляет собой разрушение поперечно-полосатой мускулатуры с повреждением сарколеммы мышц и высвобождением в системный кровоток продуктов распада. Рабдомиолиз всегда находился в зоне пристального внимания анестезиолога-реаниматолога при проведении интенсивной терапии пациентам с политравмой (автодорожной, высотной, производственной). Однако в последние годы данная проблема стала крайне актуальной в связи с поступлением раненых с минно-взрывной травмой (МВТ) из зоны проведения антитеррористической операции (АТО).
Исторически первый случай рабдомиолиза был описан еще в XIII веке у человека, употребившего в пищу перепела, питавшегося семенами болиголова. В последующем синдром длительного раздавливания с развитием острой почечной недостаточности (ОПН) был описан в 1908 г. во время Сицилийского землетрясения в Мессине, во время которого погибло около 60 тыс. человек, а 10 тыс. человек требовали оказания медицинской помощи. F. Meyer-Betz в 1910 году описал классическую триаду симптомов при рабдомиолизе: боль в мышцах, слабость, появление мочи бурого цвета.
В годы Первой мировой войны F. Davies и R. Weldon (1917) опубликовали в журнале Lancet статью «A contribution to the study of war nephritis», введя в клиническую практику тех лет термин «нефрит войны». В 1920 году W. Bredauer выдвинул предположение о том, что причиной олигоанурии является обструкция извитых канальцев почек миоглобиновыми и гемоглобиновыми цилиндрами.
В ходе Второй мировой войны, во время бомбардировок Лондона немецкой авиацией, британские врачи встретились с шоком неясной природы, возникавшим у пострадавших, находившихся в течение нескольких часов под развалинами разрушенных зданий. У них, несмотря на проведение противошоковых мероприятий, наступал смертельный исход вследствие развития стойкой анурии. В 1941 году E. Bywaters и D. Beall опубликовали статью «Crush injuries with impairment of renal function», в которой они обосновали понятие «краш-синдром» (crush-syndrome — синдром раздавливания) на основании клинической картины и патоморфологических изменений, ведущих к развитию ОПН. В последующем E. Bywaters (1942, 1944) описал 50 случаев развития нефрита от сдавления в результате обвала зданий, причем у 2/3 пострадавших развилась ОПН, приведшая к смерти. Автором было выделено 3 периода заболевания: 1) раздавливание и некроз тканей; 2) значительный местный отек и шок, развивающийся через несколько часов после раздавливания: 3) острая почечная недостаточность. Интересно, что в своих последних работах E. Bywaters (1953) предложил еще одно название данного синдрома — ишемический мышечный некроз (ischaemic muscle necrosis), считая его более точным, поскольку он установил связь развития синдрома с ишемией мышц [1, 2].
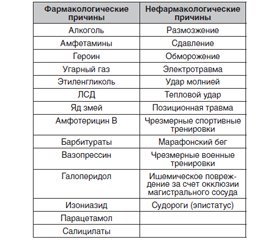
Согласно современным представлениям, рабдомиолиз может быть наследственным — за счет врожденного дефицита гликолитических ферментов (миофосфорилазы, фосфофруктокиназы и пр.), нарушения метаболизма липидов (дефицит карнитина), злокачественной гипотермии. А также приобретенным — вследствие воздействия лекарственных препаратов и токсинов, в случае непосредственной травмы мышц, размозжения, прямой компрессии, либо когда пациент в течение длительного времени лежал на полу без попыток изменить позу, так называемая позиционная травма (например, вследствие отравления угарным газом, алкоголем и пр.) (табл. 1).
/129.jpg)
В условиях отделения реанимации и интенсивной терапии (ОРИТ) наиболее частыми причинами рабдомиолиза являются травмы мышц и нарушение их кровоснабжения. Частота рабдомиолиза у пациентов с травмами может достигать 85 %. В 20 % случаев его развитию способствует алкоголь, поскольку считается, что алкоголь вызывает прямое повреждение сарколеммы, приводящее к повышению проницаемости натрия и последующему накоплению кальция [3].
В случае автодорожной, производственной, высотной и минно-взрывной травмы главными источниками рабдомиолиза выступают 3 больших мышечных массива: область спины, ягодицы и бедра.
Патогенез рабдомиолиза связан с разрушением поперечно-полосатой мускулатуры, повреждением сарколеммы мышц и высвобождением в системный кровоток продуктов распада (электролитов, креатинкиназы (КК), альдолазы, лактатдегидрогеназы, аланинаминотрансферазы, аспартатаминотрансферазы), при котором ключевую роль играет миоглобин.
Вследствие прямого повреждения сарколеммы (травма) или развития дефицита аденозинтрифосфата (АТР) в миоцитах (ишемия и пр.) происходит неконтролируемое повышение внутриклеточного кальция, которое вызывает персистирующее сокращение мышц и истощение АТР, активацию кальцийзависимых протеаз и фосфолипаз, обусловливая, таким образом, деструкцию миофибрилл, цитоскелета и мембранных протеинов — дезинтеграция миоцитов.
Секвестрация жидкости в поврежденных мышцах вызывает гиповолемию и активацию симпатического отдела вегетативной нервной системы, антидиуретического гормона, ренин-ангиотензиновой системы, что, в свою очередь, обусловливает развитие почечной вазоконстрикции.
Появление свободного миоглобина в системном кровотоке вызывает развитие миоглобининдуцированного острого повреждения почек (ОПП). Миоглобин, с одной стороны, генерирует свободнорадикальное тубулярное повреждение, а с другой, взаимодействуя с Tamm-Horsfall белком (уринарный гликопротеин, в норме секретируемый клетками дистальных канальцев), образует комплекс, вызывающий обструкцию дистальных почечных канальцев. Образованию комплекса миоглобина с Tamm-Horsfall белком способствует снижение рН мочи. Другими механизмами почечного повреждения являются эндотелиальная дисфункция и локальная воспалительная реакция [2–4].
Целью исследования явилось создание клинической стратегии предупреждения, диагностики и интенсивной терапии рабдомиолиза на основании современных международных рекомендаций и обобщения собственного опыта лечения раненных в зоне проведения АТО с минно-взрывной травмой.
Материалы и методы
Из 786 раненных в зоне проведения АТО, которые находились на лечении в клинике интенсивной терапии КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова» за период с 2014 по 2016 г., ретроспективно были обследованы 298 пациентов с клинико-лабораторными признаками острого повреждения почек вследствие минно-взрывной травмы. Все обследованные раненые находились на лечении в отделении реанимации и интенсивной терапии политравмы и в отделении анестезиологии и интенсивной терапии № 1 КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова».
Возраст пациентов составлял от 19 до 42 лет. Ранения были получены в результате артиллерийских обстрелов либо при подрывах на минах. Первый этап оказания медицинской помощи в 2014 — начале 2015 г. осуществлялся на уровне центральных районных больниц (ЦРБ) в прифронтовой зоне, а уже в 2015–2016 гг. — в условиях военно-мобильных госпиталей, а также прифронтовых ЦРБ, в которых была расположена группа военно-медицинского усиления.
Все раненые с МВТ, которые имели массивные ранения туловища и конечностей с повреждением (в виде размозжения, отрывов, ушибов большой протяженности) значительных мышечных массивов, включались в группу высокого риска развития рабдомиолиза.
Мы в нашей клинической практике использовали следующие диагностические критерии рабдомиолиза:
— появление темного цвета мочи с коричневым оттенком;
— повышение уровня креатинкиназы более чем в 5 раз. При этом необходимо подчеркнуть, что данное повышение столь значимо, что другие причины (например, инфаркт миокарда) можно было исключить. Повышение КК наступало в первые 12 часов с момента травмы, достигая пика на 3-и — 5-е сутки пропорционально объему повреждения мышц. Согласно данным литературы, считается, что уровень КК > 5000 ЕД/л ассоциирован с развитием ОПП у 50 % пациентов [4];
— повышение уровня миоглобина в плазме крови (при этом необходимо помнить, что на его уровень могут влиять также иные факторы метаболизма). Миоглобин — переносчик кислорода с молекулярной массой ≈18 800 D, лабораторные нормы для этого белка составляют до 92 мкг/л, почечный порог — 150–170 мкг/л;
— нарушения водно-электролитного и кислотно-основного баланса в виде развития гиперкалиемии, гиперфосфатемии, гиперурикемии, гипермагнезиемии, начальной гипокальциемии (при восстановлении функции почек она сменяется гиперкальциемией), метаболического ацидоза.
Все пациенты ежедневно оценивались по шкале стадий развития ОПП согласно рекомендациям KDIGO Clinical Practice Guideline for Acute Kidney Injury (2012) (табл. 2) [5].
Все пациенты, имевшие диагностические критерии развития рабдомиолиза, были проспективно разделены нами на 2 группы:
— I группа (n = 277) — пациенты, которым проводился комплекс интенсивной терапии, направленный на предупреждение дальнейшего усугубления ОПП вследствие миоглобинурии;
— II группа (n = 21) — пациенты, которым осуществляли проведение заместительной почечной терапии.
Комплекс интенсивной терапии рабдомиолиза строился на следующих принципах.
1. Агрессивная инфузионная терапия кристаллоидными растворами, при этом объем инфузионной терапии зависел от степени тяжести рабдомиолиза. Нами проводилась оценка волемического статуса пациентов: обеспечивался центральный венозный доступ для измерения центрального венозного давления (ЦВД), определялся объем почасового диуреза. В среднем инфузия кристаллоидов проводилась со скоростью около 400 мл/час (200–1000 мл/ч в зависимости от тяжести рабдомиолиза) под контролем ЦВД и диуреза. Целевое значение диуреза составляло 3 мл/кг/ч (около 200 мл/ч).
2. Инфузия 4% бикарбоната натрия. Сода потенциально предотвращает преципитацию и деградацию миоглобина в почечных канальцах, а также применима для купирования ацидоза и гиперкалиемии. Объем вводимого бикарбоната натрия определялся исходя из следующего принципа: начальная доза должна обеспечить нормализацию кислотно-щелочного состояния (КЩС) крови (коррекцию ацидоза), а последующая — достижение нейтрального значения рН мочи пациента.
При этом хотелось бы отметить, что, кроме использования рН-метра и лакмусовой бумаги, оценка рН мочи у постели больного может быть проведена реактивом Андреева, что может быть важно в условиях ограниченных лечебно-диагностических ресурсов. Реактив Андреева готовится следующим образом: предварительно готовят спиртовой раствор бромистого синего (10 г/л), для работы его разводят в 4 раза (2,5 г/л). При проведении исследования 2–3 мл мочи пациента наливают в пробирку, в которую добавляют 1–2 капли реактива Андреева. Оценка результатов исследования рН мочи: желтый цвет соответствует кислой, бурый — слабокислой, травянистый — нейтральной, сине-зеленый — слабощелочной, зеленый или насыщенно синий — щелочной реакции мочи.
3. Поддержание положительного водного баланса со стимуляцией диуреза небольшими дозами салуретиков с целью поддержания диуреза в диапазоне 90–200 мл/час (> 1 мл/кг/час) для предотвращения обструкции почечных канальцев. В случае развития олигоанурии дальнейшая стимуляция диуреза салуретиками прекращалась.
4. Проведение заместительной почечной терапии всем пациентам с клинической картиной ОПП, относящейся ко 2–3-й стадии при наличии следующих сдвигов:
— резистентная гиперкалиемия более 6,5 ммоль/л;
— диурез менее 0,5 мл/кг/ч на протяжении 12 часов;
— анурия;
— гиперволемия;
— резистентный к терапии метаболический ацидоз (рН менее 7,1).
Для обеспечения процедуры в верхнюю полую вену по стандартной методике устанавливали двухпросветный диализный катетер, способный обеспечить скорость экстракорпорального кровотока до 230 мл/мин.
Заместительная почечная терапия проводилась в следующих вариантах:
— продленная вено-венозная гемодиафильтрация (CVVHDF) аппаратом PRIZMA с использованием Set HF1000, непрерывно, в среднем в течение до 72 часов, со скоростью замещения 1500–2500 мл/час, субститут — Multibic 2+, Duosol 2+, со скоростью ультрафильтрации 75–150 мл/час и потоком крови 75–100 мл/мин;
— дискретная вено-венозная гемодиафильтрация (HDF) с использованием колонок с высокопоточными мембранами FX corDiax (Fresenius). Особенностью технологии является улучшенная элиминация миоглобина данной мембраной с коэффициентом просеивания 0,5. Длительность сеанса составляла от 2 до 4 часов; скорость экстракорпорального кровотока — от 160 до 230 мл/мин; частота сеансов — от ежедневных в начале терапии до 1–2 раз в неделю в конце терапии. Гепаринизация контура составляла 10–30 ЕД/кг/час с предварительным контролем коагулограммы, времени свертывания. По сравнению с плазмаферезом гемодиафильтрация с использованием мембран FX corDiax является более безопасным методом детоксикации, так как использование высокопроницаемых мембран не вызывает потерь белков, в том числе функциональных;
— гемодиализ (HD).
Указанные эфферентные методики детоксикации осуществлялись на аппаратах Fresenius 4008H и PRISMA.
Статистическую обработку результатов исследования проводили с использованием методов биометрического анализа, реализованных в пакетах программ Excel 2003, Statistica 8.0.
Результаты
Из всех раненых, находившихся на лечении в период 2014–2016 гг. в отделениях интенсивной терапии, у 37,9 % были выявлены клинико-лабораторные признаки рабдомиолиза и ОПП вследствие полученной минно-взрывной травмы. Из них только у 7 % потребовалось проведение заместительной почечной терапии. Как показал наш опыт, комбинация адекватной хирургической обработки ран и проводимый комплекс интенсивной терапии, несмотря на развитие ОПП, обеспечили положительный клинический эффект у 93 % раненых с рабдомиолизом без необходимости проведения заместительной почечной терапии.
Уровень миоглобина в сыворотке крови обеих групп пациентов составил от 430 до 4580 мкг/л (в норме у мужчин — до 92 мкг/л), а уровень КК — от 980 до 7850 ЕД/л (норма — 24–195 Ед/л). При этом во второй группе исходные значения уровней КК и миоглобина были достоверно выше по сравнению с пациентами первой группы (табл. 3).
У раненых второй группы критерием выбора того или иного варианта заместительной почечной терапии была способность данного метода влиять на ведущий патогенетический фактор с целью достижения коррекции: 1) гиперволемии; 2) гиперкалиемии; 3) ацидоза; 4) гиперазотемии; 5) гипернатриемии. Распределение использованных методов заместительной почечной терапии представлено в табл. 4. Необходимо подчеркнуть, что у 12 пациентов в качестве стартовой методики заместительной почечной терапии была использована продленная вено-венозная гемофильтрация (CVVHF). Нами была отмечена высокая эффективность и безопасность продленной вено-венозной гемофильтрации, которая проводилась у ряда пациентов на фоне вазопрессорной поддержки. Осложнений при ее использовании выявлено не было.
/131.jpg)
Также необходимо отметить, что 3 раненых, которым потребовалось проведение заместительной почечной терапии (на протяжении 1–1,5 месяца), поступили в больницу Мечникова в поздние сроки после ранения, с экспозицией анурии более 48 часов и клинико-лабораторными признаками 3-й стадии ОПП, что было обусловлено несвоевременной и некачественной интенсивной терапией тяжелой МВТ. Указанные раненые поступили в первые месяцы проведения АТО в 2014 г.
Летальных исходов в обеих группах пациентов с рабдомиолизом не было.
Обсуждение
Согласно данным литературы, у 10–50 % пациентов, имеющих маркеры рабдомиолиза, развивается острое повреждение почек. Из всех случаев острого повреждения почек на рабдомиолиз приходится от 5 до 25 % [3]. Уровень летальности может достигать 15–60 % [5].
Важно понимание того факта, что диагноз «рабдомиолиз» необходимо устанавливать как можно раньше, на основании наличия больших участков разрушенных мышечных массивов и/или изменения цвета мочи, для начала проведения комплекса интенсивной терапии и только потом — его лабораторного подтверждения (КК, миоглобин). Главными условиями, предрасполагающими к развитию ОПП, являются гиповолемия и ацидоз [6]. Так, в норме миоглобин свободно связывается с глобулином плазмы и выводится печенью, и лишь следы его попадают в мочу. При массивном высвобождении плазма не в состоянии связать весь миоглобин, и в этом случае миоглобин элиминирует путем клубочковой фильтрации. Гиперконцентрация миоглобина в моче в кислой среде вызывает образование нерастворимых конгломератов в почечных канальцах, что клинически проявляется в виде ОПП.
В недавно опубликованной работе [6] было продемонстрировано, что средний уровень КК у пациентов с ОПП (4923 ЕД/л) был выше, чем у пациентов без развития острого повреждения почек (2349 ЕД/л), однако при этом данный уровень был меньше, чем классический критерий при рабдомиолизе (5000 ЕД/л). Это авторы объясняют мультифакторностью развития ОПП при МВТ.
Также необходимо учитывать, что такой биохимический показатель, как креатинин, согласно П. Марино [7], не является точным показателем функции почек при рабдомиолизе, поскольку он высвобождается из скелетных мышц и дополняет уровень сывороточного креатинина.
Динамика уровня КК и миоглобина, выступающих главными биохимическими маркерами при рабдомиолизе, отражает выраженность процесса распада мышечных волокон и тяжесть повреждения, в то же время позволяет оценить эффективность проводимой интенсивной терапии, направленной на предотвращение дальнейшего углубления ОПП. Изменение данных показателей определяет суточный объем инфузионной терапии, а также необходимость пролонгирования ощелачивания бикарбонатом натрия. При снижении их уровня мы соответственно уменьшали суточный объем инфузионной терапии.
Активная инфузионная терапия кристаллоидными растворами при рабдомиолизе преследовала цель коррекции гипотензии, поддержания адекватной почечной перфузии и выведения дериватов свободного миоглобина. Для начальной инфузионной терапии необходимо исключить растворы Рингера лактата, чтобы не усугублять лактат-ацидоз. Также мы придерживались рекомендаций KDIGO [5] о преимущественном использовании кристаллоидных растворов для начальной инфузионной терапии, ранее — коллоидных (за исключением случаев геморрагического шока) (2В). Мы хотели бы подчеркнуть, что в последние 4 года в условиях наших ОРИТ мы крайне редко используем коллоидные растворы, их применение в нашей практике ограничено только случаями геморрагического шока вследствие массивного кровотечения и выраженной гипотензии различного генеза, рефрактерной к вазопрессорной поддержке.
Бикарбонат натрия в первые сутки с момента поступления вводился нами в объеме, который позволял обеспечить нормализацию КЩС и нейтральное значение рН мочи. В дальнейшем, начиная со вторых суток при отсутствии лабораторных признаков ацидоза, он вводился в дозе 200 мл/сут, а при достижении супранормальных значений КК и миоглобина его введение прекращалось.
Мы также использовали небольшие дозы салуретиков (40 мг два раза в сутки) для поддержания высокого темпа диуреза на фоне многообъемной волемической нагрузки, но только в первые несколько суток с момента получения ранения, кода биохимические маркеры ОПП имели максимально высокие значения. При этом в литературе вопрос об использовании диуретиков остается достаточно дискутабельным. Так, согласно рекомендациям KDIGO [5], допускается применение маннитола в дозе 200 г/сут под контролем осмолярности, а к салуретикам отношение отрицательное. В нашей клинической практике мы не использовали осмодиуретики. Также не рекомендуется использование диуретиков для профилактики ОПП (1В), однако не совсем понятно, о каких дозах идет речь. Нам кажется, что использование небольших доз салуретиков на фоне многообъемной волемической нагрузки с целью поддержания высокого темпа диуреза вполне допустимо.
Мы строго придерживались следующих важных рекомендаций KDIGO [5], в которых не рекомендуется использование диуретиков для лечения ОПП за исключением случаев гиперволемии (2С), а также не рекомендуется использовать низкие дозы дофамина для профилактики или лечения ОПП (1А). Последнее положение необходимо жестко выполнять, поскольку, как показал целый ряд исследований, которые были проведены за последние 20 лет, использование так называемых «почечных» доз дофамина приводит только к усугублению повреждения почек за счет углубления ишемии. К сожалению, в практике интенсивной терапии в Украине эта старая методика «добывания мочи» остается широко распространенной.
В целом своевременная волемическая нагрузка кристаллоидами, ощелачивание введением раствора бикарбоната натрия и поддержание высокого темпа диуреза небольшими дозами салуретиков позволили обеспечить эффективную терапию острого повреждения почек и сохранить диурез у подавляющего большинства раненых с минно-взрывной травмой.
Также важно подчеркнуть, что полноценная хирургическая обработка ран с удалением нежизнеспособных тканей и при наличии показаний — своевременная ампутация нежизнеспособных конечностей, а также проведение вакуум-терапии (VAC-терапии) в зонах значительных дефектов тканей позволяют обеспечить значительное ускорение грануляции и заживления значительных раневых поверхностей, внося весомый вклад в дело лечения рабдомиолиза при МВТ.
Всем пациентам, имевшим критерии 2-й стадии (без ответа на начальную стимуляцию небольшими дозами салуретиков и эуфиллином 10 мл шесть раз в сутки), а также 3-й стадии развития ОПП, проводили заместительную почечную терапию. Оптимальные сроки начала заместительной почечной терапии при ОПП в современных рекомендациях не определены. Считается, что уровень мочевины более 27,1 ммоль/л перед началом заместительной почечной терапии ассоциирован с худшими исходами [5]. В случае проведения заместительной почечной терапии диуретики не должны применяться (2В). В целом, как показали исследования, диуретики могут увеличить диурез, но не могут снизить потребность в заместительной почечной терапии.
Таким образом, проведение своевременной и качественной интенсивной терапии пациентам с МВТ и клинико-лабораторными признаками рабдомиолиза позволяет избежать развития миоглобинурической олигоанурии. В случае развития 2–3-й стадии ОПП необходимо максимально раннее проведение заместительной почечной терапии, начальным методом выбора является проведение продленной вено-венозной гемодиафильтрации.
Выводы
1. Реализация основного принципа реаниматологии — своевременности и полноценности проведения комплекса интенсивной терапии обеспечивает высокую эффективность проводимого лечения пациентов с рабдомиолизом.
2. Полноценная хирургическая обработка ран с удалением нежизнеспособных тканей, а при наличии показаний — своевременная ампутация нежизнеспособных конечностей, а также проведение VAC-терапии в участках значительных дефектов тканей.
3. Диагностическими маркерами ОПП при рабдомиолизе служат уровни КК и миоглобина, дополнительными показателями выступают состояние водно-электролитного баланса и КЩС, уровень креатинина, мочевины и факторов коагуляции.
4. Начальное проведение инфузионной терапии кристаллоидами со скоростью около 400 мл/час (200–1000 мл/ч в зависимости от тяжести рабдомиолиза) под контролем ЦВД с целевым значением диуреза 3 мл/кг/ч (около 90–200 мл/ч), с использованием небольших доз диуретиков для поддержания высокого темпа диуреза.
5. Инфузия бикарбоната натрия в первые сутки в объеме, обеспечивающем нормализацию КЩС и достижение нейтрального рН мочи, в дальнейшем, начиная со вторых суток (при отсутствии лабораторных признаков ацидоза), в дозе 200 мл/сут, с последующим прекращением его введения при достижении супранормальных значений КК и миоглобина.
6. Проведение заместительной почечной терапии при наличии следующих показаний: гиперкалиемия (> 6,5 ммоль/л), диурез < 0,5 мл/кг/ч на протяжении 12 часов, анурия, гиперволемия, резистентный к терапии метаболический ацидоз (рН менее 7,1). Продленная вено-венозная гемофильтрация (CVVHF) должна рассматриваться в качестве метода стартового выбора заместительной почечной терапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
/129.jpg)

/130.jpg)
/131.jpg)