Актуальність проблеми
Уперше менінгококову інфекцію (МІ) описав Vieusseux у Швейцарії у 1805 р. Менінгокок (Neisseria meningitidis) уперше був ідентифікований у спинномозковій рідині хворого на менінгіт Weichselbaum у 1887 р. За даними ВООЗ, у 2000-ні роки МІ стала причиною 171 000 смертельних випадків у всьому світі [1]. Neisseria meningitidis викликає 500 000 випадків септицемії та менінгіту у світі щорічно. Актуальні зарубіжні дані свідчать про 5–15% летальність при МІ [2]. Найбільш прикрим є той факт, що МІ може вбивати здорових людей будь-якого віку протягом лише кількох годин від часу появи перших симптомів. У 1919 році W.W. Herrick заявив відносно МІ, що «немає іншої інфекції, яка так швидко вбиває», і це твердження має рацію вже майже 100 років. МІ є лідером серед інфекційних чинників смерті в дітей у Великобританії, навіть попри успіх вакцинації від менінгокока групи С. В Україні щорічно реєструється 300 випадків МІ серед дорослих (вмирає приблизно 40 осіб) та близько 550 серед дітей (вмирає близько 100 пацієнтів). Показник летальності серед дітей в Україні з 2004 по 2008 р. коливався у межах 12–16 %, але в окремих регіонах країни він сягав 20–60 % [3]. Така приголомшлива різниця показників летальності є свідченням різних підходів до своєчасної діагностики та інтенсивної терапії, що нерідко лишаються далекими від сучасних та оптимальних.
Висока летальність є не єдиною проблемою, що створює МІ, адже понад третину хворих, які вижили, мають один клінічно значущий фізичний, когнітивний або функціональний дефект або більше. У цілому один з десяти може мати суттєві наслідки, такі як ампутації кінцівок та пошкодження мозку [4].
Летальні випадки та тяжка інвалідизація переважно пов’язані з блискавичними (фульмінантними) випадками менінгококового сепсису, частка яких сягає 10–20 %, летальність — 80–100 %, а середня тривалість життя становить 9 годин [5].
Одним із провідних чинників високої летальності при МІ є суттєві недоліки та помилки під час надання невідкладної допомоги хворим на догоспітальному етапі та в неспеціалізованих лікувальних установах.
Дуже симптоматичним є результати давнього, але й досі актуального британського проспективного дослідження 54 випадків МІ у дітей, що виявило численні дефекти надання медичної допомоги на догоспітальному етапі. Серед них: пізнє звернення по допомогу (16 випадків), що призводило до затримки надходження дитини до лікарні на 2,5–21 годину; у 15 випадках у відділенні невідкладної допомоги за наявності типових ознак захворювання було встановлено невірний діагноз; лікування в госпіталі розцінене як помилкове в 71 % випадків, шок не було розпізнано або не проводилось його лікування в 50 % випадків! У 20 % дітей виконано спинномозкову пункцію, що була протипоказана. Але найголовніше, що було продемонстровано: у померлих середній час до госпіталізації становив 18,3 години, у тих дітей, які одужали, — 12 годин [6].
Привертає увагу аналіз 56 історій хвороб дітей, які померли від МІ в Україні, проведений головним позаштатним дитячим інфекціоністом МОЗ України, проф. С.О. Крамарєвим у 2008 р. Він показав, що протягом 6 годин від початку захворювання по медичну допомогу звернулося лише 35,7 % батьків дітей з МІ. Лише одній п’ятій частині дітей з МІ медична допомога на догоспітальному етапі була надана в повному об’ємі, 62,5 % дітей вона взагалі не надавалася [3]!
Власний аналіз 56 історій хвороб дітей з МІ, які були госпіталізовані до КЗОЗ «Харківська обласна дитяча інфекційна клінічна лікарня» за період 2008–2009 рр., виявив: пізнє звернення (понад 24 години від початку захворювання) було у 28 (50 %) пацієнтів; медична допомога надана в повному об’ємі лише 39 (69 %) пацієнтам, не надавалася взагалі 12 (21 %) пацієнтам; помилковий діагноз при первинному зверненні по медичну допомогу встановлено 12 (22 %) пацієнтам.
Наведені результати аналізів, узяті з трьох різних джерел, вражають схожістю проблем діагностики та інтенсивної терапії (ІТ) МІ в різних країнах. Між тим була продемонстрована можливість значного зниження летальності при МІ (з 23 % до лише 2 %) за рахунок саме максимально ранньої діагностики та початку ІТ на догоспітальному етапі з подальшим направленням дитини до спеціалізованих педіатричних відділень інтенсивної терапії [7]. До речі, нещодавній аналіз результатів лікування 1820 випадків інвазивної МІ у дітей в Ірландії протягом 2001–2011 рр. констатує лише 3,6 % летального кінця, що різко контрастує з вітчизняними показниками летальності [8].
Отже, з огляду на наведені вище дані наріжним каменем щодо зміни на краще ситуації з лікуванням МІ у дітей є своєчасна, максимально рання діагностика, виявлення пацієнтів високого ризику тяжкого та блискавичного перебігу МІ та невідкладний початок сучасної ІТ саме в цих групах хворих.
Прогнозування перебігу менінгококової інфекції
Для прогнозування перебігу МІ в дітей існують різноманітні шкали та оціночні системи. Найбільш відомою та найпоширенішою є шкала менінгококового сепсису Глазго (GMSРS) (табл. 1).
Оцінка за шкалою понад 8 балів відповідає прогнозованій летальності 73 %, 10 балів — прогнозованій летальності 87,5 % [9].
Дещо пізніше, у 1997 р., було запропоновано Роттердамську шкалу (Rotterdam Score (RS)) менінгококового септичного шоку (СШ) у дітей. Вона базується на оцінюванні показників калію в плазмі (ммоль/л), BЕ (ммоль/л), кількості тромбоцитів (109/л) та C-реактивного білка (СРБ) (мг/л). RS = 1,01 + (1,21 × плазмовий рівень калію) – (0,29 × ВЕ) – (0,024 × кількість тромбоцитів) — (3,75 log × CРБ плазми). Прогнозована ймовірність смерті дорівнює e(RS)/(1 + e(RS)). Точність прогнозування смерті становить 71 %, виживання — 90 % [9].
Найбільш простою та сучасною шкалою є BEP-score (Base Excess and Platelets score). BEP = 1/(1 + e(0,18909 × BЕ, ммоль/л) + (0,01015 × кількість тромбоцитів, 109/л) + 3,07861). Шкала ВЕР дає можливість прогнозувати ймовірність настання смерті при МІ краще, ніж GMSPS, і так само точно, як і Роттердамська шкала та шкала PRISM [10].
Також існує досить простий інструментальний метод прогнозування перебігу МІ, що ґрунтується на ультразвуковому визначенні фракції викиду (ФВ) або фракції скорочення (ФС) лівого шлуночка. Зниження ФВ < 42 % дозволяє прогнозувати імовірність настання летального кінця на рівні 75 %, при ФВ > 45 % вмирає лише 28 % хворих [11]. Також несприятливим прогностичним фактором є зниження ФС < 0,3 [12]. Цей метод прогнозування тяжкості перебігу МІ обумовлений визнанням важливої ролі систолічної дисфункції лівого шлуночка, яка інколи є абсолютно рефрактерною до інотропних засобів, що призводить до розвитку необоротного катехоламін-рефрактерного шоку. Як провідна причина цього феномену при МІ розглядається інтегральна роль p38 мітоген-активованого протеїнкіназного шляху, що запускається інтерлейкіном-6. Вважається, що цей механізм може бути важливим при розробці нових напрямків терапії дисфункції міокарда в пацієнтів з МІ, нечутливих до інотропної підтримки [13].
Іншими маркерами поганого прогнозу та високої імовірності несприятливого та фульмінантного перебігу МІ в дітей є: лейкопенія, нейтропенія, лімфоцитоз, наявність еозинофілів у клінічному аналізі крові, низька швидкість осідання еритроцитів (ШОЕ); прояви коагулопатії споживання, тромбоцитопенія, ацидоз, рясна висипка на верхній половині тулуба, обличчі, слизових оболонках [14].
Вітчизняна медична школа традиційно приділяє значну увагу при МІ розвитку синдрому гострої недостатності надниркових залоз (синдром Waterhouse — Friderichsen (Уотерхауза — Фрідеріксена)), що був описаний у 1911 році Waterhouse у восьмимісячної дитини з фульмінантною пурпурою, а в 1918 році вдруге був описаний Friderichsen. З того часу двобічні крововиливи в надниркові залози вважаються в пострадянських фахових джерелах провідним показником тяжкості та причиною настання летального кінця у хворих на МІ, що абсолютно не збігається з даними провідної англомовної літератури та Guidelines щодо лікування МІ у світі, адже в них головними чинниками несприятливих результатів вважаються катехоламін-рефрактерний шок та церебральна недостатність [15]. У межах існуючого дискурсу доцільно зазначити, що сто років тому, коли був описаний синдром Waterhouse — Friderichsen, наявність недостатності надниркових залоз визначалася не за рівнем кортизолу, а за даними патоморфологічного дослідження, яке констатувало крововиливи в надниркові залози. Хотілось би зауважити, що навіть наявність структурного ушкодження надниркових залоз не є автоматичною ознакою їх функціональної неспроможності. Отже, хибна та застаріла традиція пов’язувати негативні результати лікування МІ із синдромом Waterhouse — Friderichsen обумовлює абсолютно невиправданий акцент на кортикостероїдній терапії замість інфузійної та симпатоміметичної підтримки, що є основою сучасного лікування шоку при МІ у світі [15].
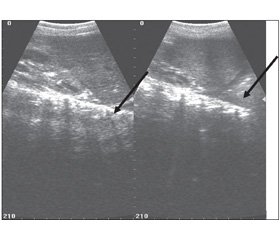
Утім, ми вважаємо за доцільне звернути увагу на провідні клініко-лабораторно-інструментальні критерії діагностики гострої недостатності надниркових залоз, що мають бути тригером для визначення рівня кортизолу та реакції на введення адренокортикотропного гормону, формулювання в клінічному діагнозі синдрому Waterhouse — Friderichsen та призначення кортикостероїдів. Гостра недостатність надниркових залоз проявляється артеріальною гіпотонією, стійкою до інфузійної терапії та симпатоміметиків, гіпоглікемією, гіпонатріємією та гіперкаліємією. При проведенні ультразвукового дослідження в надниркових залозах виявляються набряк та ехонегативні ділянки (позначені стрілкою на рис. 1) [16].
Інтенсивна терапія тяжких та блискавичних форм МІ
Швидкий початок ІТ має вкрай велике значення, він передбачає агресивну гемодинамічну та респіраторну підтримку, що в жодному разі не мають бути відстрочені.
Основними напрямками ІТ, що можуть вплинути на результат МІ, є: антибактеріальна терапія, ІТ розладів гемодинаміки (інфузійна терапія, використання симпатоміметиків, інотропів та вазодилататорів); лікування синдрому дисемінованого внутрішньосудинного згортання крові (ДВЗ-синдрому); забезпечення пластичних та енергетичних потреб; респіраторна підтримка; корекція водно-електролітного балансу (особливо важливим є запобігання гіпокальціємії, гіпо- та гіперкаліємії, гіпонатріємії, тяжкій, понад 10 % від вихідної маси тіла, гіпергідратації) та кислотно-основного стану; за наявності показань — застосування кортикостероїдів; профілактика та лікування некрозів; екстракорпоральні методи детоксикації.
Антибактеріальна терапія згідно з наказом МОЗ України № 737 від 12.10.2009 р. та більшістю провідних світових рекомендацій повинна розпочинатися якомога раніше на догоспітальному етапі. Препаратами вибору є цефалоспорини ІІІ генерації, а саме цефотаксим разовою дозою 75 мг/кг маси тіла та добовою дозою 150–200 мг/кг/маси тіла або цефтріаксон разовою дозою 50 мг/кг маси тіла та добовою дозою 100 мг/кг/маси тіла. При застосуванні цефтріаксону важливо пам’ятати, що він є несумісним із солями кальцію, введення яких може бути необхідним для корекції гіпокальціємії, не повинен використовуватися в недоношених та новонароджених із жовтяницею та ацидозом через здатність підсилювати гіпербілірубінемію. Отже, найбільш безпечною буде стартова терапія цефотаксимом. Подальша терапія, після бактеріологічного підтвердження менінгококової етіології захворювання та виведення хворого з шоку, може проводитися бензилпеніциліном у добовій дозі 300–500 тис. ОД/кг маси тіла. При алергії до β-лактамів стартова терапія розпочинається хлорамфеніколом у добовій дозі 100 мг/кг маси тіла [4, 14–16]. Проте з огляду на наявні дані щодо резистентності деяких ізолятів менінгокока в окремих країнах Європи та Азії до пеніциліну (4,6 %) та хлорамфеніколу (2,3 %), відсутність вірогідних даних щодо чутливості/резистентності менінгокока до цих антибіотиків в Україні більш безпечним є використання саме цефалоспоринів ІІІ генерації. Головним завданням антибактеріальної терапії є швидке кількісне зменшення бактеріальної популяції, зниження продукування нею факторів кооперативної чутливості та ендотоксину. Тому окремі автори пропонують використовувати для лікування тяжких форм МІ меропенем у добовій дозі 120 мг/кг маси тіла [17]. Цефалоспорини та меропенем, особливо на початку терапії, доцільно застосовувати шляхом подовжених (1–2 години) інфузій. Варто пам’ятати, що у вогнища некрозів антибіотики проникають значно гірше, отже, у них може тривати розмноження менінгококів протягом 13 годин від початку антибіотикотерапії. Отже, реперфузія тканин, пов’язана з ефективним відновленням гемодинаміки, нерідко призводить до повторного ендотоксинового викиду з катастрофічним погіршенням стану хворого [17].
Інфузійна терапія має розпочатися одночасно з антибактеріальною. Для її здійснення у хворих із блискавичними формами МІ необхідно максимально атравматично забезпечити кілька венозних доступів. На догоспітальному етапі — периферичних, на госпітальному — додати центральний венозний доступ у випадках рідинно-рефрактерного шоку та/або блискавичної МІ [14]. За неможливості здійснення венозного доступу протягом 5 хвилин більшість провідних Guidelines рекомендує забезпечувати внутрішньокістковий доступ [15]. Як відомо, СШ у дітей в першу чергу характеризується гіповолемією, що потребує якнайшвидшого усунення. Отже, гемодинамічна підтримка розпочинається зі швидкої (болюсної, протягом 5–10 хв) стартової інфузії 20 мл/кг ізотонічних сольових розчинів, серед яких перевага надається 0,9% розчину хлориду натрію або розчину Рінгера лактату, з наступною оцінкою показників гемодинаміки (артеріальний тиск (АТ), частота серцевих скорочень (ЧСС)) та периферичної перфузії (час заповнення капілярів). Якщо не відбулося відновлення гемодинаміки, болюси можуть повторюватися тричі до досягнення об’єму 60 мл/кг за першу годину лікування (рівень доказовості B). За наявності гемодинаміки інфузійна терапія може розпочинатися 5% розчином альбуміну, також болюсами по 20 мл/кг маси тіла [15, 18, 19]. Наявність менінгіту не виправдовує обмеження інфузійного навантаження у хворого з шоком, адже встановлено, що великі об’єми ізотонічної рідини не сприяють збільшенню набряку мозку [20]. На догоспітальному етапі інфузію необхідно припинити при різкому збільшенні розмірів печінки та/або появі вологих хрипів у легенях. В умовах відділення інтенсивної терапії (ВІТ) інфузія має на меті забезпечити зростання центрального венозного тиску (ЦВТ) до 8 мм рт.ст. (близько 110 мм вод.ст.), але при цьому необхідно зважати на різницю між середнім артеріальним тиском (САТ) та ЦВТ (перфузійний тиск), адже дотримання рекомендованих показників сприяє зменшенню летальності (табл. 2).
/12-1.jpg)
Необхідно пам’ятати, що масивна інфузія холодних розчинів сприяє розвитку ацидозу та нечутливості до катехоламінів, отже, всі розчини необхідно підігрівати до температури 36–37 °С. За наявності гіпоглікемії її необхідно усунути введенням 10–25% розчину глюкози з розрахунку 0,5–1,0 г/кг маси тіла сухої речовини.
Збереження симптомів шоку попри інфузію в об’ємі 60 мл/кг маси тіла протягом години або поява ознак перевантаження кровообігу дають підставу вважати шок рідинно-рефрактерним. У такому випадку рекомендоване обов’язкове забезпечення центрального венозного доступу з подальшим титруванням рідини для підтримки ЦВТ 8 мм рт.ст. Слід пам’ятати, що значна кількість пацієнтів з МІ мають коагуляційні порушення внаслідок ДВЗ-синдрому, тому тривалі, грубі й безуспішні спроби катетеризації центральних вен є дуже небезпечними в плані розвитку серйозної крововтрати [21]. Хворі на СШ, які отримували рідину до досягнення ЦВТ у 8 мм рт.ст., мали меншу летальність, ніж хворі, у яких ЦВТ становив від 8 до 12 мм рт.ст. Найбільшою була летальність у тих хворих, які мали ЦВТ понад 12 мм рт.ст. [22]. Отже, перевантаження рідиною не дає користі, а збереження симптомів шоку попри зростання ЦВТ до 8 мм рт.ст. є показанням для застосування інотропних або вазоактивних препаратів. Доцільно зазначити, що у хворих із критичними розладами гемодинаміки та дихання ЦВТ недостатньо точно відбиває стан венозного повернення та погано корелює з рівнем волемії, отже, практичне застосування цього показника викликає багато запитань [23, 24].
Окрім перших годин втрата рідини й вторинна гіповолемія, пов’язана з витоком з капілярів, можуть тривати протягом багатьох днів. Відновлення втрат рідині, що тривають, необхідно спрямовувати на досягнення клінічного результату, під яким слід розуміти ефективний серцевий викид і тканинну перфузію (рівень доказовості 2C) [25]. Частіше за все подальша інфузійна терапія здійснюється за правилом «4–2–1» з урахуванням факторів, що впливають на добову потребу в рідині (гіперальдо–стеронізм, внутрішньочерепна гіпертензія, гостре пошкодження нирок тощо).
Діуретики (фуросемід, торасемід) використовують для усунення рідинного перевантаження після виведення хворого з шоку. З метою усунення гіпер–альдостеронізму як одного з чинників гіпотонічної гіпергідратації, гіпокаліємії та олігурії ми вважаємо за доцільне раннє призначення антагоністів альдо–стерону — спіронолактону. У разі неефективності діуретичної терапії застосовують постійну вено-–венозну гемофільтрацію або переривчастий діаліз для запобігання рідинному перевантаженню понад 10 % від маси тіла [25].
Через окрему лінію призначається симпатоміметик. У дітей препаратом першого вибору вважається допамін, що призначається дозою 10 мкг/кг/хв [18] (рівень доказовості 2C). Дозу допаміну титрують до ефективної, але не більше від 20–25 мкг/кг/хв. Альтернативою допаміну є використання добутаміну, що найбільше доцільне у хворих з поганою перфузією та збереженим артеріальним тиском та/або легеневою гіпертензією. Добутамін титрується від 10 до 20 мкг/кг/год [26]. У разі збереження ознак шоку він вважається допамін-рефрактерним. У 2016 році було показано, що адреналін може бути ефективною альтернативою допаміну як препарату стартової інотропної підтримки. Більше того, його застосування сприяє вірогідному зниженню летальності порівняно із допаміном [27]. Адреналін титрується в дозах від 0,1 до 2–3 мкг/кг/хв. Низькі дози адреналіну (0,1–0,3 мкг/кг/хв) здатні збільшувати серцевий викид та покращувати периферичну перфузію. Слід звернути увагу на те, що в ретроспективному дослідженні продемонстровано вірогідне зростання летальності, пов’язане з призначенням неадекватної інотропної терапії в дітей з менінгококцемією (відношення шансів 23,7; 95% довірчий інтервал 2,6–213, p = 0,005) [28].
Дійти висновку щодо допамін-чутливості або допамін-рефрактерності шоку необхідно протягом 1 години. Причинами рефрактерності до допаміну можуть бути: глибокий ацидоз (рН < 7,2), неусунені електролітні розлади (гіпо- або гіперкаліємія, гіпонатріємія, гіпокальціємія); гіпоглікемія; розлади судинного тонусу, депресія міокарда тощо. У таких випадках, як правило, необхідно забезпечувати корекцію грубих водно-електролітних розладів. При рН < 7,2 можлива корекція ацидозу гідрокарбонатом натрію. Доза натрію гідрокарбонату розраховується за формулою:
4,2% NaHCO3 (мл) = (НСО3 бажаний – НСО3 пацієнта) × МТ × Кпкр,
де НСО3 бажаний — бажаний рівень стандартного бікарбонату; НСО3 пацієнта — рівень стандартного бікарбонату пацієнта; МТ — маса тіла; а Кпкр — коефіцієнт, який відображає кількість позаклітинної рідини в організмі пацієнтів обраної вікової категорії (у новонароджених — 0,8, у немовлят у віці 1–6 міс. — 0,6, від 6 міс. до 3 років — 0,5, від 3 до 14 років — 0,4).
Менш виражений ацидоз може усуватися за допомогою розчинів, які містять лактат або ацетат натрію, але необхідно пам’ятати, що типовий для СШ лактат-ацидоз відбиває наявність тканинної гіпоксії та вуглеводного гіперметаболізму, отже, саме усунення причин ацидозу є запорукою стійкої нормалізації показників кислотно-основного стану.
При гіпокальціємії вводиться глюконат кальцію дозою 1,0 мл/кг маси тіла або хлорид кальцію дозою 0,5 мл/кг маси тіла повільно внутрішньовенно [18]. Рівень натрію бажано підтримувати у фізіологічних межах (140–145 ммоль/л), особливо небезпечною є гіпонатріємія, адже вона здатна підсилювати внутрішньочерепну гіпертензію та викликати судоми. Гіпокаліємія найбільш часто розвивається після стабілізації гемодинаміки та перфузії й може дуже негативно впливати на роботу міокарда, аж до розвитку фатальних аритмій. Розвиток гіпокаліємії пов’язаний з нормалізацією кислотно-основного стану, що призводить до повернення калію до внутрішньоклітинного простору, розвитком гіпер–альдостеронізму, безконтрольним призначенням петльових та осмодіуретиків з метою дегідратації. За умов відновлення діурезу при гіпокаліємії калій призначається у складі добової інфузії з розрахунку 3–4 ммоль/кг маси тіла за добу.
Подальша підтримка гемодинаміки здійснюється на підставі визначення патологічного типу гемодинамічного профілю. Можливі три його варіанти. Відомо, що, на відміну від дорослих, у дітей з рідинно-рефрактерним допамін-резистентним шоком найбільш поширений (58 %) тип гемодинамічних розладів — це низький серцевий викид та високий периферичний судинний опір. Саме цей гемодинамічний профіль асоціюється з найбільшою летальністю. Ще 22 % дітей мають низький серцевий викид та низький периферичний судинний опір. І лише близько 20 % дітей мають гемодинамічний профіль у вигляді високого серцевого викиду та низького периферичного опору [18].
Перший профіль. Низький серцевий викид та високий периферичний судинний опір. Його клінічні ознаки: наявність мікроциркуляторних розладів (холодні кінцівки, подовжений час заповнення капілярів, плямиста волога шкіра) та нормальний артеріальний тиск. Лікування полягає в титруванні адреналіну дозою від 0,1 до 2 мкг/кг/хв у поєднанні з нітратами або нітропрусидом.
Другий профіль. Низький серцевий викид та низький периферичний судинний опір. Його клінічні ознаки: наявність мікроциркуляторних розладів (холодні кінцівки, подовжений час заповнен–ня капілярів, плямиста волога шкіра) та низький артеріальний тиск. Лікування полягає в титруванні адреналіну дозою від 0,1 до 2 мкг/кг/хв.
Третій профіль. Високий серцевий викид та низький периферичний судинний опір. Його клінічні ознаки: теплі кінцівки, швидке заповнення капілярів та низький артеріальний тиск. Лікування полягає в титруванні норадреналіну дозою від 0,1 до 2 мкг/кг/хв [18, 25].
Мета використання інотропів — підтримання серцевого викиду в межах 3,3–6,0 л/хв/м2. Показано, що при допамін-рефрактерному шоку забезпечення цільових позначок серцевого викиду сприяє покращенню прогнозу. У цілому в дітей, на відміну від дорослих, високе споживання кисню детермінується збільшенням його доставки, а не екстракції [18]. Ефективним критерієм достатності серцевого викиду є величина сатурації крові з центральної вени (SсVO2) понад 70 %. Якщо попри застосування інотропів зберігається низька SсVO2 та гематокрит менше від 0,3, показана трансфузія еритроцитарної маси [25].
Мета застосування вазоактивних засобів — підтримання САТ понад 65 мм рт.ст. та індексу загального периферичного опору в межах 800–1600 дін × с × см2/м-5.
Усі хворі, які потребують інотропної та вазопресорної підтримки, мають бути забезпечені інвазивним моніторингом АТ в умовах відділення інтенсивної терапії.
Згідно з рекомендаціями NICE та SIGN, на відміну від вітчизняного наказу № 737, глюкокортикоїди у високих дозах не рекомендують рутинно вводити дітям з менінгококовою септицемією [15]. Недостатність надниркових залоз має бути запі–дозрена при катехоламін-резистентному гіпотензивному шоку. Отже, лише при підозрі на наявність недостатності надниркових залоз та/або рефрактерності до симпатоміметиків доцільне призначення гідрокортизону дозою 1–2 мг/кг (до 300 мг/добу) болюсно або у вигляді інфузії внутрішньовенно (рівень доказовості 2C) [15, 18, 25].
Збереження ознак шоку попри забезпечення адекватного переднавантаження та використання адреналіну/норадреналіну вимагає детального аналізу та обстеження з метою виявлення та усунення можливих чинників рефрактерності (напружений пневмоторакс, тампонада серця, прихована кровотеча, внутрішньоабдомінальна гіпертензія понад 12 мм рт.ст., гіпотиреоз, наявність значної маси некротизованих тканин). При низьких рівнях тироксину та трийодтироніну показане пероральне або парентеральне застосування L-тироксину [18].
При виключенні наведених чинників рефрактерності шоку та з огляду на потенційно фатальний наслідок при катехоламін-рефрактерному шоку провідні фахівці розглядають такі альтернативні втручання:
— використання препаратів з іншими механізмами інотропної дії (інгібітори фосфодіестерази — мілринон (на жаль, не має реєстрації в Україні) або сенситизатори кальцію — левосимендан) при рефрактерній депресії міокарда [18, 25];
— використання препаратів вазопресину (вазопресин, аргінін-вазопресин, терліпресин також не мають реєстрації в Україні) при рефрактерній до норадреналіну вазоплегії [18, 25];
— використання екстракорпоральної мембранної оксигенації та штучного кровообігу в дітей з катехоламін-резистентним шоком, що також вважаються потенційно рятівними методами інтенсивної терапії [18].
Клінічними ознаками ефективності лікування шоку є також досягнення кінцевих терапевтичних пунктів, а саме:
— швидкість заповнення капілярів < 2 c;
— нормальний пульс на артеріях з відсутністю різниці між центральним та периферичним пульсом;
— потепління кінцівок;
— нормалізація психічного статусу;
— діурез понад 1 мл/кг/год [18, 25].
Кінцевою метою лікування СШ у дітей вважають: відновлення нормальної перфузії та перфузійного тиску ПТ (ПТ = САТ – ЦВТ), усунення тканинної гіпоксії (SсVO2 понад 70 %) та підтримання СІ у межах 3,3–6,0 л/хв/м2 [18].
З метою ілюстрації ефективності цілеспрямованої корекції гемодинаміки при менінгококовому СШ у дитини за допомогою моніторингу серцевого викиду неінвазивним методом (esCCO — Estimated Continuous Cardiac Output) наводимо наступний клінічний приклад.
Дитина Г., 1 рік 1 міс. Надійшла до ВІТ КЗОЗ «Харківська обласна дитяча інфекційна клінічна лікарня» 12.01.2016 на першу добу захворювання з діагнозом: менінгококова інфекція, менінгококцемія, тяжка форма, синдром Уотрехауса — Фрідеріксена, септичний шок (рис. 2).
З моменту надходження катетеризовано підключичну та периферичну (кубітальну) вени, набрано кров на біохімічне дослідження, розпочата інфузійна та антибактеріальна терапія. Стан дитини розцінено як дуже тяжкий, що обумовлено «холодним» СШ, ДВЗ-синдромом, гострою недостатністю надниркових залоз, гострим пошкодженням нирок (ступень R за шкалою RIFLE). Оцінка за шкалою SOFA 11 балів (прогнозована імовірність летального кінця до 69 %), оцінка за шкалою GMSPS 7–8 балів (прогнозована імовірність летального кінця до 70 %).
Рівень свідомості 9–10 балів за шкалою коми Глазго в педіатричній модифікації, менінгеальні знаки негативні. Маса тіла 10,5 кг. Аксилярна температура тіла 36,7 °С, ректальна — 38,9 °С. Шкіра та слизові оболонки бліді, на обличчі, тулубі та кінцівках рясна геморагічна висипка з некрозами, кінцівки холодні, виражені розлади мікроциркуляції, час заповнення капілярів понад 3 с. ЧСС 156 за 1 хв, АТ 73/41 мм рт.ст., тахіпное — 48 за 1 хв, SpO2 88 % при FiO2 0,4. У клінічному аналізі крові: гемоглобін 94 г/л, еритроцити 3,3 • 1012/л, тромбоцити 60 • 109/л, лейкоцити 3,8 • 109/л, паличкоядерні нейтрофіли 3 %, сегментоядерні нейтрофіли 44 %, еозинофіли 1 %, лімфоцити 46 %, моноцити 6 %, ШОЕ 3 мм/годину. Коагулограма: час згортання крові 7 хв, протромбіновий індекс 65 %, фібриноген 2,22 г/л. Біохімічний аналіз крові: гематокрит 0,29, глюкоза 5,8 ммоль/л, загальний білок 52,5 г/л, С-реактивний білок 48 мг/л, сечовина 16 ммоль/л, креатинін 158 мкмоль/л, АЛТ 17,9 Од/л, АСТ 40,6 Од/л, загальний білірубін 10,9 мкмоль/л, К+ сироватки 3,3 ммоль/л, Na+ сироватки 136 ммоль/л, іонізований Са++ сироватки 0,98 ммоль/л, Сl– сироватки 104 ммоль/л.
Проведено інфузійну терапію сольовими розчинами (розчин Рінгера, 0,9% розчин NaCl, реосорбілакт) у загальному об’ємі 600 мл за 1 годину, тобто 60 мл/кг маси тіла, призначена антибактеріальна терапія цефотаксимом. Здійснюється моніторинг АТ, ЧСС, електрокардіограми, частоти дихання, SpO2 та серцевого викиду (монітор Vismo Nichon Conden).
Як видно з табл. 3, інфузійна терапія не сприяла виведенню дитини зі стану СШ, отже, він був визнаний рідинно-рефрактерним. Після чого була розпочата інфузія допаміну з титруванням дози з 10 до 16 мкг/кг/хв, дитину переведено на штучну вентиляцію легенів.
/15-1.jpg)
Попри це зберігалися розлади мікроциркуляції та показник САТ – ЦВТ лишався нижчим за рекомендований. Отже, шок визнаний допамін-резистентним. За клінічними ознаками мав місце профіль недостатнього серцевого викиду при нормальному артеріальному тиску, що потребувало заміни допаміну на адреналін у невеликих дозах, що сприяло зростанню серцевого викиду понад 5 л/хв/м2 та нітратів для зниження післянавантаження. На тлі проведеної терапії через 6 годин після початку ІТ були досягнуті цільові показники серцевого викиду та САТ – ЦВТ та констатовані клінічні ознаки виходу зі стану СШ. На другу добу о 9:00 проведено ехокардіоскопію: ЧСС 149 уд/хв, ударний об’єм лівого шлуночка 17 мл, ФВ 61 %, серцевий індекс 5,1 л/хв/м2. На час проведення ехокардіоскопії неінвазивний СІ за технологією esCCO становив 5,2 л/хв/м2. У подальшому стан дитини поступово покращувався, респіраторна підтримка тривала 8 діб. Дитина одужала.
Лікування ДВЗ-синдрому. Основним препаратом для відновлення факторів коагуляції та природних антикоагулянтів є свіжозаморожена плазма (СЗП), що призначається за наявності геморагічного синдрому, при зниженні фібриногену < 1,2 г/л та протромбінового індексу < 55 %. Добова доза СЗП становить 10–30 мл/кг маси тіла. Критерієм ефективності терапії буде підвищення рівня фібриногену до 1,5–2 г/л, протромбінового індексу — понад 60 %, припинення кровотечі зі слизових, місць ін’єкцій. Доцільно нагадати читачеві, що плазма має бути швидко розморожена при температурі 37 °С та максимально швидко (зважаючи на можливість перевантаження кровообігу) введена. Крім можливого об’ємного перевантаження СЗП містить фактори комплементу та здатна значно ушкоджувати ендотелій судин і погіршувати функцію легенів. Отже, СЗП протипоказана, коли показань для її застосування немає! Замість СЗП для зупинки геморагічного синдрому та усунення дефіциту факторів згортання може бути застосований кріопреципітат дозою 15–100 ОД/кг/добу. Тромбомаса призначається при наявності кровотечі та тромбоцитопенії < 50 • 109/л. У дітей застосовується лише нефракціонований гепарин, дозування якого залежить від фази ДВЗ-синдрому. При гіперкоагуляції дози сягають 200 ОД/кг/добу, при гіпокоагуляції — 30–50 ОД/кг/добу, краще шляхом постійної інфузії за допомогою інфузійного насоса. При наявності кровотечі гепарин протипоказаний. Слід зазначити, що доказова база наведених рекомендацій ІТ ДВЗ-синдрому при МІ відсутня та вищезазначена терапія призначається здебільшого традиційно [15].
Кортикостероїди. Ми вже виклали сучасні рекомендації щодо застосування гідрокортизону при гострій недостатності надниркових залоз. Але існує ще одне показання для призначення стероїдів — зменшення кількості ускладнень гнійного менінгіту (ураження кортієвого органу та розвитку глухоти). У таких випадках призначається дексаметазон у дозі 0,4 мг/кг маси тіла двічі на добу протягом двох діб або 0,15 мг/кг кожні 6 годин протягом чотирьох діб [15].
Забезпечення пластичних та енергетичних потреб. Для запобігання транслокації кишкової флори показане раннє ентеральне зондове харчування з використанням елементних або напівелементних дієт, яке слід розпочинати після стабілізації гемодинаміки, за відсутності парезу кишечника та шлунково-кишкової кровотечі. За наявності респіраторного дистрес-синдрому дітей (РДСД) доцільно застосовувати харчування, збагачене ω-3 та ω-6 жирними кислотами. При неможливості ентерального харчування використовується збалансоване парентеральне харчування, що також розпочинається після стабілізації гемодинаміки й усунення грубих метаболічних та електролітних розладів.
Респіраторна підтримка. На догоспітальному етапі хворі на тяжкі та блискавичні форми МІ потребують інгаляції зволоженого кисню та підтримки прохідності дихальних шляхів. У випадках вкрай тяжкого стану рішення про інтубацію трахеї й початок штучної вентиляції приймається на підставі клінічних даних: збільшеної роботи дихання, ослаблення рефлексів з боку дихальних шляхів, порушення свідомості або наявності термінального стану. Близько 60 % дітей, які надходять до відділень інтенсивної терапії з приводу МІ, потребують проведення респіраторної підтримки [29]. Своєчасний її початок відіграє важливу роль у зниженні летальності. Показаннями для початку респіраторної підтримки є збереження СШ попри інфузію 5% альбуміну в об’ємі 40 мл/кг маси тіла [15], допамін-рефрактерний шок, розвиток респіраторного дистрес-синдрому дітей, розлади свідомості (8–10 балів за шкалою коми Глазго) та ознаки значної внутрішньочерепної гіпертензії, тривалі судоми, рідинне перевантаження з ознаками гемодинамічного набряку легенів. Підготовка до інтубації трахеї включає обов’язкове спорожнення шлунка. Під час інтубації трахеї інфузійна терапія та інотропна підтримка мають тривати. Для премедикації доцільно застосовувати атропін 0,01–0,02 мг/кг. Під час інтубації обов’язково виконувати прийом Селліка. Найбільш безпечними засобами для ввідної анестезії є кетамін 2 мг/кг та/або оксибутират натрію 100–150 мг/кг внутрішньовенно. Введення пропофолу та барбітуратів на тлі нестабільної гемодинаміки необхідно вважати помилковим. Інтубація трахеї здійснюється переважно оротрахеальним шляхом. Наступна респіраторна підтримка має проводитися відповідно до вимог легенево-протективної вентиляції з метою запобігання баротравмі, волюмотравмі, ателектотравмі, біотравмі та забезпечення прий–нятного газообміну.
При вираженій (понад 20 мм рт.ст.) внутрішньочерепній гіпертензії необхідно забезпечити нормовентиляцію (РаСО2 38–42 мм рт.ст.) та адекватну оксигенацію (РаО2 80–100 мм рт.ст., SpO2 = 98–99 %). Короткочасна гіпервентиляція виправдана при ознаках уклинення. Наявність внутрішньочерепної гіпертензії не є протипоказанням для застосування позитивного тиску в кінці видиху, коли це необхідно для підтримки стабільності альвеол та адекватної оксигенації. Хворим, які потребують респіраторної підтримки та залишаються в критичному стані, показана седація (1D) [25].
Обмеження та лікування некротичного ураження шкіри та м’яких тканин. Обмеження площі та глибини некрозів при МІ є ще одною проблемою, що далека від вирішення. Існують лише окремі публікації щодо спроб вплинути на розмір некрозів. Зокрема, відзначається, що ранній мікрохірургічний артеріолізис є прийнятним методом, здатним зменшити частоту ампутацій, необхідних хворим на МІ, що суттєво покращує функціональний результат дітей [30]. Також відомі окремі повідомлення щодо успішного застосування гіпербаричної оксигенації [31]. За рекомендаціями SIGN (Scottish Intercollegiate Guidelines Network, Management of invasive meningococcal disease in children and young people) доцільно проводити контроль тиску в тканинних компартментах кінцівок при масивних циркуляторних некрозах та виконувати ранні фасціотомії для запобігання масивним некрозам м’язів [15].
Лікування значних за площиною некрозів проводиться сумісно з комбустіологами шляхом місцевої антисептичної терапії, застосування функціональних ліжок типу «клінітрон», некректомії, закриття дефектів шкіри аутодермотрансплантатами [32].
Експериментальні методи терапії. До експериментальних методів ІТ МІ належать переважно екстракорпоральні методи гемокорекції та екстракорпоральна мембранна оксигенація. Невеличка низка досліджень, у які входила незначна кількість пацієнтів (від 3 до 13), демонструвала позитивний вплив плазмаферезу та плазмафільтрації на перебіг ДВЗ-синдрому та навіть наслідки МІ [33]. Проте останнє, найбільше дослідження плазмообміну в поєднанні із стандартною терапією при тяжкому сепсисі в дітей не продемонструвало позитивного впливу на 28-денну летальність [34]. Згідно з рекомендаціями SIGN, плазмаферез не є стандартною терапією, його застосування має бути обмежене клінічними дослідженнями [15].
Високооб’ємна вено-венозна гемофільтрація, як свідчать окремі повідомлення та власний досвід авторів, також є методом ІТ, що дає підстави сподіватися на можливість покращення результату СШ при МІ, проте контрольовані дослідження, які б підтвердили це, відсутні. Відповідно до рекомендацій SIGN вона може бути застосованою в дітей з катехоламін-залежним СШ, тяжким метаболічним ацидозом, гострим пошкодженням нирок та проблемами із забезпеченням рідинного балансу [15].
Екстракорпоральна мембранна оксигенація в поодиноких невеликих дослідженнях здатна була покращити результат у хворих із тяжким перебігом РДСД на тлі МІ. За рекомендаціями SIGN, цей метод не є стандартним, але може бути розглянутий у хворих, які не відповідають на адекватне лікування РДСД [15].
З огляду на обмежені матеріально-технічні можливості вітчизняної системи охорони здоров’я лише рання діагностика, раціональна антибактеріальна терапія, циркуляторна та респіраторна підтримка є оптимальними методами покращення результатів лікування тяжких та блискавичних форм МІ.
На завершення хотілось би підкреслити, що навіть найтяжчі форми МІ за умов своєчасного початку лікування та проведення висококваліфікованої ІТ залишають надію на збереження життя.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hamborsky J. Centers for Disease Control and Prevention Epidemiology and Prevention of Vaccine Preventable Diseases / J. Hamborsky, Kroger A., C. Wolf [et al]. — 13th Edition. — 2015. — 375 p.
2. Outcomes of invasive meningococcal disease in adults and children in Canada between 2002 and 2011: a prospective cohort study / M. Sadarangani, D. Scheifele, S. Halperin [et al.] // Clin. Infect. Dis. — 2015. — Vol. 60(8). — P. 27-35. doi: 10.1093/cid/civ028.
3. Анализ историй болезни детей, умерших от менингококковой инфекции в Украине в 2008 г. / C. Крамарев, Р. Моисеенко, В. Педан [и др.] // Клінічна імунологія. Алергологія. Інфектологія. — 2009. — № 9(28). — C. 13-15.
4. Meningococcal Meningitis and Septicaemia. Guidance Notes. Diagnosis and Treatment in General Practice / Meningitis Research Foundation. — Updated in line with NICE Bacterial Meningitis and Meningococcal Septicaemia CG102, SIGN Meningococcal Disease Guideline 102, and NICE Feverish Illness in Children CG1602014. — BMA, 2014.
5. Rogers M. Textbook of Pediatric Intensive Care. — 5th ed. — Lippincott Williams and Wilkins, 2008. — 1710 р.
6. Avoidable Deficiencies in the Delivery of Health Care to Children With Meningococcal Disease / S. Nadel, J. Britto, R. Booy [et al.] // J. Accid. Emerg. Med. — 1998. — Vol. 15(5). — P. 298-303.
7. Reduction in case fatality rate from meningococcal disease associated with improved healthcare delivery / R. Booy, P. Habibi, S. Nadel [et al.] // Arch Dis Child. — 2001. — Vol. 85. — P. 386-390.
8. Maoldomhnaigh C. Invasive meningococcal disease in children in Ireland, 2001–2011 / C. Maoldomhnaigh, R. Drew, P. Gavin // Arch. Dis. Child. — 2016. — Vol. 101. — P. 1125-1129.
9. Andrew J. Meningococcal Disease: Methods and Protocols / J. Andrew, M. Pollard, J. Maiden. — Totowa: Humana Press, 2001. — 720 p.
10. Prognostic markers of meningococcal disease in children: recent advances and future challenges / M. Montero-Mart, D. Inwald, E. Carrol [et al.] // Expert Review of Anti-Infect. Ther. — 2014. — Vol. 12(11). — P. 1357-1369.
11. Нарушения гемодинамики при тяжелых формах менингококковой инфекции у детей // М.А. Георгиянц, И.Ю. Одинец, Д. Кухарь [и соавт.] // Врачебная практика. — 2000. — № 1. — С. 16-19.
12. Life-threatening heart failure in meningococcal septic shock in children: non-invasive measurement of cardiac para–meters is of important prognostic value / H. of ten Have, W. Wiegman, A. van den Hoek [et al.] // Eur. J. Pediatr. — 2000. — Vol. 159. — P. 277-282.
13. Myocardial depressant effects of interleukin 6 in meningococcal sepsis are regulated by p38 mitogen-activated protein kinase / P. Nazima, J. Eleftherohorinou, H. Wright [et al.] // Crit. Care Med. — 2011. — Vol. 39(7). — P. 1692-711.
14. Наказ МОЗ України № 737 від 12.10.2009. Протокол лікування менінгококцемії у дітей.
15. Management of invasive meningococcal disease in children and young peaple: A national clinical guideline / SIGN. — 2008. — 44 pp.
16. Георгіянц М. / Тяжкі форми менінгококової інфекції у дітей / М. Георгіянц [та ін.] — Харків: Золоті сторінки, 2006. — 176 с.
17. Матвеев В. Эпидемиология, клиника, диагностика, лечение и профилактика менингококковой инфекции у детей. Возможности УЗ-исследований при выявлении контингента, особо угрожаемого по развитию молниеносной менингококцемии: Учебно-метод. пособие / Матвеев В.А., Хулуп Г.Я. — Минск: БелМАПО, 2007. — 48 с.
18. Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. 2007 update from the American College of Critical Care Medicine / J. Brierley // Crit. Care. Med. — 2009. — Vol. 37. — P. 666-688.
19. Nadel S. Treatment of Meningococcal Disease. Review article / S. Nadel // J. of Adolescent Health. — 2016. — Vol. 59. — P. 21-28.
20. Normalization of plasma arginine vasopressin concentrations when children with meningitis are given maintenance plus replacement fluid therapy / K. Powell, L. Sugerman, A. Eskenazi [et al.] // J. Pediatr. — 1990. — Vol. 117. — Р. 515-522.
21. Георгіянц М.А., Корсунов В.А. Септичний шок у дітей. Принципи діагностики та інтенсивної терапії: Навчальний посібник. — Харків: Золоті сторінки, 2009. — 248 с.
22. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality / J. Boyd, J. Forbes, T. Nakada [et al.] // Crit. Care Med. — 2011. — Vol. 39(2). — P. 259-265.
23. Maric P. Noninvasive Cardiac Output Monitors: A State-of the-Art Review / P. Maric // Journal of Cardiothoracic and Vascular Anesthesia. — 2013 Feb. — 27(1). — 121-34.
24. Георгіянц М.А. Актуальні та дискусійні питання інфузійної терапії септичного шоку в дітей / М.А. Георгіянц, В. Корсунов // Медицина неотложных состояний. — 2014. — № 1(56). — С. 77-81.
25. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012 / R.P. Dellinger [et al.] // Crit. Care Med. — 2013. — Vol. 41. — P. 580-637.
26. Khilnani P. Recent advances in sepsis and septic shock / P. Khilnani, S. Deopujari, J. Carcillo // Indian J. of Ped. — 2008. — Vol. 8. — P. 821-830.
27. Double-Blind Randomized Clinical Trial Comparing Dopamine and Epinephrine in Pediatric Fluid-Refractory Hypotensive Septic Shock / K. Ramaswamy, S. Sunit, J. Muralidharan [et al.] // Pediatric Critical Care Medicine. — 2016. — Vol. 17. — P. 502-512.
28. The role of healthcare delivery in the outcome of meningococcal disease in children: case-control study of fatal and non-fatal cases / N. Ninis, C. Phillips, L. Bailey [et al.] // BMJ. — 2005. — Vol. 330. — P. 331-323.
29. Mok Q. The outcome of children admitted to intensive care with meningococcal septicaemia / Q. Mok, W. Butt // Intens. Care Med. — 1996. — № 3. — Р. 259-263.
30. Minimizing limb amputations in meningococcal sepsis by early microsurgical arteriolysis / W. Boeckx, L. Nanhekhan, G. Vos [et al.] // J. of Ped. Surgery. — 2009. — Vol. 44. — P. 1625-1630.
31. Conservative surgical management of necrotic tissues following meningococcal sepsis: Case report of a child treated with hyperbaric oxygen / I. Takas, S. Kvolik, D. Divkovic [et al.] // UHM. — 2010. — Vol. 37. — P. 95-99.
32. Фисталь Э.Я. Клинический случай менингококцемии у ребенка, осложнившийся обширным некрозом кожи / Э. Фисталь, В. Солошенко, В. Носенко // Здоровье ребенка. — 2014. — № 1(52). — С. 150-152.
33. Long E. A randomised controlled trial of plasma filtration in severe pediatric sepsis / E. Long , F. Shann, D. Buckley // Critical Care and Resuscitation. — 2013. — Vol. 15. — P. 198-204.

/10-1.jpg)
/11-1.jpg)
/12-1.jpg)
/14-1.jpg)
/15-1.jpg)