Вступ
Сепсис, згідно із сучасними уявленнями, — це загальна відповідь організму на інфекцію (Systemic Inflammatory Response Syndrome — SIRS), завжди пов’язана з присутністю в організмі інфекційного збудника, причому клінічна та метаболічна маніфестація сепсису аналогічна такій при синдромі загальної відповіді організму на запалення.
Запалення — це комплексна судинно-мезенхімальна неспецифічна реакція на пошкодження тканин, викликана інфекційними та неінфекційними агентами. Ця реакція спрямована на видалення патогенного агента, відновлення структури та функцій пошкоджених тканин (Jacobi J., 2002).
У міжнародній настанові з діагностики та лікування сепсису/септичного шоку — Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2012–2016 [4] було узгоджено клінічні критерії сепсису/септичного шоку: гіпер- чи гіпотермія, тахікардія, тахіпное (гіпокапнія), лейкоцитоз/лейкопенія та/або зсув лейкоформули (табл. 1). Незважаючи на недосконалість критеріїв SIRS (низька специфічність), їх чутливість сягає 100 %. Фізіологічні особливості вагітної жінки вносять корективи в класичну картину діагностики та лікування, відображені у вищевказаній настанові.
/41-1.jpg)
Основні механізми розвитку SIRS — це пошкодження ендотелію, активація лейкоцитів, зовнішнього й внутрішнього шляху коагуляції, порушення фібринолізу, агрегація тромбоцитів, вплив на систему комплементу, калікреїн-кінінову систему, обмін катехоламінів і глюкокортикоїдів, порушення адекватної імунної відповіді. Але пошкодження ендотелію лежить в основі як мінімум ще одного грізного критичного стану — прееклампсії (гестозу). А якщо врахувати ще й ті зміни, що виникають в організмі вагітної жінки (норма вагітності), то стають очевидними проблеми в діагностиці у вагітних ознак SIRS як компонента діагнозу «сепсис».
Натомість проблема сепсису залишається на даний час дуже гострою, у тому числі в акушерстві. На сьогодні у світі інфекції посідають третє місце в структурі материнської летальності й становлять близько 15 %.
У Росії материнська летальність, пов’язана із сепсисом під час пологів та в післяопераційному періоді, у загальній структурі материнської летальності становить 3,4 %. За даними А.В. Куликова і співавт. (2012), серед усіх пацієнток акушерського профілю, які надходили в критичному стані у відділення анестезіології, реанімації та інтенсивної терапії обласної клінічної лікарні Єкатеринбурга з лікувально-профілактичних закладів Свердловської області, у 43,2 % були гнійно-септичні ускладнення.
Мета дослідження: визначити особливості перебігу сепсису та токсико-септичного шоку у вагітних та породіль з урахуванням міжнародної настанови з лікування сепсису/септичного шоку (Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2012–2016).
Матеріали та методи
Нами обстежено 37 хворих із сепсисом, що виник унаслідок перитоніту на ґрунті хоріоамніоніту та післяпологового ендометриту, які надходили в клініку анестезіології та інтенсивної терапії Львівської обласної клінічної лікарні з 2010 по 2016 р. Усім хворим було проведено інтенсивну терапію (волемічну ресусцитацію, кардіореспіраторну підтримку, антибіотикотерапію та інше) та операційне втручання (усунення причин перитоніту, санація та дренування черевної порожнини). Загальний стан хворих оцінювали в 14,5 ± 1,5 бала за шкалою АРАСНЕ ІІ, а стан поліорганної дисфункції оцінювали в 5,0 ± 1,0 бала за шкалою SOFA.
Результати
Фізіологічні зміни в організмі вагітної суттєво впливають на діагностику та лікування сепсису. Якщо ще врахувати особливості антибіотикотерапії у вагітних, то стає очевидною проблема інтенсивної терапії сепсису в даної категорії хворих:
1. Неускладненому перебігу сепсису у вагітних сприяють молодий вік, як правило, відсутність фонового захворювання, обмеження джерела інфекції (у більшості випадків — порожниною малого таза), дотримання національної програми надання допомоги вагітним та породіллям.
2. З іншого боку, швидкий прогрес септичного процесу може бути зумовлений зниженням активності клітинної ланки імунітету у вагітних (зміни співвідношення Th1 : Th2), схильністю до внутрішньоклітинних збудників (бактерії, віруси, паразити), лейкоцитозом, збільшенням кількості D-димерів, дисфункцією ендотелію, зниженням рівня антитромбіну ІІІ, протеїнів С і S, активності фібринолізу, зростанням під час пологів рівня прозапальних цитокінів. До цього ще слід додати наявність запальної реакції при ускладненнях вагітності (прееклампсія, еклампсія, HELPPE-синдром) — «материнська відповідь на запалення» (MSIR — maternal systemic inflammatory response).
3. Системні прояви (у тому числі й розвиток поліорганної дисфункції) можуть значно випереджати локальні зміни гнійного джерела.
4. Можна погодитись з А.В. Куликовим і спів–авт. (2012) у тому, що розвиток сепсису/септичного шоку при первинному джерелі інфекції в матці далеко не завжди супроводжується симптомами «класичного» метроендометриту, що утруднює діагностику та затримує радикальну санацію джерела інфекції, сприяючи прогресуванню поліорганної дисфункції [1].
За даними ряду авторів [3], питання про санацію первинного джерела інфекції оптимально вирішити в перші 6 годин перебування пацієнта у відділенні анестезії, реанімації та інтенсивної терапії. При розвитку тяжкого сепсису/септичного шоку мова іде не про локальне гнійне джерело, а про загальну відповідь організму на запалення. У такому випадку традиційні симптоми післяродового ендометриту можуть бути стертими й невираженими. Слід зауважити, що і бімануальне дослідження, і ультрасонографія матки не завжди дають необхідну інформацію. Також існує велика ймовірність вторинного інфікування.
Нижче наведено не абсолютні показання до гістеректомії, а ті клінічні ситуації, що вимагають відповіді на питання про необхідність проведення операційного втручання.
Ситуації, при яких слід вирішити питання про доцільність гістеректомії:
— крім матки, не виявлено інших джерел інфекції, які б були причиною тяжкості стану;
— при невідповідності погіршення стану пацієнтки і симптомів основного захворювання (наростання органної дисфункції);
— наростання симптомів загальної відповіді організму на запалення, незважаючи на адекватно інтенсивну терапію;
— наростання рівня С-реактивного білка та прокальцитоніну;
— антенатальна смерть плода на фоні інфекційного процесу будь-якої локалізації;
— ознаки появи або прогресування поліорганної дисфункції.
Первинним джерелом сепсису в акушерстві зазвичай є вагітна, післяабортна або післяродова матка. Ознаки класичної септичної матки: наявність гнійного чи гнійно-некротичного запалення децидуальної оболонки й міометрію, як правило, поєднується з тромбофлебітом вен матки та малого таза. Морфологічними наслідками SIRS є васкуліти, інтерстиційне запалення, гіперплазія лімфоїдної тканини та органів кровотворення. Компонентом септичного шоку зазвичай є ДВЗ-синдром. Залежно від переважаючого процесу (коагуляція чи фібриноліз) проявами ДВЗ-синдрому будуть утворення фібринових згортків у мікроциркуляторному руслі або коагулопатичні кровотечі.
Показання до органозберігаючої тактики:
— верифіковане/сановане інше джерело інфекції, що зумовлювало тяжкість стану хворої;
— стабільні показники SIRS;
— не прогресує синдром поліорганної дисфункції;
— не зростає рівень прокальцитоніну;
— живий плід;
— нема клініки септичного шоку.
Проаналізувавши загальноклінічні ознаки сепсису, зауважимо, що у вагітних та породіль є певні особливості. У першому триместрі вагітності задишка турбує близько 15 % жінок. До 19 тижнів вагітності прояви задишки мають до 50 % жінок, а до 31 тижня — 75 % жінок. У 60 % вагітних задишка виникає тільки при фізичному навантаженні, а у 20 % — у спокої (табл. 2).
Збільшення ЧСС є нормальним проявом третього механізму (об’єм циркулюючої крові (ОЦК) — перший, скоротлива здатність міокарда — другий) регуляції серцевого викиду, це так звана ритмоінотропна залежність. Вона характеризується ростом сили серцевих скорочень у міру збільшення їх частоти. (Тахікардію вагітних, крім патологічних тахікардій, не коригувати.)
В організмі вагітної іони натрію накопичуються в позаклітинному просторі (інтерстицій та внутрішньосудинне русло), у результаті чого тканини стають гідрофільними, розвиваються фізіологічні набряки.
Розглядаючи ознаки запалення як критерії діагностики сепсису, слід зауважити, що при нормальному перебігу вагітності зростає кількість лейкоцитів. До 30-го тижня вагітності кількість лейкоцитів зростає до 12–16 тис. кл. (табл. 3).
Питання волемічної ресусцитації до цього часу є актуальним та викликає немало дискусій у літературі [2]. E.P. Riversetal. у 2001 році в надзвичайно рейтинговому журналі N. Eng. J. Med. опублікував статтю, що дотепер цитується різними авторами, і на її основі було розроблено загальновідомий алгоритм волемічної та інотропної терапії хворих із сепсисом/септичним шоком. В основі цього алгоритму — досягнення рівня центрального венозного тиску (ЦВТ) 8–12 мм рт.ст. Ми вважаємо, що оптимальними орієнтирами адекватної інфузійної терапії є середній АТ > 65–70 мм рт.ст. і темп сечовиділення > 0,5–1 мл/кг/год.
Визначаючи ЦВТ, ми вимірюємо лише внутрішньосудинний тиск, але не можемо судити про внутрішньосудинний об’єм. Лише визначивши ЦВТ-ТМТ (Рpl), ми отримаємо уявлення про наповнення центрального венозного русла.
J.H. Boydetal (2011) вказує, що ЦВТ у хворих із септичним шоком корелював із водним балансом лише в перші 12 год інфузійної терапії. У наступні 4 дні позитивний водний баланс, що ґрунтувався на ЦВТ, був пов’язаний із ризиком збільшення летальності. Дослідник робить висновок, що ЦВТ можна використовувати для контролю інфузійної терапії тільки в перші 12 год. P.E. Marik et al. на основі великого метааналізу роблять висновок про те, що моніторинг ЦВТ не може передбачити відповідь на волемічне навантаження при проведенні інфузійної терапії, тому з цією метою у клініці недоцільно використовувати ЦВТ, а M. Cessonietal (2011) вказує на те, що АТ, ЦВТ і темп сечовиділення є грубими індикаторами гемодинамічного статусу. Золотим стандартом для моніторингу відповіді на інфузійну терапію є постійне вимірювання серцевого викиду [6–8].
J.L. Vincent, D. De Backer (2013) у своїй статті «Circulatory shock» у журналі N. Engl. J. Med. виділи декілька фаз інфузійної терапії та визначили її цілі в кожній із вказаних фаз. У фазі волемічної ресусцитації основною метою є корекція шоку та рятування життя. Тривалість цієї фази, як правило, оцінюється у хвилинах, і інфузійна терапія проводиться болюсним введенням рідини. У фазі оптимізації протягом годин необхідно забезпечити тканинну перфузію шляхом титрування інфузії рідини плюс fluid challenge. А у фазі стабілізації необхідно забезпечити нейтральний або від’ємний баланс рідини шляхом мінімальної підтримуючої інфузії, якщо неможливо забезпечити пероральне вживання рідини. У подальшому (de-escalation) необхідно забезпечити виведення з організму надміру рідини та проведення нутритивної терапії (табл. 4).
/43-1.jpg)
На етапі ресусцитації у хворих із септичним шоком інфузійна терапія нами проводилася за ліберальною технологією, і при введенні кристалоїдних препаратів у дозі 25–30 мл/кг маси тіла й недосягненні середнього АТ > 70 мм рт.ст. приєднували інотропні препарати. На етапі оптимізації инфузійна терапія нами проводилася за рестриктивною технологією (1–1,5 мл/кг маси тіла) та контролювалася темпом сечовиділення пацієнтки.
Ще одним дискусійним питанням, на наш погляд, залишається якісний склад інфузійної терапії. І справа тут не лише у вічній колоїдно-кристалоїдній проблемі. Багато поколінь анестезіологів виросло з розумінням того, що 0,9% розчин NaCl є фізіологічним розчином. Останнім часом це твердження піддається серйозним сумнівам. Дедалі частіше можна почути думку, що застосування 0,9% розчину NaCl приводить до виникнення гіперхлоремічного ацидозу.
Найважливішими характеристиками кристалоїдів є ступінь збалансованості та наявність носіїв резервної лужності. Звичайно, найменш збалансованим є 0,9% р-н NaCl, але при гіперкаліємії, гіпо–хлоремічному алкалозі він має безперечну перевагу порівняно зі збалансованими розчинами. Носії резервної лужності (лактат, ацетат, малат, фумарат) — це речовини, що в процесі метаболізму перетворюються в гідрокарбонат. Збалансовані кристалоїди з високим вмістом цих речовин протипоказані хворим з алкалозом та тяжкою печінковою дисфункцією (табл. 5).
У нашій практиці лікування хворих із сепсисом/септичним шоком ми використовували розчин Хартмана, оскільки він максимально наближений за іонним складом до плазми крові та интерстицію, містить магній, що полегшує транспорт калію та не викликає гіперхлоремії.
При гіпокаліємії препаратом вибору ми вважаємо розчин Дарроу, оскільки вміст іонів калію в розчині Дарроу 36 ммоль/л, тобто з урахуванням потреби в калії (1–1,5 ммоль/ кг) він не створює виникнення небезпечного рівня гіперкаліємії.
Враховуючи низький волемічний ефект та невеликий час перебування кристалоїдів у судинному руслі, ми (після застосування кристалоїдних препаратів — 15–20 мл/кг маси тіла) використовували гідроксіетилкрохмалі (гековен) у дозі не більше ніж 5–10 мл/кг маси тіла. Незважаючи на те, що в настанові Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016 «не рекомендується» (але і не забороняється!) застосовувати гідроксіетилкрохмалі у хворих із сепсисом, ми бачили позитивний клінічний ефект при застосуванні гековену у хворих із септичним шоком, оскільки таким чином нам вдавалося швидше відновити ОЦК та забезпечити кращу перфузію периферичних органів (відновлення темпу сечовиділення > 0,5–1 мл/кг/год; зменшення часу наповнення капілярного ложа нігтя до 2 с; зниження лактату крові до 2–2,5 ммоль/л).
Респіраторну терапію проводили за технологією step by step.
Стратегічні напрямки респіраторної підтримки (step by step):
1. При SpO2 < 90 % — інгаляція зволоженого кисню від 4–6 л/хв до 10–15 л/хв.
2. При неефективності й подальшому SpO2 < 90 % — неінвазивна штучна вентиляція легень (ШВЛ) (СРАР або BiPAP).
3. При SpO2 < 90 %, участі в акті дихання допоміжної мускулатури та/або появі ознак церебральної дисфункції — інвазивна штучна вентиляція легень.
4. При SpO2 < 90 % — інвазивна ШВЛ + РЕЕР + IVR.
5. При SpO2 < 90 % — інвазивна ШВЛ + РЕЕР + IVR + FiO2 0,6.
6. При SpO2 < 90 % — інвазивна ШВЛ + РЕЕР + IVR + FiO2 0,6 + фуросемід 0,5–1 мг/кг.
7. При SpO2 < 90 % — інвазивна ШВЛ + РЕЕР + IVR + FiO2 1,0 (не більше ніж 24 год).
Інвазивна штучна вентиляція легень проводилася в режимі PCV. Намагалися досягнути цільових показників оксигенації за допомогою параметрів PCV, що подані в табл. 6.
Коли вищевказані параметри ШВЛ не забезпечували досягнення бажаних показників оксигенації, проводили їх корекцію шляхом step by step.
Корекція незадовільної оксигенації при інвазивній ШВЛ
При незадовільній оксигенації:
— ↑РЕЕР до 10–14 см вод.ст.;
— ↑Tі до 1,7–2,5 с (І : Е = 1 : 1).
Якщо і це не приводить до бажаного ↑SaO2 і PaO2:
— ↑Pcontrol до 28–30 см вод.ст.;
— ↑FiO2 до 65–70 %.
У подальшому доцільно Pcontrol утримувати в ме–жах 20–25 см вод.ст.
Як свідчать дані літератури, більше ніж у 80 % випадків збудниками сепсису є бактерії з родини Enterobacteriaceae (E.coli — 45 %, K.pneumoniae — 17; у нашому випадку E.coli виділяли в 40 %, а K.pneumoniae — у 23 %). Враховуючи те, що, за даними, продукція ESBL була виявлена у 21 % позалікарняних та 59 % нозокоміальних штамів бактерій з родини Enterobacteriaceae, при тяжкому сепсисі препаратом вибору ми вважали ертапенем, що не має антисиньогнійної активності, проте активно діє як на мікроорганізми родини Enterobacteriaceae, так і на грампозитивні мікроорганізми.
З урахуванням фармакокінетики та фармакодинаміки антибіотиків їх поділено на так звані дозозалежні та час-залежні (табл. 7).
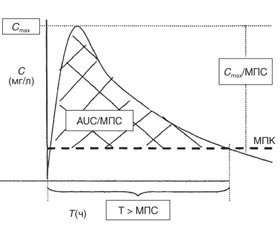
Для час-залежних антибіотиків фактором, що визначає їх клінічну ефективність, є термін, протягом якого концентрація препарату в плазмі крови перевищує мінімально пригнічуючу концентрацію (МПК) для певного збудника. Клінічна ефективність дозозалежних антибіотиків визначається площею під фармакокінетичною кривою AUC24/MПC (рис. 1).
Комбінація карбапенемів з аміноглікозидами (тобраміцином) проявляє синергізм при лікуванні хворих із гнійно-септичними процесами, які –зумовлені неферментуючими грамнегативними паличками (Ps.aeruginosa), що проявляється швидшим регресом ознак загальної відповіді на запалення, тяжкості стану та поліорганної дисфункції.
Висновки
1. В організмі вагітної/породіллі відбуваються важливі зміни (фізіологічна норма вагітної), які треба враховувати, підозрюючи в них сепсис/септичний шок.
2. Пріоритетними ознаками сепсису у вагітних/породіль є температурна реакція, рівень С-реактивного білка та прокальцитоніну.
3. Критеріями адекватної інфузійної терапії слід вважати досягнення середнього АТ > 65–70 мм рт.ст. та темпу сечовиділення > 0,5–1,0 мл/кг/год.
4. Респіраторну терапію слід проводити методом step by step, а при необхідності інвазивної механічної вентиляції легень — presser control ventilation.
5. При нозокоміальному сепсисі доцільно застосовувати комбінацію двох антибактеріальних препаратів, одним з яких може бути аміноглікозид (тобраміцин).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.

/41-1.jpg)
/42-1.jpg)
/43-1.jpg)
/44-1.jpg)
/45-1.jpg)
/45-2.jpg)