Жизнь — это борьба за выживание,
где побеждает сильнейший.
…И если мы хотим выжить,
нам надо бороться…
Исторический этюд
Сепсис был известен уже в глубокой древности. Обозначение термина происходит от греческого слова σῆψις, означающего «гниение» или «распад», был впервые использован Гомером более 2700 лет назад. Термин «сепсис» в практическое применение ввел Аристотель. Он определял сепсис как отравление организма продуктами гниения собственных тканей. Ранние греческие врачи считали, что сепсис представляет собой биологический распад, возникший внутри тела, и до Гиппократа его возникновение связывали с нарушением соотношения или состава четырех жидкостей (кровь, слизь, желчь желтая, желчь черная), определявших, по мнению древних философов (Эмпидокл), состояние здоровья или болезни человека. В трудах Гиппократа можно найти описание симптомов «гнилокровия», как именовали долгое время все формы сепсиса, дифференцируя его от бешенства и летаргии.
Позже считалось, что сепсис является результатом разложения вещества, присутствующего в миазмах, подобного смогу в воздухе, характеризующегося плохим запахом. Римский писатель Маркус Терентиус Варро, пишущий примерно в 100 г. до н.э., даже предположил, что в миазмах могут присутствовать микроорганизмы: «Некоторые мельчайшие существа, которые невозможно увидеть глазами, но которые плавают в воздухе и входят в тело через рот и нос, могут вызывать серьезные заболевания».
Гален понимал под «гнилой кровью» любые изменения, способные вызвать лихорадку. Авиценна, имея в виду «гнилокровие», описывает в «Каноне врачебной науки» различные виды лихорадки и подчеркивает необходимость точной характеристики состояния организма при этом заболевании.
В дальнейшем, до эпохи Возрождения, практически не появлялось новых идей о сущности гнилостных процессов в организме. В XVI–XVII вв. А. Паре, Парацельс, Сильвий (Sylvius F. dele Вое) высказывали предположение о «гнилокровии» как интоксикации организма химическими веществами. В конце XV века во Франции были опубликованы первые руководства по «гнилокровию», однако в них не было ничего принципиально нового об этом заболевании.
Лишь с начала XIX века в понятие «гнилокровие» стали включать только определенные виды продолжительных лихорадок. Французский врач Гаспар (Gaspard М.Н.В.) установил, что «...гной попадает в кровеносные сосуды в малых дозах, может циркулировать в них, не причиняя смерти, затем он может вызвать значительные нарушения функций, и он выталкивается из организма с любой экскрецией (особенно с мочой и калом). Однако если даже малые количества (гноя) попадут несколько раз непрерывно в организм одной и той же особы, то гной может вызвать смерть. Если же он попадет в организм в большом количестве, то смерть наступает быстрее... Большая часть симптомов, наблюдаемых при любой медленной лихорадке, может быть связана с наличием гноя в организме...» Р. Вирхов четко дифференцировал пиемию, характеризующуюся гнойным метастазированием, с септицемией, для которой метастазы не характерны.
Большой вклад в учение о сепсисе был внесен Н.И. Пироговым, который считал, что пиемия есть миазматическое заболевание, отличающееся особой прилипчивостью, продукт общего заражения организма в обширнейшем значении этого слова. Заразное начало — гипотетические миазмы (роль микробов в развитии сепсиса еще не была известна) образуются в тканях раны, подвергшихся обширному разрушению, а затем, при скоплении больных в закрытых помещениях госпиталя, накапливаются в окружающей среде и начинают поражать всех, даже не раненых. Н.И. Пирогов впервые определил значение первичного очага инфекции в патогенезе раневого сепсиса, подробно описал общие и местные его проявления, классифицировал сепсис и сформулировал передовые для своего времени принципы его лечения: «...1) пиемия — действительно миазмы — продукт гнойного заражения в широком смысле этого слова... 3) способ и механизм ее развития не всегда одно и то же; 4) источник заражения и свойства заразы также вполне вероятно различны; 5) …как бы ни были различны в своих проявлениях различные виды (формы) пиемии, все они имеют то общее, развивающиеся под влиянием миазм, переходят нередко один в другой и иногда отличаются особой заразительностью...» Н.И. Пирогов выделял две основные формы сепсиса: пиемию и септицемию (ихоремия, токсемия). Он впервые определил в патогенезе сепсиса значение первичного очага инфекции. Он писал: «…будут ли переносные нарывы внутренних органов зависеть от застоя в них (то есть в сосудах их тканей) гнойных очагов или маленьких частиц свернутой крови, в обоих случаях предполагается известный патологический местный процесс в самой ране или ее окружности». В то же время он говорил о важной роли в развитии сепсиса общего состояния организма. Н.И. Пирогов описал общие и местные проявления пиемии, сформулировал основные принципы лечения сепсиса, намного опередив своих современников.
Вторая половина, особенно конец XIX века, ознаменовалась бурным развитием микробиологии и открытием возбудителей ряда инфекционных заболеваний. И хотя «маленькие существа» — микроорганизмы впервые были визуализированы Ван Левенгуком в 1674 году с помощью самодельного микроскопа, тем не менее только через 200 лет Земмельвейс, Листер, Пастер и Кох в своих изысканиях фактически начали связывать микроорганизмы с сепсисом.
Наконец, в 1914 году Шоттмюллер (Schottmuller) впервые предложил сепсис связывать с ответом хозяина на инфекцию, заявив: «…о сепсисе можно говорить тогда, когда в организме есть очаг инфекции, из которого постоянно и периодически в кровь поступают бактерии, вследствие чего и возникают субъективные и объективные симптомы заболевания». Он ввел понятие септического очага. Согласно его взглядам, сепсис развивается при воздействии на организм микробов, поступающих из первичного очага, отведя макроорганизму пассивную роль. Дальнейшие исследования показали, что трактовать течение сепсиса только с микробиологических позиций нельзя. В первой половине ХХ века исследователи стали сосредоточивать свое внимание не только на изучении возбудителей, но и на состоянии макроорганизма.
Макробиологическая теория И.В. Давыдовского (1928) внесла существенный вклад в понимание вопросов патогенеза сепсиса; согласно ей сепсис стал трактоваться как общее инфекционное заболевание, обусловленное неспецифической реакцией организма на попадание в кровоток различных микроорганизмов и их токсинов. В середине ХХ века в вопросе патогенеза сепсиса возник ряд разночтений, взгляды ученых разделились на две группы, одни были сторонниками бактериологической теории, другие — токсической. Согласно бактериологической концепции, бактериемия считалась постоянным или непостоянным специфическим симптомом сепсиса.
С точки зрения токсической теории (Савельев В.С. с соавт., 1976), основное место в патогенезе отводится не микробному фактору, а влиянию экзо- и эндотоксинов. Токсическая концепция не отвергала значение микробной инвазии, но основная роль отводилась интоксикации организма токсинами. Некоторые исследователи вообще предлагали отменить понятие «сепсис», заменяя его другими терминами.
Аллергическая теория (Royx I.C., 1983) предполагала, что патогенетические сдвиги в организме обусловлены реакцией аллергического типа на бактериальные токсины.
Нейротрофическая теория (Сперанский Г.Н. и др., 1937) основывается на работах И.П. Павлова, в которых показано главенствующее значение центральной нервной системы (ЦНС) в развитии патологии вообще. Согласно данной теории основная роль в развитии сепсиса отводится состоянию ЦНС и периферической нервной системы.
Цитокиновая теория (Ertel W., 1991) в настоящее время занимает доминирующее положение. Согласно данной теории эндотоксины бактерий вызывают поступление в кровь большого количества цитокинов. Они являются веществами, которые регулируют иммунитет. В результате увеличения в крови цитокинов поражается эндотелий и развивается синдром системной воспалительной реакции и иммунодепрессия.
Важным шагом можно считать принятие в Чикаго в 1991 году решения согласительной конференции, посвященной унификации клинических представлений о сепсисе и связанных с ним состояний. Были определены основные понятия и термины, которыми рекомендуется пользоваться, предложена удобная классификация. Последний пересмотр состоялся в 2016 году (Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016), опубликован 18 января 2017 года в журнале Intensive Care Med [1].
Определения и понятия
Сепсис — генерализованное инфекционное заболевание, не имеет склонности к самоликвидации (самовыздоровлению).
В.Г. Бочоришвили (1978) дал следующее определение: «Сепсис — такая клиническая форма любого инфекционного заболевания, при которой либо с тяжелым преморбидным состоянием (диабет, травма и т.д.), или из-за высокой вирулентности большое количество микробов (резистентность организма настолько сорвана), микробные очаги воспаления с мест их уничтожения превращаются в места размножения и повторных распространений. В связи с этим процесс теряет цикличность и без искусственного подавления возбудителя или искусственного повышения иммунитета приводит человека к смерти».
Н.А. Бубнова и соавторы (2016) трактуют сепсис в свете современных представлений как установленный (или предполагаемый) очаг инфекционного процесса, приведший к развитию синдрома системной воспалительной реакции (SIRS) (2 показателя и более). При недоказанной инфекционной природе SIRS для постановки диагноза «сепсис» целесообразно выполнение количественного прокальцитонинового теста. При концентрации прокальцитонина 2 нг/мл и более тест считается положительным [2].
В соответствии с решением согласительной конференции Американской ассоциации пульмонологов и Общества специалистов критической медицины (ACCP/SCCM, Чикаго, 1991): сепсис — это патологический процесс, в основе которого лежит реакция организма в виде генерализованного (системного) воспаления на инфекцию различной природы (бактериальную, вирусную, грибковую). Сепсис — одна из форм такой реакции, при которой как минимум два симптома SIRS развиваются в ответ на локальный инфекционный процесс. Локальное воспаление, сепсис, тяжелый сепсис и септический шок — это различные формы выраженности воспалительной реакции организма на инфекционный процесс. Тяжелый сепсис и септический шок являются наиболее тяжелыми формами такой реакции и сопровождаются нарушениями функций, дистантных от основного инфекционно-воспалительного процесса систем и органов.
В 2014 году была образована группа из 19 экспертов в области интенсивной терапии, хирургии, инфекционных болезней и пульмонологии, которые после 2 лет исследовательской работы вышли с предложениями о введении в клиническую практику новых определений. Быстрая оценка SOFA (Sepsis organ failure assessment) (quickSOFA или qSOFA) была введена группой Sepsis-3 на 45-м конгрессе Society Critical Care Medicine (SCCM) в феврале 2016 года в качестве упрощенной версии показателя SOFA и первичного способа выявления пациентов с высоким риском неблагоприятного исхода при инфицировании [1, 3]. Определения критерия SIRS при сепсисе заменяются, поскольку они, как было установлено, имеют слишком много ограничений: «Текущее использование двух или более критериев SIRS для выявления сепсиса было единодушно рассмотрено целевой группой как бесполезное». QSOFA значительно упрощает оценку SOFA, включая только 3 клинических критерия с включением «любого измененного сознания» вместо требования GCS ≤ 13. QSOFA может легко и быстро воспроизводится у любого пациента. Также исключается понятие «тяжелый сепсис». Сепсисом предлагается, согласно International Guidelines for Management of Sepsis and Septic Shock 2016, называть угрожающую жизни органную дисфункцию, вызванную нерегулируемым ответом организма на инфекцию [4–6]. А септический шок — вариант сепсиса, развивающегося в результате гипоперфузии тканей, сопровождающегося гипотензией, нуждающейся в применении вазопрессоров, и повышенным уровнем лактата ≥ 2 [1–3].
Предложение исключения симптомов SIRS вызвало неоднозначную реакцию в медицинском сообществе, несмотря на одобрение 31 общественной организации. Это обусловлено тем, что базовыми для большинства национальных и международных рекомендаций являются определения ACCP/SCCM 1991 года. Таким образом, в настоящее время нет однозначного мнения о необходимости и целесообразности перехода на использование Sepsis-3. Следует отметить, что в Международной классификации болезней 10-го пересмотра критерии SIRS включены в разделы R57.2 — септический шок, R65(0–5) — синдром системной воспалительной реакции с последующей детализацией.
Классификация сепсиса
По клиническому течению различают сепсис:
— молниеносный — характерно чрезвычайно бурное начало и быстро прогрессирующее течение, комплекс клинических симптомов появляется за несколько часов, максимум через 1–2 дня с момента внедрения инфекции, часто заканчивается смертью больного;
— острый — клинические симптомы проявляются в течение нескольких дней, протекает более благоприятно, длится 2–4 недели;
— подострый — процесс развивается медленно, в течение нескольких недель, симптомы менее выражены, длительность заболевания — от 6 до 12 недель;
— хронический — в случаях, когда не удалось ликвидировать острый сепсис, он переходит в хроническую форму (сроки — более 3 месяцев), протекает с мало выраженной клинической симптоматикой и нередкими ремиссиями, заболевание продолжается несколько лет;
— рецидивирующий сепсис характеризуется сменой периодов обострений и периодов ремиссий;
— как особая форма хронического воспаления выделяется sepsis lenta.
По времени развития:
— ранний (развился до 10–14 дней с момента повреждения);
— поздний (развился позднее 2 недель с момента повреждения или гнойно-септического заболевания).
При наличии на месте входных ворот возбудителя инфекции первичного септического (гнойного) очага, обусловливающего развитие сепсиса, говорят о вторичном сепсисе; при отсутствии видимого септического очага сепсис условно называют первичным или криптогенным.
По характеру входных ворот возбудителя заболевания различают сепсис раневой и возникший на почве гнойно-воспалительных заболеваний различных органов; своеобразным видом сепсис является ожоговый сепсис.
В зависимости от локализации первичного очага инфекции различают сепсис:
— одонтогенный (первичный очаг локализуется в полости рта);
— отогенный (возникающий как осложнение острого или хронического гнойного отита);
— риногенный (первичный очаг локализуется в полости носа и придаточных пазухах);
— тонзиллогенный (первичный очаг в миндалинах, чаще — небных);
— уросепсис (первичный очаг в почках и мочевых путях);
— акушерско-гинекологический (первичный очаг в матке или ее придатках);
— пупочный (наиболее частый у детей первого года жизни; первичный очаг локализуется в месте отделения культи пуповины);
— эндокардиальный (очаг инфекции локализуется в эндокарде, главным образом в клапанах сердца);
— ангиогенный (первичный очаг инфекции расположен внутри сосудов; нередко возникает как результат внутрисосудистых инструментальных исследований и длительного стояния центрального венозного катетера и т.д.);
— кожный (первичный очаг формируется в коже в виде пиодермии, гнойного пустулеза, фурункулов);
— кишечный (первичным очагом являются язвенно-некротический энтерит, колит, энтероколит).
Помимо перечисленных выше локализаций, септический очаг может находиться и в других органах при различных гнойных процессах, например гнойно-деструктивных поражениях легких, плевры, гнойном перитоните, гнойном тромбофлебите и др.
Особую группу составляет так называемый хирургический сепсис, который объединяет все случаи заболеваний сепсисом по признаку наличия первичного или метастатического гнойного очага, доступного оперативному вмешательству. Чаще всего сюда относятся раневой и послеоперационный сепсис, когда входными воротами является рана, а также сепсис, возникающий на фоне или вследствие гнойных заболеваний, например абсцесс, карбункул, остеомиелит, перитонит, флегмона, фурункул, эмпиема плевры, некротизирующая инфекция и другие.
Некротизирующая инфекция имеет множество названий, таких как антонов огонь, некротическая рожа, злокачественный отек, гангрена Фурнье, прогрессирующая гангрена мягких тканей, flesh-eating bacteria (бактерия, поедающая плоть), неудержимое омертвение кожи, эпифасциальная прогрессивная гангрена, госпитальная гангрена, фагеденическая язва, гемолитическая стрептококковая гангрена, острая дермальная гангрена, язва Мелени (Meleney ulcer), гнойный фасциит, синергический некротический целлюлит. Летальность при некротизирующих формах инфекции (НФИ), согласно данным литературы, составляет от 20 до 80 % и выше.
Классификация некротизирующей инфекции
Некротизирующая инфекция I типа. Возбудителем является смешанная флора, однако главенствующая роль в развитии НФИ I типа отводится анаэробным грамположительным коккам рода Peptostreptococcus в ассоциации с такими бактериями, как грамотрицательные палочки рода Bacteroides — Fusobacterium, Proteus, Klebsiella, Ps.aeruginosa, Acinetobacter, и грамположительными кокками Staphylococcus spp., Enterococcus spp.
Некротизирующая инфекция II типа. Возбудителем является β-гемолитический стрептококк группы А, с возможной ассоциацией с St.aureus. Характеризуется фульминантным течением, развитием септического шока и полиорганной недостаточности, а также высокой летальностью до 80–100 %. НФИ II типа требует дифференциальной диагностики с тяжелыми формами рожистого воспаления.
Некротизирующая инфекция III типа. Возбудителем является Clostridium spp., чаще всего выделяют Cl.perfringens, а также Cl.oedematiens, с развитием классического клостридиального мионекроза.
Возбудитель, характерный для морской/пресной среды обитания, —Vibrio vulnificu/aeromonas hydrop–hila. Данный вид возбудителя отмечается у людей с хроническими заболеваниями печени.
По характеру реакции организма больного:
— гиперергическая форма;
— нормергическая форма;
— гипергическая форма.
По фазам клинического течения:
1. Фаза напряжения — стимуляция гипофизарно-адреналовой системы.
2. Катаболическая фаза — нарушение метаболизма, преобладает катаболизм, нарушение кислотно-основного состояния и водно-электролитного баланса.
3. Анаболическая фаза — с 10–12-го дня — восстановление обменных процессов (особенно протеины).
4. Фаза реабилитации — полное восстановление обменных процессов.
По клинико-анатомическим признакам:
— септицемия (сепсис без метастазов);
— септикопиемия (сепсис с метастазами).
Септицемию (сепсис без гнойных метастазов), пиемию (сепсис с метастазами) и септикопиемию (смешанная форма сепсиса) большинство современных исследователей, как и Н.И. Пирогов, не считают принципиально различными формами сепсиса, а рассматривают скорее как различные фазы единого септического процесса, нередко переходящие одна в другую.
По бактериологическому признаку различают стафилококковый, стрептококковый, колибациллярный, псевдомонозный, анаэробный, гнилостный, грибковый и другие виды сепсиса [7].
Критерии диагностики сепсиса
Заболеваемость сепсисом в мире составляет 18–20 млн случаев в год, становясь причиной летального исхода у 4–6 млн человек. В США сепсис является причиной 6 % от всех смертей и входит в десятку причин летальных исходов, а в некардио–логических отделениях реанимации и интенсивной терапии занимает второе место. Известно, что у каждого четвертого пациента с тяжелым сепсисом развивается септический шок, летальность при котором достигает 80 %. Сепсис как таковой чаще всего не является самостоятельным заболеванием, развивается как осложнение многих патологических состояний.
Вызванный сепсисом ответ организма в виде органной дисфункции может быть скрытым, не всегда видимым клинически, и это, в свою очередь, вызывает необходимость рассматривать возможность наличия органной дисфункции у каждого пациента при наличии инфекционного процесса. И наоборот, нераспознанная инфекция может быть причиной развития органной дисфункции. Все это создает необходимость иметь действенные критерии для диагностики и верификации сепсиса, более полного понимания клинической ситуации: оценки тяжести состояния с целью определения прогноза, показаний для госпитализации в отделение реанимации и интенсивной терапии, выбора объема терапии и мониторинга[2, 7].
«Сепсис» — термин, имеющий широкий смысл, применяется для не вполне понятного процесса. Нет однозначных критериев или биологических, визуализационных, лабораторных показателей.
На данный момент на основании проведенных клинических и экспериментальных исследований рассматривают сепсис как патологический процесс, в основе которого лежит ответ организма в виде системной генерализованной реакции воспаления на инфекцию различной природы (бактериальную, вирусную, грибковую). Клинической интерпретацией такого взгляда на патогенез сепсиса явились критерии диагностики и классификация, предложенные согласительной конференцией Американского колледжа пульмонологов и Общества специалистов критической медицины. Согласно критериям ACCP/SCCM локальный воспалительный процесс, сепсис, тяжелый сепсис и полиорганная недостаточность — это звенья одной цепи в реакции организма на воспаление вследствие микробной инвазии. В свою очередь, тяжелый сепсис и септический шок являются следствием прогрессирования системного воспаления с развитием нарушения функций систем и органов (табл. 1).
/77-1.jpg)
Для оценки органной, системной дисфункции и общей тяжести состояния больных с сепсисом с 1991 года рекомендовалась шкала SOFA (табл. 2). Шкала SOFA позволяет определять в количественном выражении и тяжесть органно-системных нарушений. Нулевое значение по шкале SOFA указывает на отсутствие органной дисфункции. Полная интерпретация представлена в табл. 2.
Патогенез сепсиса сейчас известен лучше, чем в 1991 г. Если раньше в основе критериев диагностики был SIRS, то теперь признают, что при сепсисе активируется не только воспалительный, но и противовоспалительный ответ. Задействуются не только иммунологические, но и другие пути (кардиологические, неврологические, гормональные, метаболические, коагуляционные), имеющие также высокую прогностическую значимость. Выраженная биологическая и клиническая гетерогенность пострадавших: возраст, преморбидный фон, принимаемые препараты, разные источники инфекции — создают высокую вариабельность начала и течения патологического процесса.
Формирование диагноза сепсиса и септического шока должно включать наиболее современное понимание патобиологии органной дисфункции, являясь, с точки зрения группы экспертов Sepsis-3, определяющим компонентом сепсиса, который может быть включен в любое пересмотренное определение. Таким образом, сепсис определялся в терминах как органная дисфункция, что делает термин «тяжелый сепсис» ненужным [4, 5, 9, 10].
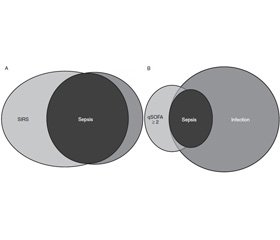
Самая популярная шкала, SOFA, за пределами отделений реанимации известна мало. Сейчас расшифровывается как Sequential Organ Failure (последовательная шкала органной недостаточности), раньше была Sepsis Related (связана с сепсисом). Хорошая, но сложная вне отделений интенсивной терапии. К сожалению, из-за необходимости в лабораторных данных (число тромбоцитов, билирубина и креатинина, РаО2) затрудняется быстрая скрининговая оценка пациента. Принятая группой Sepsis-3 qSOFA (табл. 3) показала высокие сравнимые с SOFA возможности прогнозирования госпитальной смертности для пациентов с подозрением на генерализованную инфекцию [9, 10]. Критерии SIRS (два и более критерия), применяемые до настоящего времени для идентификации сепсиса, были рассмотрены рабочей группой и признаны бесполезными (рис. 1). Связанная с сепсисом органная недостаточность коррелирует с высокой летальностью, поскольку сепсис потенциально смертелен по своей природе. Термин «угрожающая жизни» был добавлен к определению Sepsis-3 [4, 5, 9, 10].
/78-2.jpg)
/79-1.jpg)
Органная дисфункция определяется как острое изменение по шкале qSOFA как ≥ 2 балла. QSOFA ≥ 2 балла отражает общую летальность примерно в 10 % в общей популяции больных с подозрением на инфекцию. Даже при умеренной органной дисфункции ситуация может быстро ухудшиться, если не предпринять быстро и правильно необходимые лечебные действия [9, 10].
Длительно пребывающие больные с подозрением на инфекцию с высокой вероятностью могут быть быстро идентифицированы по qSOFA как пациенты с риском сепсиса и высокой летальностью (нарушение сознания, систолическое АД ≤ 100 мм рт.ст. или частота дыхания ≥ 22 в 1 минуту) [10, 11]. Возрастание балльности по qSOFA должно подтолкнуть клинициста на поиск инфекции, углубленное обследование больного, более тщательный мониторинг. Критериями септического шока в современном представлении являются наличие клиники сепсиса с персистирующей гипотензией, требующей применения вазопрессоров для поддержания среднего АД ≥ 65 мм рт.ст. на фоне проводимой жидкостной ресусцитации, при уровне лактата крови > 2 ммоль/л. Такое сочетание критериев приводит к летальности 40 % и более [10].
Наиболее надежным образом диагноз сепсиса устанавливается на основании следующих признаков (Гельфанд Б.Р. и соавт.) [7]:
1. Клинические проявления инфекции или выделение возбудителя.
2. Наличие воспалительного ответа и органной дисфункции.
3. Лабораторные маркеры системного воспаления (табл. 4) (специфичным является повышение в крови уровня прокальцитонина, С-реактивного протеина, а также интерлейкинов (IL)-1, -6, -8, -10 и фактора некроза опухоли (TNF)).
Развитие органно-системных повреждений при сепсисе связано прежде всего с неконтролируемым распространением из первичного очага инфекционного воспаления провоспалительных медиаторов с последующей активацией под их влиянием макрофагов, нейтрофилов, лимфоцитов и ряда других клеток в органах и тканях, с повреждением эндотелия и снижением органной перфузии и доставки кислорода. Диссеминация микроорганизмов может вообще отсутствовать или быть кратковременной, трудноуловимой.
Развивающаяся острофазовая реакция контролируется провоспалительными медиаторами (IL-1, -6, -8, TNF и др.) и их эндогенными антагонистами, такими как IL-4, -10, -13 и др., получившими название антивоспалительных медиаторов. В генезе острой сосудистой недостаточности, лежащей в основе септического шокового синдрома, ведущая роль отводится оксиду азота (NО), концентрация которого увеличивается в десятки раз в результате стимуляции макрофагов ТNF, IL-1, IFN [12–15].
Прокальцитониновый тест является одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции. При неочевидной бактериальной природе системного ответа проведение прокальцитонинового теста позволяет в ранние сроки определить бактериальную природу септического процесса. Для постановки диагноза сепсиса рекомендовано выполнение количественного прокальцитонинового теста. У здоровых людей уровни прокальцитонина очень низкие. При системных инфекциях, включая сепсис, уровни обычно выше 0,5–2 нг/мл и часто превышают уровень > 10 нг/мл, что коррелирует с тяжестью заболевания и плохим прогнозом [16]. В качестве диагностического лабораторного теста при грибковой инфекции рекомендовано использовать определение маннанового антигена и антиманнановых антител в качестве дополнительных диагностических тестов.
Заключение
Время не стоит на месте: меняются понятия, определения, но от этого не меняется суть проблемы под названием «сепсис». Остаются неизменными цели — увеличение выживаемости и снижение общей заболеваемости сепсисом в стационарах.
Новые определения сепсиса перенастроили фокус на переосмысление клинических проявлений этого синдрома и подчеркнули важность органной дисфункции как ключевого диагностического признака. Необъяснимая органная недостаточность у пациента должна насторожить врача в отношении возможности развития сепсиса. И от того, насколько быстро мы сможем среагировать на изменения, рационально и адресно назначить терапию, будет зависеть конечный результат.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/77-1.jpg)
/78-1.jpg)
/78-2.jpg)
/79-1.jpg)
/79-2.jpg)