Современная медицина достигла такого уровня, когда снижение повреждающего действия общего обезболивания на ЦНС должно стать непременным условием высокого качества. Единственный путь профилактики патологии ЦНС после оперативных вмешательств в условиях длительной общей анестезии — своевременная диагностика и патогенетически обоснованная терапия.
Н.А. Шнайдер (2005)
В настоящее время все актуальнее становится проблема безопасности анестезиологического обес–печения оперативных вмешательств в связи с увеличением количества публикаций о развитии после операций в условиях общей анестезии снижения когнитивного функционирования той или иной степени выраженности и его продолжительности у больных различных возрастных групп с отягощенным и неотягощенным психоневрологическим анамнезом.
Актуальность этой проблемы обусловливается медико-социальными последствиями когнитивных расстройств, которые могут оказывать нежелательное влияние не только на продолжительность госпитализации и ее стоимость, но и на качество жизни больных в отдаленном послеоперационном периоде [1].
Под когнитивными (познавательными) функциями понимают наиболее сложные функции головного мозга, с помощью которых осуществляется процесс рационального познания мира и обеспечивается направленное взаимодействие с ним.
К ним относятся:
— внимание — умение долгосрочно концентрироваться на наиболее актуальных целях и задачах, удерживать в восприятии разные объекты;
— память — способность запечатлевать, сохранять и многократно воспроизводить полученную информацию;
— гнозис — способность воспринимать и распознавать информацию различной модальности;
— праксис — способность усваивать и удерживать разнообразные двигательные навыки, в основе которых лежат автоматизированные серии движений;
— речь — способность понимать обращенную речь и выражать свои мысли с помощью слов;
— мышление — способность к анализу информации, выявлению сходства и различия, общего и частного, главного и второстепенного, способность к абстрагированию, решению задач, построению логических умозаключений.
Вся система когнитивных функций составляет интеллект.
Возникновение когнитивного дефицита ведет к снижению способности человека к мышлению, обучению, активному восприятию информации, принятию решений, ухудшению других психофизиологических функций с последующей выраженной социальной и бытовой дезадаптацией, ограничением или потерей профессиональной деятельности, что тяжелым бременем ложится на семью и общество в целом.
Важно подчеркнуть, что в настоящее время плановым и ургентным оперативным вмешательствам ежедневно подвергается огромное количество больных, у многих из которых уже в дооперационном периоде наблюдается ослабление когнитивной продуктивности, выраженность которой в послеоперационном периоде может усугубляться.
Среди оперирующихся следует прежде всего отметить больных пожилого и старческого возраста с возрастзависимым снижением когнитивных функций, доля которых в общей структуре населения неуклонно увеличивается. В настоящее время возраст каждого десятого жителя Земли составляет 60 лет и более, а в Украине каждый пятый житель достиг 60 лет, что, по данным статистического портала нашей страны на 2010 год, составляет около 20 %. По прогнозу Всемирной организации здравоохранения (ВОЗ), к 2030 году в Европе этот показатель возрастет до 30 %.
Увеличивается и число заболеваний, особенно цереброваскулярной, сердечно-сосудистой, аутопатогенной патологии (алкоголизм, наркомания, курение и др.), сопряженных с нарушениями в когнитивной сфере [2].
Нельзя не указать и на рост различных аварий, катастроф, стихийных бедствий, военных конфликтов с развитием у пострадавших после перенесенных критических состояний посттравматических когнитивных расстройств различной степени тяжести.
Таким образом, в настоящее время проблема сохранения и восстановления когнитивного здоровья стала глобальной в современном мире, что побудило ВОЗ последнее десятилетие ХХ века назвать Международной декадой изучения мозга –человека.
Вышеуказанное требует усиления внимания врачей-анестезиологов к проблеме послеоперационных когнитивных расстройств и необходимости их профилактики и ранней коррекции.
Термин послеоперационной когнитивной дисфункции (ПОКД; postoperative cognitive dysfunction) был дан в 2001 году L.S. Rusmussen для характеристики послеоперационного когнитивного дефицита и обозначает когнитивные расстройства, развивающиеся в раннем и сохраняющиеся в позднем послеоперационном периоде, клинически проявляющиеся нарушениями памяти и других высших корковых функций (мышления, речи и др.) и подтвержденные данными нейропсихологического тестирования в виде снижения его результатов по сравнению с дооперационным уровнем не менее чем на 10 %, что влечет за собой проблемы обучения, снижение умственной работоспособности и настроения [3].
Как отмечает А.М. Авезов (2013), ПОКД может иметь обратимый характер, и по продолжительности клинических проявлений различают такие дисфункции:
— острую (acute postoperative cognitive dysfunction) — продолжительность до 1 недели после операции;
— промежуточную (intermediate) — до 3 месяцев;
— долгосрочную (prolonged) — до 1–2 лет и более.
Чаще выделяют:
— раннюю (early) — продолжительность до 3 месяцев;
— стойкую (steadfast) — более 3 месяцев (Moller G.T. et al., 1998).
Эпидемиология ПОКД
Уже в первом крупном многолетнем эпидемиологическом исследовании — International Study of Postoperative Cognitive Dysfunction — ISPOCD-1 и -2 (1994–2000 гг.) по истинному распространению ПОКД в Европейских странах при рутинных операциях, исключая кардиохирургические операции и операции на головном мозге, отмечено ее развитие, особенно у лиц пожилого возраста:
— до 40 лет: ранняя ПОКД — 19,2 %, стойкая ПОКД — 6,7 %;
— старше 60 лет: ранняя ПОКД — 25,8 %, стойкая ПОКД — 9,9 % [3].
Р.В. Большедворов с соавт. [4] в обзоре литературы, охватывающем 80 самостоятельных исследований, по данным разных авторов, приводит следующую частоту ПОКД:
— в среднем 36,8 % (Canet Y. et al., 2003);
— после кардиохирургических операций — от 3 до 47 %, при этом у 42 % оперированных больных даже спустя 3–5 лет (Neuman M. et al., 2001);
— после некардиохирургических вмешательств — от 7 до 26 %, при этом у 9,9 % — 3 месяца и более, у 1 % — более 2 лет (Rasmussen L.S. et al., 2003).
Нарушения когнитивных функций после общехирургических оперативных вмешательств, выполняемых в условиях общей анестезии, встречаются во всех возрастных группах (табл. 1).
ПОКД обычно возникает после длительных высокотравматичных, многократных оперативных вмешательств, чаще у лиц пожилого возраста, но отмечена и у детей.
В последнее время появились публикации с сообщениями о развитии ПОКД после оперативных вмешательств, проведенных в условиях не только общей анестезии, но и регионарной, выявляются новые факторы риска и влияния ранней и стойкой ПОКД на увеличение вероятности смерти в ближайшем и более отдаленном послеоперационном периоде (табл. 2).
Вышеприведенные данные подчеркивают необходимость усиления внимания врачей-анестезиологов к этой важной проблеме.
Этиопатогенез ПОКД
Механизмы, ответственные за развитие ПОКД, полностью еще не раскрыты. В настоящее время ПОКД рассматривается как многофакторное –осложнение.
В экспериментах на животных установлены нарушения тонких механизмов деятельности головного мозга под влиянием фактически всех известных анестетиков. В литературе отмечено неблагоприятное влияние на центральную нервную систему (ЦНС) даже среднетерапевтических доз анестетиков и наркотических анальгетиков, являющихся потенциально опасными для головного мозга (табл. 3). Обсуждается вопрос о повреждающем влиянии на головной мозг гипотензивной общей анестезии.
М. Herman et al. (2000) обнаружили повышение уровня нейробиологических маркеров повреждения мозга: нейроспецифических ферментов энолазы (маркера повреждения нейронов) и протеина S-100β (маркера повреждения глии). Длительная ПОКД ассоциировалась в большей степени с высоким уровнем энолазы и в меньшей степени была –обусловлена повышением протеина S-100β. Такие же данные получены L. Peng et al. (2013).
Кроме нейротоксического действия общих анестетиков, в этиологии ПОКД выделяют и другие факторы:
— остаточное действие компонентов общей анестезии и продуктов их деградации, активных в отношении ЦНС; действие пролонгированных седативных средств; неадекватная послеоперационная аналгезия (Салтанов А.И. с соавт., 1999; Mackensen G.B., Gelb A.W., 2004);
— уровень достигаемой во время операции антиноцицептивной защиты мозговых структур, несостоятельность которой приводит к перевозбуждению и истощению энергетического баланса коры больших полушарий и подкорковых образований, связанных с уровнем сознания (Виноградов В.Л., 2002; Атеф Дагеш, Кобеляцкий Ю.Ю., 2012);
— повреждающее действие гипоксии, как общей (гипоксемия, острая анемия, гипоциркуляция), так и локальной (изменение перфузии мозга, внутричерепного давления) (Ибрагимов Н.Ю. с соавт., 2008; Wang D.S. et al., 2011).
В последнее время в качестве основного потенциального механизма развития когнитивных расстройств стали рассматривать: нейровоспаление и нейрогуморальные изменения как составляющие синдрома системного воспалительного ответа организма на хирургическую агрессию; опосредованное анестетиком повреждение головного мозга, а также окислительный стресс [6].
Массивное высвобождение медиаторов воспаления, сопровождающее операционный стресс, зачастую усугубляет процессы тканевого повреждения вследствие избыточного повышения уровня интерлейкинов IL-1β, IL-6, фактора некроза опухоли α.
В развитии нейродегенеративных процессов большое значение придается окислительному стрессу. Перекисное окисление липидов провоцирует окислительное повреждение нейронов, приводящее к их гибели и сопровождающееся продукцией высокореактивных биомолекул, обладающих нейротоксическими свойствами [7].
И.Н. Пасечник с соавт. (2009) установили повреждение белков и липидов на фоне снижения активности ферментов антиоксидантной защиты под влиянием различных общих анестетиков.
Замечено, что длительность анестезии и повторные операции повышают риск послеоперационных когнитивных нарушений, как и предшествующий когнитивный дефицит. Увеличение риска поражения ЦНС отмечается при увеличении времени общей анестезии более 3,5–4 часов с максимальным значением 5–6 часов общей анестезии.
С частотой ПОКД ассоциируется уровень интраоперационной седации. По данным Y. Marimoto (2010), частота интранаркозного пробуждения составляет не менее 0,3 %, и в 88 % случаев эти эпизоды были связаны с тотальной внутривенной анестезией. Применение BIS-мониторинга для контроля глубины анестезии снижает дозы общих анестетиков и частоту когнитивных расстройств.
Продолжает активно изучаться вопрос о роли анестезии и оперативного лечения в механизмах развития болезни Альцгеймера [8].
Выделяют несколько механизмов:
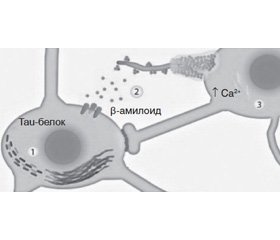
1. Увеличение продукции и фосфорилирование тау-протеина, образование нейрофибрилляторных клубочков.
2. Увеличение продукции β-амилоида, его олигомеризации, образование амилоидных бляшек.
3. Эксайтотоксическое нейронное повреждение (рис. 1).
Морфологические изменения головного мозга при этом во многом схожи с таковыми при болезни Альцгеймера: атрофия гиппокампа, снижение плотности серого вещества головного мозга, расширение желудочков. Общими звеньями в их патогенезе являются также нейровоспаление и наследственный фактор.
Способствует развитию ПОКД и нарушение циркадного цикла, наступающего после хирургического лечения, особенно у пожилых больных, что вызывает расстройство сна и связанное с ним снижение секреции мелатонина. Из других факторов риска выделяют тяжелые заболевания и осложнения (сахарный диабет, инфекционные осложнения, почечная недостаточность, дыхательные расстройства, метаболический синдром), неблагоприятную больничную среду (больничная обстановка, инвазивные процедуры, шум мониторов в ночное время и др.). Н. Шнайдер (2004) в патогенезе ПОКД обращает внимание на такие факторы, как метаболические, гемореологические, гипоксические, токсические, которые приводят к повреждению стенок церебральных сосудов на уровне микроциркулярного русла, нарушению обмена внутриклеточного кальция, разобщению ассоциативных и межнейрональных связей в различных структурах головного мозга. Механизм действия общей анестезии осуществляется на уровне центральных структур, главным образом ретикулярной фармации, торможение которой обусловливает снижение восходящего активирующего влияния на кору головного мозга. В условиях длительной общей анестезии это воздействие усугубляется.
В последнее время увеличилось распространение метаболического синдрома среди трудоспособных лиц молодого и среднего возраста, что делает эту проблему чрезвычайно актуальной.
В целом все факторы риска можно разделить на поддающиеся и не поддающиеся коррекции.
Немодифицируемые факторы риска:
— пожилой возраст (> 65 лет);
— предшествующие когнитивные расстройства;
— наследственные факторы (наследование АроЕε4-аллели).
Относительно модифицируемые факторы риска:
— травматичность операции;
— длительность анестезии и повторные операции;
— тяжелые заболевания и осложнения.
Модифицируемые факторы риска:
— анестезиологическая тактика;
— глубина седации;
— неадекватная анальгезия;
— применение опиоидов и бензодиазепинов;
— нарушение сна;
— неблагоприятная больничная среда;
— полипрагмазия;
— нарушение водно-электролитного и кислотно-щелочного равновесия;
— иммобилизация (Политов М.Е., 2015).
Для более глубокого понимания необходимости раннего предотвращения развития тяжелых неврологических последствий общей анестезии важно обратить внимание врачей-анестезиологов на следующие обстоятельства:
— ранняя ПОКД является главным предиктором развития стойкой ПОКД;
— неврологическая дисфункция часто обратима лишь в начале своего развития, поэтому так важны меры профилактики и ранней коррекции этих нарушений;
— потенциальная опасность развития болезни Альцгеймера на фоне стойкой ПОКД;
— рост числа судебных исков к анестезиологам, связанных с развитием ПОКД [9].
Клиника и диагностика ПОКД
Недостаточность когнитивных функций в послеоперационном периоде проявляется ухудшением памяти и внимания, речи, счета, пространственно-временной ориентации, способности к абстрактному мышлению и признаками его замедления, развитием или усилением депрессии [10].
Для оценки когнитивных функций используются многочисленные нейропсихологические методы исследования, представляющие собой различные тесты и пробы на запоминание и воспроизведение слов и рисунков, узнавание образов, решение интеллектуальных задач и др. [11].
Среди них наиболее часто применяют:
— Монреальскую шкалу оценки когнитивных функций, которая позволяет определить память, внимание, исполнительные навыки, речь, ориентацию в пространстве, другие более сложные интеллектуальные функции;
— шкалу MMSE (Mini Mental State Examination) для оценки мнестических функций;
— прогрессивные матрицы Равена как интегральный показатель, позволяющий оценить логичность мышления, провести качественную оценку типа ошибок, допущенных больными при выполнении тестовых заданий;
— тест Бурдона (корректурная проба) для определения умственной работоспособности и степени концентрации, объема и стойкости внимания;
— тест Лурье (заучивание 10 слов), что позволяет проследить процессы запоминания, сохранения и воспроизведения информации;
— тест «исключение лишнего» для оценки способности к обобщению и абстрагированию, умению выделять существенные признаки, что позволяет оценить способности к аналитико-синтетической мыслительной деятельности.
В целях уточнения этиологии ПОКД ряд авторов рекомендует проводить лабораторные исследования показателей кислотно-щелочного равновесия и водно-электролитного баланса, газов крови, гемоглобина, глюкозы, осмолярность сыворотки крови, содержание креатинина, мочевины.
Профилактика и коррекция ПОКД
В связи с достижениями фундаментальных исследований в области нейрофизиологии, нейрохимии, молекулярной биологии к концу ХХ века появились новые данные о способности мозга к восстановлению своих функций независимо от возраста за счет репаративных процессов и компенсации нарушенных функций [12–14].
Эволюция представлений о механизмах повреждения и восстановления тканей мозга и, исходя из этого, о возможностях улучшения его деятельности, а также бурное развитие фармацевтической отрасли с появлением нейропротективных препаратов с различным механизмом действия стали основанием для разработки методов предупреждения и коррекции когнитивных нарушений, вызванных возрастом или другими факторами [10, 11, 15].
В настоящее время профилактику и коррекцию ПОКД рекомендуется проводить в двух направлениях:
— воздействие на различные параметры и системы организма с целью обеспечения их функционирования, адекватного потребностям организма;
— применение методов фармакологической нейропротекции.
Периоперационная нейропротекция должна включать:
— идентификацию больных, имеющих риск развития ПОКД с учетом возможных и доказательных факторов риска с последующим проведением у них нейропсихологического тестирования до операции и после нее;
— обеспечение интраоперационной профилактики ПОКД путем выбора наиболее оптимального анестетика с минимальным воздействием на ЦНС и поддержание стабильных показателей основных жизненно важных функций организма (неспецифическая профилактика) с назначением при необходимости до, во время операции или сразу после нее фармакологических нейропротективных препаратов;
— в случае развития ПОКД — проведение ранней коррекции когнитивных расстройств (специ–фическая профилактика), так как своевременное ее проведение, когда в большинстве случаев нарушения являются потенциально обратимыми, позво–ляет предупредить развитие стойкой ПОКД.
Неспецифическая профилактика ПОКД преду–сматривает:
1. Контроль глубины анестезии. Оптимальным является использование для нейромониторинга ВIS-мониторинга, который позволяет определять степень угнетения сознания во время общей анестезии, что важно как для предотвращения передозировки анестетиков, так и для предупреждения интранаркозного пробуждения.
2. Поддержание стабильной гемодинамики.
3. Обеспечение нормального метаболизма (газообмен, кислотно-щелочное равновесие, водно-электролитный и углеводный гомеостаз).
Специфическая профилактика ПОКД включает проведение фармакологической нейропротекции.
Среди различных нейротропных препаратов, арсенал которых на сегодня достаточно велик, основное место занимают:
— препараты ноотропного действия, в основе которых лежит влияние на интеллектуально-мнестическую функцию и нейропротективный эффект, что оказывает прямое активирующее воздействие на обучение, улучшение памяти и умственной деятельности, повышает устойчивость мозга к вредным воздействиям;
— антихолинэстеразные препараты, которые, кроме улучшения памяти и других интеллектуальных функций, способствуют повышению способности к обучению и торможению прогредиентного развития деменции;
— антиоксиданты, которые приводят к уменьшению выраженности оксидативного стресса, что снижает его пагубное воздействие на нейроны.
Согласно современным представлениям, предпочтение отдается комбинации нейропротективных препаратов, поскольку когнитивная сфера нарушений имеет полимодальный характер.
У больных пожилого возраста и/или при наличии исходных отягощающих соматических заболеваний для снижения риска неврологических осложнений необходимы мультидисциплинарный подход с привлечением специалистов разных специальностей (невролог, кардиолог, эндокринолог) и проведение нейрофизиологического обследования до и после оперативного вмешательства.
При этом длительность курса профилактики стойкой ПОКД зависит от исходного состояния когнитивных функций больного.
Заключение
Послеоперационная когнитивная дисфункция является одним из серьезных послеоперационных осложнений и вызывает необходимость выявления факторов риска ее развития, понимания патогенеза когнитивных расстройств, определения оптимального варианта ее периоперационной профилактики и коррекции.
Она требует внимания анестезиолога в плане не только:
— выбора оптимального варианта анестезии;
— обеспечения ее адекватного уровня;
— четкого мониторинга и своевременной коррекции показателей гемодинамики, газообмена, красной крови, уровня гликемии интраоперационно и в раннем послеоперационном периоде,
но и:
— учета исходного состояния когнитивных функций до и после оперативного вмешательства;
— проведения упреждающей фармакологической нейропротекции и своевременной коррекции ранней ПОКД, особенно у больных с повышенным риском развития в послеоперационном периоде когнитивных расстройств.
Раннее начало проведения фармакологической профилактики и коррекции позволяет не только предупредить развитие стойкой ПОКД, но и в ряде случаев повысить уровень психофизиологических функций в отдаленном послеоперационном пе–риоде, что улучшает качество жизни больных, к чему очень уместно призывает нас, врачей, профессор В. Зельман (2009): «Нашей задачей в лечении больных или дисфункций в человеческом организме должно быть сохранение личностных качеств и интеллекта каждого больного».
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/11-1.jpg)
/12-1.jpg)