«Нефрологическим» может стать любой больной как при естественном течении заболевания, так и в результате лечения.
Н.А. Мухин
Одной из актуальных проблем современной медицины является особая форма пневмонии — так называемая тяжелая негоспитальная пневмония (ТНП), которая характеризуется высокой летальностью и большими затратами на медицинскую помощь. ТНП — болезнь различной этиологии, сопровождается выраженной рефрактерной дыхательной недостаточностью (ДН), сепсисом, инфекционным шоком, ДВС-синдромом, полиорганной дисфункцией (ПОД), необходимостью лечения в отделении реанимации и интенсивной терапии (ОРИТ) [2, 11]. Пациенты с диагнозом «пневмония» входят в группу повышенного риска по развитию внезапной остановки сердца вследствие гемодинамической, почечной недостаточности, нарушений метаболизма.
В последние годы наиболее частой причиной развития ТНП являются респираторные вирусы гриппа, коронавирусы, риносинтициальные, метапневмонические вирусы, бокавирус человека, а также пандемический вирус гриппа А/H1N1, вирусы т.н. птичьего и свиного гриппа, которые вызывают первичное поражение легочной ткани и прогрессирующую ДН [5]. При этом непрямое опосредованное повреждающее действие на легочную ткань оказывают не только вирусы и последующая бактериальная инфекция, но и аутоиммунные процессы (интерстициальный и альвеолярный отек, нарушения сурфактантной системы), гипоксемия. Для вирусных пневмоний характерно быстрое развитие (через 4–6 часов после поступления пациента в стационар) бронхообструктивного синдрома, острое повреждение легких (ОПЛ), острый респираторный ди–стресс-синдром (ОРДС), острая ДН.
В клинике часто встречаются т.н. пульморенальные синдромы, которые объясняются общностью антигенных структур базальных мембран клубочков и альвеол, а также единством многих гомеостатических функций (регуляция кислотно-основного состояния организма, участие легких в регуляции артериального давления (АД) через ангиотензиназу и др.). Почки чувствительны к гипоксии, ишемии, инфекционно-токсическим влияниям, нефротоксическим влияниям лекарственных препаратов, нарушениям системной гемодинамики (гипотензия, уменьшение ОЦК) [25]. Поэтому при ТНП часто развивается нарушение функции почек, которое обычно входит в понятие «ПОД», является одним из критериев ТНП и нередко приводит к летальному исходу.
Согласительная конференция инициативной группы по улучшению качества острого диализа (The Second International Consensus of the Acute Dialysis Initiative, ADUL) в 2004 г. выступила с рекомендацией заменить термин «острая почечная недостаточность, ОПН» на «острое повреждение почек, ОПП» (acute kidney injury, AKI) с целью «выведения исследований почечной недостаточности и практической помощи больным на качественно более высокий уровень и стандартизацию подходов и пониманий».
ОПП может развиваться внебольнично, в различных стационарах, независимо от природы служит предиктором неблагоприятных исходов, чаще возникает на фоне хронической болезни почек (ХБП), шире понятий ОПН и острого тубулярного некроза, включая эти состояния [2, 18]. Частота внутрибольничного ОПП составляет при сепсисе 68,4 %, при пневмонии — 52,5 %, при застойной сердечной недостаточности — 47,4 %, при остром инфаркте миокарда и ХБП — 46,4 %, у пациентов, находящихся в критических состояниях, — 60 % случаев. Таким образом, с ОПП встречаются врачи всех специальностей [26].
Комитет экспертов KDIGO (Kidney Disease: Improving Global Outcome) [18] предложил следующую модифицированную систему диагностики и стратификации тяжести ОПП: 1) повышение уровня сывороточного креатинина (SCr) более чем на 26,5 мкмоль/л в течение 48 часов, или 2) повышение SCr более чем в 1,5 раза по сравнению с исходным уровнем в течение предшествующих 7 дней, или 3) объем диуреза менее 0,5 мл/кг/час за 6 часов. Существует мнение, что почки являются достаточно «прочным» органом, способным перенести воздействие нескольких повреждающих факторов. Однако необходимо учитывать, что даже незначительное преходящее нарастание SСr может ассоциироваться с серьезным повреждением почечных структур, резким увеличением летальности в раннем и отдаленном периодах [13]. Кроме того, суточные колебания этого критериального показателя зависят от диеты, физической активности, концентрации мочевой кислоты, билирубина, лекарственных препаратов.
Диагностика ОПП согласно показателям диуреза также затруднена, поскольку требует катетеризации мочевого пузыря для учета объема почасового диуреза [6], в 50 % случаев ОПП не сопровождается олигурией.
К факторам риска развития ОПП относят дегидратацию, пожилой возраст, генетическую предрасположенность, острые и хронические сопутствующие болезни, нефротоксические лекарственные препараты. У 30 % больных с восстановлением функции почек после перенесенного ОПП имеется риск развития хронической болезни почек (ХБП), болезней сердечно-сосудистой системы и прежде–временной смерти. ОПП часто сопровождается колебаниями гликемии, гиперкатаболизмом белков, вызванными стрессовыми воздействиями, воспалением, ацидозом.
Таким образом, ОПП — распространенное и опасное для жизни, трудоспособности состояние, которое зачастую несвоевременно диагностируется и является причиной неблагоприятных исходов, что определяет актуальность и необходимость дальнейших исследований этой проблемы.
Цель работы: изучить особенности течения ОПП у больных ТНП для оптимизации диагностики и лечения в условиях многопрофильного лечебного учреждения.
Материалы и методы
Проведен ретроспективный анализ 43 случаев смерти от ТНП больных (40,7 % составляли мужчины, 59,5 % — женщины), поступивших в пульмоаллергологическое отделение Харьковской областной клинической больницы в январе — ноябре 2016 года с диагнозом «негоспитальная пневмония IV клинической группы» и находившихся в условиях ОРИТ. Средний возраст пациентов составил 58,18 года, преобладали лица старших возрастных групп (в возрасте старше 70 лет — 16,3 % пациентов, от 60 до 70 лет — 30,6 %, от 50 до 60 лет — 22,4 %, от 40 до 50 лет — 22,4 %, от 20 до 40 лет — 4 %). Всего за этот период в отделении лечилось 1168 больных с пневмониями III–IV клинических групп, летальность, таким образом, составила 3,59 %. Досуточная летальность составила 17,5 %, до 5 суток — 52,5 %, до 10 суток — 23,5 %, до 20 суток и более — 6,5 %. Время пребывания больного на амбулаторном лечении до госпитализации в среднем составляло 5,3 суток, колебалось от 3 до 12 суток. У всех пациентов заболевание начиналось как острое респираторное (повышение температуры тела от 38 до 40 °С, кашель, слабость), затем присоединялась и нарастала одышка. Больные лечились парацетамолом, отхаркивающими, противовирусными препаратами. Антибиотики на догоспитальном этапе назначались в 2 случаях (аугментин, кларитромицин). Сопутствующая патология не обнаружена у 5 пациентов в возрасте 38–47 лет (средний возраст — 43,4 года). Коморбидная патология у пациентов представлена следующими нозологиями: гипертоническая болезнь (ГБ) III ст. — у 38,7 % пациентов; ишемическая болезнь сердца (ИБС), постинфарктный кардиосклероз — у 32,65 %, при этом сердечная недостаточность (СН) IIА ст. — у 46,3 % пациентов, а СН IIБ ст. — у 53,7 % пациентов с кардиальной патологией; сахарный диабет (СД) типа 2 — у 4 пациентов, СД типа 1 — у 1 пациента; хроническое обструктивное заболевание легких (ХОЗЛ) — у 3, бронхиальная астма (БА) — в 2 случаях, патология органов пищеварения (холецистит, гепатит, язвенная болезнь 12-перстной кишки, синдром короткой кишки) — у 7 пациентов.
При поступлении все больные находились в критическом состоянии: выраженная ДН, при рентгенологическом исследовании двусторонняя пневмония констатирована у 65,8 % пациентов, мультилобарная односторонняя — у 24,2 %, поражение одной доли легкого — в 10 % случаев.
С учетом тяжести пневмонии, кратковременности пребывания пациентов в стационаре системная антибактериальная терапия назначалась эмпирически, проводилась волюмическая и инотропная терапия для обеспечения адекватной тканевой перфузии, респираторная поддержка, искусственная вентиляция легких (ИВЛ). В качестве препаратов эмпирической антибактериальной терапии использовались цефалоспорины III–IV поколения, меропенемы, респираторные фторхинолоны, пиперациллин натрия/тазобактам, коломицин, линезолид, при сепсисе — аминогликозиды. При фебрильной нейтропении в комплексную терапию включались противовирусные препараты, противогрибковые средства. С целью профилактики острого повреждения легких применялись стимуляторы сурфактанта, мукорегуляторы, антиоксиданты. Пациенты обеспечивались нутриционной поддержкой через зонд.
Статистическая обработка результатов осуществлялась с помощью пакета Statistica 10 с использованием непараметрических методов. Данные выражены медианой с межквартильным диапазоном (Mе) 25–75 % и указанием минимальных и максимальных значений (Min-Max), если не указано другое. Для выявления различий между независимыми группами использовали тест Манна — Уитни (U), в зависимых группах — критерий Вилкоксона (W). Зависимость между переменными оценивали с помощью коэффициента корреляции Спирмена (R).
Результаты
Для ретроспективного анализа выделены 2 группы пациентов: в 1-ю группу вошли больные ТНП с ОПП (14 пациентов; 32,5 %), во 2-ю группу — больные с ТНП без признаков ОПП (29 пациентов; 67,5 %).
При поступлении SCr находился в пределах нормальных значений у 15 пациентов, у 6 из них развилось ОПП, у 8 больных ОПП констатировано на фоне исходно повышенного SCr («ОПП на ХБП»?). У 28 пациентов повышение SCr наблюдалось при поступлении (от 137 до 466 мкмоль/л), из них у 6 уровень SCr быстро снижался до нормальных величин, что позволяет предположить в этих случаях возможность ОПП на догоспитальном этапе. У 15 пациентов уровень SCr оставался повышенным, что могло быть следствием ХБП (нефроангиосклероз при ГБ III ст., ИБС, диабетический гломерулосклероз, хронический пиелонефрит). У 8 больных SCr исследован 1 раз в связи с кратковременным пребыванием в стационаре, что не дает возможности судить о причинах повышения показателя.
Стратификация пациентов согласно тяжести ОПП [14] показала, что ОПП 1-й ст. тяжести (увеличение SCr в 1,5–1,9 раза, или более 26,5 мкмоль) отмечена в 3 случаях, 2-й ст. тяжести — у 6 пациентов (увеличение SCr в 2–2,9 раза), 3-й ст. (увеличение SCr в 3 раза, или более 353,6 мкмоль) — у 5 пациентов. У 3 больных SCr был выше 353,6 мкмоль/л (383; 359; 767,8 мкмоль/л).
Изменений в общем анализе мочи не обнаружено у 2 пациентов. У всех остальных протеинурия колебалась от 0,07 до 0,91 г/л, в одном случае протеинурия составляла 3,6 г/л (пациентка с ОПП). В осадке мочи отмечены гиалиновые и зернистые цилиндры, почечный эпителий, у 9 пациентов гематурия от 20–25 измененных эритроцитов в поле зрения до целого поля зрения, из них у 4 больных с ОПП.
У больных с ОПП в общем анализе крови количество тромбоцитов оказалось достоверно сниженным по сравнению с показателями 2-й группы, различия в количестве лейкоцитов и эритроцитов недостоверны, имеется тенденция к лейкопении у больных с ОПП.
Уровень АСТ и АЛТ в крови был достоверно повышенным у пациентов с ОПП по сравнению с нормальными показателями и с показателями 2-й группы, причем у 4 пациентов эти показатели превышали нормальные более чем в 10 раз, у остальных в 1-й группе (61,53 % больных) уровень АСТ был повышен в 5,45 раза по сравнению с нормой. Сравнительная характеристика лабораторных данных отражена в табл. 1, 2.
Во 2-й группе умеренное повышение уровня АЛТ и АСТ (в 4,3 и 4,87 раза) отмечено у 47 % больных. Исходный уровень SCr и мочевины был более высоким у больных во 2-й группе, однако различия недостоверны. При развитии ОПП SCr достоверно превышал исходные показатели (табл. 2).
Содержание белка в крови у больных с ОПП было достоверно сниженным по сравнению с показателями 2-й группы. Снижение отмечено у 81 % больных 1-й группы и у 42 % пациентов 2-й группы. Содержание глюкозы в крови не различалось достоверно у пациентов 1-й и 2-й групп, было повышенным у 11 больных (84,6 %) 1-й группы (СД типа 2 в 2 случаях) и у 18 больных (62 %) во 2-й группе (СД типа 2 у 2 и СД типа 1 у одного пациента).
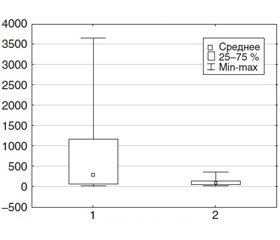
Анализ диаграмм размаха свидетельствует о том, что при ОПП наблюдается более значительный разброс показателей уровня мочевины в крови. Разброс величин уровня SCr более выражен в группе ТНП до развития ОПП, при развитии ОПП разброс значительно увеличивается. Во 2-й группе разброс показателей SCr был менее выражен. Такие же тенденции характерны для показателей АСТ у пациентов 2-й группы: повышение уровня АСТ в 5,45 раза (рис. 1).
/48-1.jpg)
При проведении корреляционного анализа достоверная зависимость обнаружена у следующих показателей: в 1-й группе имеется прямая зависимость уровня мочевины в крови и количества лейкоцитов периферической крови (R = 0,564, р < 0,05), а также прямая зависимость уровня SCr при развитии ОПП от исходного уровня этого показателя (R = 0,723; р < 0,05). Во 2-й группе обратная корреляционная зависимость обнаружена между уровнем мочевины в крови и количеством тромбоцитов в периферической крови (R = –0,560, р < 0,05), прямая зависимость между SCr и АСТ (R = 0,452, р < 0,05), количеством эритроцитов в периферической крови и уровнем белка в крови (R = 0,471, р < 0,05).
При аутопсии в 22 случаях констатирована тотальная фибринозно-гнойная пневмония, у 12 — субтотальная, у 7 — двусторонняя долевая, в 1 случае — тотальная пневмония правого легкого и в 1 — поражение одной доли правого легкого. Фибринозно-гнойный плеврит односторонний обнаружен в 12 случаях, двусторонний — в 5 случаях. Диабетический гломерулосклероз отмечен в 1 случае, нефроангиосклероз — в 24 случаях. В 6 случаях обнаружен острый субтотальный некроз эпителия извитых канальцев почек (у 2 больных с ОПП была умеренная протеинурия, у остальных клинических признаков поражения почек не обнаружено).
Обсуждение
Проведенное исследование подтверждает высокую частоту ОПП при ТНП (32,5 % от общего количества умерших), холестаз как признак поражения печени при ПОД выявлен всего в 16,6 % случаев, из них у 5 пациентов 2-й группы. Быстрое снижение уровня исходно повышенного SCr отмечено еще у 5 пациентов, что позволяет предположить у них развитие ОПП на догоспитальном этапе. Возраст, пол, течение пневмонии, амбулаторное лечение и терапия в стационаре, распространенность инфильтрации легочной ткани, сопутствующая патология были одинаковыми в группе пациентов с ОПП (1-я группа) и без ОПП (2-я группа).
Анализ продолжительности пребывания в стационаре до летального исхода показал, что в 1-й группе (больные с ОПП) количество койко-дней составляло в среднем 4,8, у больных 2-й группы с исходно повышенным SCr — 6,14 и у пациентов с нормальным исходным SCr — 13 койко-дней. Таким образом, развитие ОПП при пневмонии может расцениваться как маркер тяжести течения и неблагоприятного ближайшего прогноза для жизни.
Определенные различия выявлены при изучении результатов лабораторных исследований крови у пациентов 1-й и 2-й групп: в группе больных с ОПП чаще встречались лейкопения, снижение уровня гемоглобина, тромбоцитопения, гипопротеинемия, повышение уровня АСТ и АЛТ, а также у большего количества пациентов обнаруживалась гипергликемия.
В последние годы показано, что нарастание уровня SCr и падение диуреза являются поздними показателями ОПП, не отражают времени развития ОПП, его локализации, тяжести клубочкового или канальцевого поражения, имеются данные о том, что до 50 % ренальных функций утрачены еще до повышения уровня SCr. Даже относительно незначительное ОПП или нарушение ренальной функции, которое проявляется изменениями диуреза и биохимического состава крови, имеют серьезные клинические последствия и потенциально опасны при критических состояниях [2, 3, 13].
Важнейшей проблемой интернистики в целом и нефрологии и клинической реаниматологии в частности стало выявление ранних признаков ОПП в связи с отсутствием четкой клинической симптоматики, простых, приемлемых для большинства отделений ОРИТ способов ранней диагностики этого тяжелого проявления критических состояний.
В начале ХХІ века предлагаются новые подходы к решению проблемы ранней диагностики ОПП, в частности использование различных биомаркеров, наиболее популярным из которых является NGAL, белок семейства липокалинов, ассоциированный с желатиназой нейтрофилов, сравнимый по диагностической значимости с тропонином в кардио–логии («ренальный тропонин») [1, 3, 12, 16, 18]. В настоящее время исследование NGAL методом ИФА вполне доступно и высокоинформативно с точки зрения диагностики характера ОПП (преренальное, ренальное, постренальное), прогноза, изучения нефротоксичности и эффективности различных препаратов. Однако NGAL не является идеальным маркером ОПП в связи с отсутствием органоспецифичности.
ОПП является одним из наиболее часто встречающихся проявлений синдрома полиорганной недостаточности, или ПОД — тяжелой неспецифической стресс-реакции организма с универсальным поражением органов и тканей агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной дисфункции — легочной, сердечной, почечной, печеночной [14, 24]. В развитии ПОД имеют значение генетические факторы (различия в экспрессии генов и протеома, индивидуальные характеристики которых влияют на тяжесть течения ПОД), коморбидность и особенности лечения (вентиляториндуцированное повреждение легких, инфузионная терапия, иммобилизация, пере–охлаждение, трансфузии продуктов крови, инотропы, антибиотики и др.), воспаление (дисрегуляция провоспалительных и противовоспалительных цитокинов [8], внутриклеточных сигнальных путей (NF kB, TOLL-like receptors, HMGB-1)).
В основе развития критического состояния при пневмонии лежит синдром системного воспалительного ответа (ССВО), для которого характерна медиаторно-цитокиновая буря, мощный хаотический выброс огромного количества активных биологических субстанций с разнонаправленными эффектами (цитокины, простагландины, лейкотриены, гистамин, серотонин, опиоиды, гормоны, протеазы, супероксидные радикалы и пр.). В ответ на повреждение развивается т.н. гиперметаболический синдром (ГМС), основными признаками которого являются гипертермия, усиление катаболизма белков, углеводов, липидов как суммарный адаптационный ответ, обеспечивающий мобилизацию энергетических ресурсов организма, включающий активацию и дисрегуляцию физиологических гомеостатических систем, периферическую инсулинорезистентность и гипергликемию [4]. При ГМС даже умеренная «стрессовая» гипергликемия более токсична, чем у здоровых лиц, и при сахарном диабете индуцирует апоптоз, функцию нейтрофилов, повышает риск инфекций, ассоциируется с повышенной смертностью [15, 17, 21, 22]. Все эти пусковые факторы приводят к развитию абсолютного либо относительного перфузионного дефицита, расстройств микроциркуляции, гипотонии, олигурии, как энергозависимый процесс, тормозится выделительная функция нефронов. Гиперкатаболизм белков, обусловленный воспалением, стрессом, ацидозом, — характерный признак критического состояния. В наших наблюдениях гипопротеинемия выявлена у пациентов обеих групп, достоверно снижен этот показатель у пациентов с ОПП по сравнению со 2-й группой.
У большинства пациентов 1-й группы обнаружено повышение уровня аминотрансфераз, причем у 4 из них — более чем в 10 раз, что свидетельствует не только о повреждении гепатоцитов при ПОД, но и о вовлечении этих ферментов в процессы протеолиза скелетной мускулатуры. Высокая гиперферментемия развивается также при тяжелой гипоксии тканей, которая характерна для тяжелой пневмонии [7]. Поскольку в наших наблюдениях высокий уровень трансаминаз обнаружен только у больных 1-й группы, мы склонны связывать его с большей выраженностью ГМС при ОПП, утилизацией аминокислот скелетной мускулатуры для активного глюконеогенеза, более выраженной гипоксией тканей. Об этом же свидетельствует достоверное снижение общего белка крови в 1-й группе по сравнению с показателями 2-й группы.
Подводя итоги, можно отметить, что у больных тяжелой пневмонией, осложнившейся ОПП, чаще наблюдаются признаки синдрома гиперкатаболизма (гипопротеинемия, гипергликемия, гиперферментемия), а также угнетение лейкопоэза, тромбоцитопения. Считается, что изменение энергетического метаболизма при ОПП вызвано не ОПП как таковым, а острыми сопутствующими заболеваниями и осложнениями [18]. В наших наблюдениях причиной развития ГМС является тяжелая пневмония.
Трактовка полученных данных оказалась весьма затруднительной в связи с большим разбросом показателей, связанным с развитием медиаторно-цитокинового шторма, кратковременным пребыванием больных в стационаре, развитием феномена «двойного удара», влияния патологических и ятрогенных агрессивных факторов (использование больших доз антибиотиков, в том числе нефротоксических, петлевых диуретиков, ИВЛ, трансфузии крови, коллоидных растворов и пр.). Следует подчеркнуть, что при ОПП разброс показателей был значительнее, чем во 2-й группе пациентов, что отражает хаотическое состояние гомеостатических систем.
Ранняя диагностика ПОД и ОПП служит основанием для проведения ранней агрессивной терапии в ОРИТ после первоначальной легочной ресусцитации. В настоящее время выделение ранних клинических признаков повреждения функции остается нерешенной проблемой: отсутствует система ранней (в первые сутки) и доступной для лечебных учреждений диагностики ОПП, не выработана четкая концепция своевременной и адекватной коррекции нарушений гомеостаза с помощью доступных и эффективных методов лечения [4]. Сложности в оценке, интерпретации результатов полученных данных, в выборе правильной стратегии коррекции многочисленных факторов, ведущих к развитию ОПП, у каждого конкретного пациента связаны, кроме всего прочего, с генетическими факторами. В частности, в проспективном обсервационном генетическом исследовании описывается 4es/5G полиморфизм PAL-1 гена, ассоциированный с ПОД и септическим шоком при пневмонии [20, 23].
Основным направлением в коррекции гиперкатаболизма при ПОД является нутриционная поддержка, направленная на обеспечение достаточного поступления белков для поддержания метаболического равновесия энтеральным путем. Ранняя энтеральная нутритивная поддержка не снижает летальность, но уменьшает частоту инфекционных осложнений, длительность пребывания в стационаре, подавляет гиперметаболизм, компенсирует дефицит энергии, возникающий при критических состояниях.
Важнейшим этапом терапии является устранение пускового фактора развития ПОД. В наших наблюдениях таким фактором является тяжелая пневмония, требующая назначения своевременной адекватной эмпирической деэскалационной антибактериальной терапии. При выборе антибиотиков необходимо учитывать ежедневные данные микробиологического мониторинга в регионе или в многопрофильном стационаре [10], а также их нефротоксичность, гепатотоксичность.
Мультиорганная поддержка осуществляется введением жидкостей, предпочтительно кристаллоидов. Ведутся дискуссии о показаниях к применению коллоидов (альбумин, препараты желатина, крахмалы —гидроксиэтилкрахмал (ГЭК)). При предельных значениях сывороточного SCr (106–177 мкмоль/л) рекомендуется тщательно взвешивать возможность и необходимость применения коллоидов, в особенности ГЭК.
Диализная терапия должна начинаться при появлении опасных для жизни нарушений водного, электролитного, кислотно-основного равновесия. Решение о начале ЗПТ следует принимать на основе оценки динамики лабораторных данных и всестороннего анализа клинической ситуации [19].
Выводы
1. ОПП является актуальной проблемой здравоохранения, решению которой будет способствовать повышение информированности врачей о важности мониторирования уровня сывороточного креатинина, объема выделяемой мочи у пациентов с высоким риском развития острого повреждения почек.
2. Развитие ОПП при ТНП связано с полиорганной дисфункцией, гиперметаболическим синдромом и может служить предиктором неблагоприятного исхода.
3. Особенностями ОПП при ТНП являются тромбоцитопения, гипопротеинемия, значительное повышение уровней АЛТ и АСТ, выраженность которых свидетельствует о тяжести ПОД, ГМС, гипоксии тканей.
4. При ТНП ОПП часто развивается на фоне ХБП ІІ–IV ст. (ангиогенный нефросклероз при ГБ, ИБС; диабетический гломерулосклероз).
5. С целью ранней диагностики ОПП необходимо исследование биомаркеров почечного повреждения у пациентов из групп риска, к которым относится ТНП.
6. При выборе эмпирической терапии ТНП необходимо учитывать нефротоксичность антибиотиков, коллоидных растворов с учетом соотношения риск/польза.
7. Учитывая разнообразие клинических проявлений ОПП, их разнонаправленность, фазовое течение ПОД и ГМС, которые способствуют развитию поражения почек при ТНП, желательно проводить исследование генетического полиморфизма, различий в экспрессии генов и протеома с целью выделения фенотипов этого опасного осложнения тяжелой негоспитальной пневмонии, обоснования персонализированного подхода к лечению.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Вельков В.В. NGAL (липокалин-2) — «ренальный тропонин», ранний маркер острого повреждения почек: значение для нефрологии и кардиохирургии (ч. 1) / В.В. Вельков // Лабораторна діагностика. — 2012. — № 1 (59). — С. 42-47.
2. Данилов И.А. Полиорганная недостаточность: состояние проблемы и современные методы лечения с использованием низкопоточных мембранных технологий / И.А. Данилов, А.М. Овечкин // Общая реаниматология. — 2011. — 11 (6). — С. 66-71.
3. Иванов Д.Д. Острое повреждение почек / Д.Д. Иванов // Медицина неотложных состояний. — 2012. — 3 (42). — С. 16-19.
4. Лейдерман И.Н. Синдром гиперметаболизма — универсальное звено патогенеза критических состояний / И.Н. Лейдерман, В.А. Руднов, А.В. Клейн // Вестник интенсивной терапии. — 1997. — № 3. — С. 17-23.
5. Мавродий В.М. Вирус-ассоциированные пневмонии / В.М. Мавродий, В.Ю. Артеменко // Укр. терапевт. журнал. — 2015. — № 1. — С. 95-101.
6. Макеева Е.Р. Влияние острого повреждения почек на прогноз больных с острой декомпенсацией хронической сердечной недостаточности / Е.Р. Макеева, М.В. Мензоров, А.М. Шутов и др. // Сердечная недостаточность. — 2014. — 182 (1). — С. 32-38.
7. Маршалл В.Дж. Клиническая биохимия / В.Дж. Маршалл: Пер.с англ. — М.; СПб.: БИНОМ: Невский Диалект, 1999. — С. 265.
8. Молчанова Л.В. Молекулярные аспекты полиорганной недостаточности: система цитокинов. Фундаментальные проблемы реаниматологии (Избранные лекции и обзоры) // Труды института общей реаниматологии РМН. — 2005. — Т. 4. — С. 190-209.
9. Смирнов А.В. Клиника и диагностика острого повреждения почек / Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Каюков И.Г. // Острое повреждение почек. — М.: МИА, 2015. — С. 80-206.
10. Черный В.И. Новые направления деэскалационной антибактериальной терапии в медицине критических состояний и проблема MRSA-инфекций в отделениях интенсивной терапии / В.И. Черный, А.Н. Колесников, А.Г. Лунева и др. // Медицина неотложных состояний. — 2006. — № 5. — С. 74-78.
11. Чучалин А.Г. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых / А.Г. Чучалин // Consilium Medicum. — 2015. — Т. 17, № 3. — С. 8-37.
12. Шраменко Е.К. Динамические изменения 5-NGAL у больных с острым повреждением почек различного генеза / Е.К. Шраменко // Укр. журнал хирургии. — 2014. — 2 (25). — С. 114-117.
13. Chertov G.M. Acute kidney injury, length of stay, and costs in hospitalised patients / G.M. Chertow, E.Burdick, M. Honour et al. // J. Am. Soc. Nephrol. — 2005. — 16 (11). — P. 3365-3370.
14. Cuest G.M. The stress response and critical illness: a review / J.M. Cuest, M. Singer // Critical care medicine. — 2012. — 40 (12). — P. 3283-3289.
15. Das S. Insulin — resistance and beta-cell function as prognostic indicator in multiorgan disfunction syndrome / S. Das, B. Mistra, L. Roul et al. // Metabol. Syndr. Relat. Disord. — 2009. — 7 (1). — P. 47-51.
16. Gens H. Biomarcers for the prediction of acute kidney injury a narrative review on current status and future challenges / H. Gens, M. Betjes, J. Baccer // Clinical Kidney J. — 2012. — V. 5. — 2. — P. 102-108.
17. Grimble R.F. Inflammatory status and insulin resistance / R.F. Grimble // Curr. Opin. Clin. Nutr. Metab. Care. — 2002. — 5. — P. 551-559.
18. Haase M. The outcome of neutrophil gelatinase — associated lipocain-positive subclinical acute kidney injury: a multicentre pooled analysis of prospective studies / M. Haase, P. Devarajan, A. Haase-Fielitz et al. // J. Amer. Coll. of car–diol. — 2011. — V. 57. — 17. — P. 1752-1761.
19. KDIGO Clinical Practice Gudeline for Acute Kidney Injury // Kidney Intern. Suppl. — 2012. — V. 2 (1). http: //www.kidney-international,org
20. Madach K. 4es/5G polymorphism of PAL-1 gene is associated with multiple organ dysfunction and septic shock in pneumonia induced severe sepsis: prospective, observational, genetic study / K. Madach, I. Aladzsity, A. Scilagyi et al. // Crit. Care. — 2010. — 14 (2). — R79. doi: 10.1186/cc 8992.
21. Marik P.G. Stress — hyperglycemia, insulin and immunomodulation in sepsis / P.E. Marik, M. Radhavan // Intensive Care Med. — 2004. — 30. — P. 748-756.
22. McCowen K.C. Stress-induced hyperglycemia / K.C. McCowen, A. Malhotra, B.K. Bistrain // Crit. Care Clin. — 2001. — 17. — P. 107-124.
23. Sapru A. 4G/5g polymorphism of plasminogen activator inhibitor-1gene is associated with mortality in intensive careunit patients with severe pneumonia / A. Sapru, H. Hansen, T. Ajayi et al. // Anestesiology. — 2009. — 110. — P. 1086-1091.
24. Singer M. Multiorgan failure is adaptive, endocrine-mediated, metabolic response to over helming systemic inflammation // M. Singer, V. de Santis, D. Vital, W. Jeffcoate // Lancet. — 2004. — 364 (9433). — P. 545-548.
25. Uchino S. Acute renal failure in critically ill patients: a multinational multicentre study / S. Uchino, J.A. Kellum, R. Bellomo et al. // JAMA. — 2005. — 294 (7).—P. 813-818.
26. Zeng X. Incindence, outcomes, and comparisons across definitions of AKI in hospitalized individuals / X. Zeng, G.M. McMahon, S.M. Brunelli et al. // Clin. J. Am. Soc. Nephrol. — 2014. — 9 (1). — P. 12-20.

/48-2.jpg)
/48-1.jpg)