Вступ
Пошкодження осьової частини центральної нервової системи, що пов’язане з проведенням процедур нейроаксільної анестезії або медицини болю, відносять до анатомічного та/або фізіологічного пошкодження спинного мозку (СМ), корінців спинномозкового нерва або їх кровопостачання.
Механізм пошкодження часто піддається ідентифікації, як у разі епідуральної гематоми або абсцесу, але може бути надзвичайно складним для його точного визначення, про що свідчить значна кількість випадків непередбачуваного пошкодження судин СМ [1].
Американська спілка з регіонарної анестезії та медицини болю (ASRA) у 2008 і 2012 роках на підставі роботи спеціально створених консультативних комітетів із відомих спеціалістів у цій сфері, аналізі доступних літературних та експериментальних даних створила методичні рекомендації із запобігання ускладненням під час виконання нейроаксіальної анестезії [1, 2].
Водночас автори досліджень зазначають, що через надзвичайну рідкісність виникнення окремих ускладнень такі традиційні методики, як рандомізовані контрольовані дослідження, метааналіз або значні дослідження серії випадків рідко зустрічаються і навряд чи будуть у подальшому відмічатися в науковій літературі. Ці рекомендації призначені для стимулювання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [1, 2].
Метою даного наукового огляду є надання інформації щодо анатомо-фізіологічних пошкоджень центральної нервової системи під час виконання нейроаксіальної анестезії з огляду на останні літературні повідомлення та власні результати.
Дані, що подані в цій статті, можуть допомогти в окремих випадках знизити ймовірність виникнення пошкодження. Проте, ґрунтуючись на поточному статусі знань, багато з описаних нами пошкоджень не є ні прогнозованими, ні попереджаючими.
Механічне пошкодження
Під час проведення нейроаксіальної анестезії можливі пошкодження безпосередньо СМ, спинномозгових корінців у спинномозковому каналі чи в місці виходу через міжхребцеві отвори унаслідок прямої травми голкою/катетером або компресії об’ємним утвором (гематома, абсцес) і наступної ішемії. Наслідком можуть бути стійкий неврологічний дефіцит, минущі порушення або ж відсутність клінічної симптоматики (рис. 1).
Ятрогенна травма спинного мозку
Частота виникнення травми СМ від голки/катетера залишається невідомою, але, безперечно, є невеликою. За 10 років у Швеції пряме травмування голкою було виявлено лише в 9 із 1,7 мільйона випадків проведення нейроаксіальної анестезії (0,0005 %), і лише 1 випадок зафіксовано з 2000 досліджених випадків у французьких реабілітаційних центрах спинного мозку (з оціненого 1 мільйона нейроаксіальних анестезій, що проводилися того ж року в даному регіоні) [3, 4].
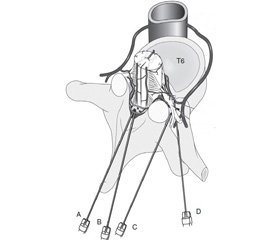
Хребці та їх відростки захищають вразливі нервові структури, залишаючи анестезіологу декілька «вікон» для субарахноїдального доступу. Для запобігання травмі СМ пункція робиться нижче від conus medullaris, що вважається безпечним. За даними літератури, найчастіше пряме пошкодження спинного мозку пов’язане з надмірно низьким його закінченням або некоректною локалізацією кісткових орієнтирів [3, 5] (рис. 2).
/62-2.jpg)
Зазвичай спинний мозок закінчується на рівні L1–L2 міжхребцевого проміжку, але в літературі описані варіанти його закінчення від T12 до L4 [5, 6, 49]. Лінія, проведена між crista iliaca, що часто використовують як орієнтир, як правило, проходить через L4–L5 міжхребцевий проміжок або остистий відросток L4 (рис. 3) [50]. Однак залежно від анатомічних особливостей може проходити через L3–L4, L5–S1. Дослідження показують, що в 40 % породіль ця лінія пальпаторно проходить через L3 міжхребцевого проміжку або вище [7]. Недбале визначення кісткових орієнтирів або особливості анатомії пацієнта (якщо ці орієнтири погано пальпуються) може спричинити пункцію вище від запланованого рівня, що може призвести до прямого травмування СМ. У складних випадках (ожиріння, сколіоз, попередні втручання на хребті) у визначенні рівня пункції може допомогти ультрасонографія [8].
Ще дві анатомічні особливості слід враховувати при проведенні епідуральної анестезії. Так, при проходженні голки через ligamentum flavum відчувається опір із наступною втратою супротиву, що є індикатором входження в епідуральний простір. У частини людей ligamentum flavum не зрощена по середній лінії, що зумовлює вхід в епідуральний або субдуральний простір без характерних відчуттів. Така анатомічна аномалія найчастіше зустрічається в грудному або шийному відділах [9]. Схожі труднощі можуть бути при вроджених патологіях хребта, таких як spina bifida. Зменшення передньозаднього розміру епідурального простору від 5–13 мм у поперековому відділі до 2–4 мм — у грудному і 0,4 мм — у шийному може бути причиною провалу голки при пункції на цих рівнях. Також варто враховувати, що у верхньошийних відділах цей простір взагалі може не існувати [10].
При проходженні голки в речовину СМ відбувається розрив нервової тканини (із можливим подальшим набряком і гематомою), а якщо введено МА, додаються його токсичний вплив та можливе утворення фістули. Лише проходження голки через СМ або спинномозковий корінець без введення МА рідко призводить до серйозного пошкодження. Оскільки СМ не має чутливої іннервації, голка або катетер проходять у нього без відчуттів [11]. Навпаки, ін’єкція МА в СМ найчастіше супроводжується інтенсивними відчуттями, що зумовлено підвищенням інтрамедулярного тиску та впливом на аферентні нейрони [11]. Іннервація менінгеальних оболонок до кінця не вивчена. При пункції голкою менінгеальних оболонок може виникати відчуття тиску, болю або парастезії. При введенні МА епідурально чутливість менінгеальної оболонки зменшується. Така нейроанатомія СМ та його оболонок не забезпечує обов’язкове виникнення відчуттів при травмі голкою чи катетером. Значення парестезій при спінальній анестезії не з’ясовано. Вони спостерігаються досить часто (6,3 %), але пошкодження виникає рідко — 0,8 на 10 000 випадків [12, 13]. За результатами аналізу випадків травмування, під час виконання нейроаксіальної анестезії деякі пацієнти не мали ніяких відчуттів, інші відчували парестезії, а деякі — біль. Тобто слід пам’ятати, що виникнення болю під час введення МА може бути ознакою травмування нервової тканини [13].
Травма спинномозкових корінців або спинномозкових нервів є іншою причиною механічного пошкодження. Спинномозкові корінці добре захищені кістковими структурами від прямого травмування голкою при серединному чи парамедіальному доступі (рис. 4). Вони можуть бути травмовані при сильному відхиленні голки або при інших видах анестезій, таких як паравертебральна блокада або блокада поперекового сплетення в занадто медіальному доступі. Особливо небезпечні пункції, що направлено через міжхребцеві отвори, які застосовуються в практиці медицини болю. Вони проводяться під рентгенконтролем і створюють загрозу пошкодження як нервових корінців, так і судин. А хибне введення стероїдів інтраартеріально може спровокувати інфаркт на відповідному рівні СМ або стовбурі головного мозку. Описані випадки пошкодження СМ місцевим анестетиком, що помилково введений у периферичний нерв при регіонарній анестезії та ретроградно поширився вздовж периневрію [11].
/63-1.jpg)
Рекомендації: фактори, що можуть обмежити виникнення нейроаксіального пошкодження
Анатомічні фактори
— Помилкове визначення хребетного рівня, невраховане латеральне введення голки чи відхилення, патологічне каудальне завершення спинного мозку або нездатність жовтої зв’язки влитися до серединної лінії можуть сприяти виникненню прямого травмування голкою. Рекомендовано враховувати зазначені анатомічні умови, зокрема в пацієнтів із складною анатомією тіла (наприклад, що може відбутися при ожирінні, кіфосколіозі та інших умовах). Ультразвукове дослідження або флюороскопію можна вважати допоміжним засобом у точному визначенні хребетного рівня в зазначених складних випадках (клас І).
— Положення пацієнта на операційному столі, тяжкий стеноз спинномозкового каналу, а також специфічні об’ємні екстрадуральні ураження (наприклад, епідуральний ліпоматоз, гіпертрофія жовтої зв’язки, синовіальна кіста або епендимома) пов’язані з виникненням тимчасового або постійного пошкодження спинного мозку разом із методиками проведення нейроаксіальної регіонарної анестезії. Ці умови є особливо важливими, якщо вони співіснують з епідуральною гематомою або абсцесом. Наявність цих умов має наштовхувати на аналіз відношення ризику та користі при виборі методик проведення нейроаксіальної регіонарної анестезії (клас І).
— Пацієнтам із виявленим новоутворенням в епідуральному просторі необхідно пройти нейроаксіальні дослідження візуалізації з метою визначення ступеня пухлинної маси. Якщо новоутворення знаходиться близько до ділянки, в яку планується введення епідурального розчину, необхідно розглянути застосування альтернативних методів анестезії чи знеболювання (клас ІІ).
— Для пацієнтів, яким проводять нейроаксіальну ін’єкцію для лікування болю (наприклад, цервікальне епідуральне введення стероїдів через інтерламінальний шлях), необхідно провести такі радіологічні дослідження, як комп’ютерна томографія (КТ) або магнітно-резонансна томографія (МРТ), з метою оцінки розмірів спинномозкового каналу, а отриману інформацію слід проаналізувати щодо ризику і користі, а також вибору найбезпечнішого рівня для проникнення (клас ІІ).
Фізіологічні фактори
В методичних рекомендаціях Американського товариства регіонарної анестезії та медицини болю рекомендовано враховувати та уникати умов, що пов’язані з утворенням епідуральної гематоми або епідурального абсцесу. До таких умов належать супутній або неминучий прийом антикоагулянтних препаратів, застосування багатьох антикоагулянтних препаратів, неправильне використання асептичних засобів, а також проведення блокади при септичному стані.
Ці рекомендації призначені для покращання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних –наслідків [1, 2].
Пошкодження за рахунок стиснення та спінальний стеноз
Екстра- та інтрадуральні об’ємні утворення (гематома, абсцес, пухлина, кісти міжхребцевих дисків, епідуральний ліпоматоз, анкілозивний спондиліт) зменшують поперечний просвіт спинномозкового каналу, що призводить до прямої компресії СМ, зменшення току крові по артеріях, венозного відтоку та підвищення лікворного тиску. Це, зі свого боку, створює умови для пошкодження СМ при спінальній та епідуральній анестезії/аналгезії [1, 2] (рис. 7).
/66-1.jpg)
Введення розчину анестетика може підвищувати тиск в епідуральному просторі або тиск цереброспінальної рідини, що знижує спинномозковий кровотік із наступною ішемією [1, 2]. Порушення перерозподілу розчину МА зумовлює його місцеву нейротоксичність. Зменшення поперечного просвіту спинномозкового каналу можливе за рахунок дегенеративних змін хребта, набутих утворень та позиційних деформацій від певного положення на операційному столі. До дегенеративних змін належать остеопороз, гіпертрофія кісток та м’яких тканин, що зменшує ширину міжхребцевих отворів, унаслідок чого зменшується відтік анестетика з епідурального простору. Введення в епідуральний простір розчину анестетика тимчасово підвищує в ньому тиск, але травматизація СМ при цьому не доведена. Такі анатомічні зміни можуть проявлятися клінічно, а можуть бути й безсимптомні. Ступінь спінального стенозу варіює від легкого до тяжкого, 19 % пацієнтів 60-річного віку мають абсолютний спінальний стеноз (передньозадній діаметр спінального каналу — менше від 1 см) [14] (рис. 5).
/65-1.jpg)
Найпершу ознаку взаємозв’язку між патологією спинного мозку та підвищеним ризиком виникнення нейроаксіального пошкодження було визначено V. Moen та його колегами в 1,7 мільйонa випадків нейроаксіальної анестезії, що проводилася у Швеції за період із 1990 по 1999 р. [3]. Із 33 випадків спинномозкової гематоми одна третина була пов’язана з коагулопатією або профілактикою тромбозу (в однієї третини цих випадків профілактику тромбозу призначали відповідно до опублікованих методичних інструкцій). Дана звітна інформація зіставляє надзвичайно рідкісне явище гематоми спинного мозку в молодих жінок, яким проводили нейроаксіальну анестезію при пологах, із випадками гематоми в жінок літнього віку, які перенесли оперативне втручання після перелому стегна, — 1 : 200 000 та 1 : 22 000 відповідно або з явищами спинномозкової гематоми в жінок літнього віку, яким проводили тотальне ендопротезування кульшового суглоба, — 1 : 3600 [3].
Під час проведення діагностичної візуалізації було зафіксовано 6 із 33 випадків, у яких виявлено попередньо недіагностований стеноз спинномозкового каналу або анкілозивний спондилоартрит. При зазначених умовах циркуляція спинного мозку може порушуватися до більшого ступеня. Особливо страждали жінки літнього віку, які становили основу даної групи і порівнювалися з пацієнтками-породіллями з неушкодженим спинномозковим каналом, які, ймовірно, перенесли недостатню циркуляцію крові меншого ступеня внаслідок гематоми аналогічного розміру [3, 16].
Ретроспективний аналіз нейроаксіальних анестезій, що проводилися пацієнтам із діагностованими спінальними стенозами чи кістами міжхребцевих дисків, показав наявність 1,1 % ней–роаксіальних ускладнень, що вище, ніж у пацієнтів без таких захворювань [15]. Із спінальними стенозами пов’язують збільшення кількості постпункційних гематом у хворих похилого віку. Отже, у разі відомого вираженого стенозу спинномозкового каналу в пацієнта рішення про виконання нейроаксіальної анестезії слід приймати в кожному конкретному випадку, зважуючи користь/ризик (рис. 10). Під час проведення нейроаксіальних анестезій рекомендується приділяти більше уваги ускладненням [1, 2]. Немає переконливих даних щодо пошкодження, якщо рівень анестезії віддалений від рівня стенозу [2]. Наприклад, стеноз на поперековому рівні впливає незначно і не є протипоказанням для проведення епідуральної анестезії в грудному відділі [1]. Пацієнтам із відомою пухлиною епідурального простору має проводитися нейровізуалізація для з’язування поширення процесу. Якщо пухлина близько розташована до запланованого місця встановлення епідурального катетера, то слід розглянути альтернативний метод анестезії. Пацієнтам, яким планується нейроаксіальна анестезія для лікування болю (епідуральне введення стероїдів у шийний відділ), також необхідно проводити нейровізуалізацію (МРТ, КТ) для вибору оптимального та безпечного рівня пункції [17]. Набуті утворення розміщуються інтрадурально (інтрамедулярні пухлини або гранульоми внаслідок тривалого перебування інтратекального катетера) та екстрадурально (епідуральна гематома або абсцес, гіпертрофія жовтої зв’язки, ліпоматоз, епіндимома) (рис. 7, 8). Певне положення на операційному столі (надмірний лордоз, літотомічне положення або бокове торакотомічне) також може зменшувати поперечний просвіт спинномозкового каналу [18].
/67-1.jpg)
Епідуральна гематома — відносно рідкісне ускладнення нейроаксіальної анестезії. Частота її виникнення становить, за різними даними, від 1 на 2700 до 1 на 19 505 [19] (рис. 6).
Фактори ризику: прийом хворим антикоагулянтів чи антиагрегантів, жіноча стать, технічно складна пункція. Більший ризик відмічається після епідуральної анестезії, ніж спінальної. Частіше виникає після епідуральної анестезії в поперековому відділі (1 : 1341), ніж у грудному (1 : 10 199) [19].
/68-1.jpg)
Також, як показали дослідження, частота виникнення епідуральної гематоми вища в пацієнтів із спінальними стенозами або анкілозивним спондилітом, тобто станами, пов’язаними із зменшенням просвіту спинномозкового каналу й порушенням циркуляції крові в СМ [3]. Епідуральна гематома з компресією СМ — це загрозливий для здоров’я хворого стан, що потребує вирішення в межах 6–12 годин. Ознаками компресії спинного мозку можуть бути тривалий моторний чи сенсорний блок, відчуття тиску в місці пункції, дисфункція сечового міхура. Якщо підозрюється компресія СМ, методом вибору є МРТ. Якщо вона недоступна, КТ має бути виконана невідкладно. Єдиним ефективним методом лікування є ламінектомія, і чим скоріше вона виконана, тим кращі неврологічні наслідки [19].
Рекомендації для пацієнтів із стенозом спинномозкового каналу
— Стеноз спинного мозку становить континуум порушення спинномозкового каналу в результаті гіпертрофованої жовтої зв’язки, гіперостозу та/або дегенеративних змін, таких як остеопороз або грижа міжхребцевого диска. Пацієнти із патологією спинномозкового каналу (наприклад, стеноз спинного мозку, захворювання поперекового диска) можуть мати клінічне або субклінічне підтвердження наявного раніше неврологічного розладу у зв’язку зі стадією неврологічного захворювання. Однак навіть помірно тяжкий стеноз спинномозкового каналу не завжди є симптоматичним; багато пацієнтів не знають про те, що мають зазначене захворювання (клас І).
— У разі, коли проведення нейроаксіальної анестезії ускладнюється розвитком об’ємних новоутворень у межах спинномозкового каналу (наприклад, гематома або абсцес), отримані постоперативні неврологічні ускладнення, ймовірно, можуть бути більш тяжкими в пацієнтів із стенозом або іншою обструктивною патологією спинного мозку, включаючи зміни під час позиціювання пацієнта (клас І).
— У пацієнтів із виявленим тяжким стенозом спинномозкового каналу або симптомами, зазначеними вище, рекомендовано провести аналіз ризику щодо користі перед проведенням нейроаксіальної анестезії у зв’язку з прямим відношенням стенозу спинного мозку до виникнення неврологічних ускладнень під час нейроаксіальної блокади. Якщо нейроаксіальна блокада вже в стадії проведення, рекомендовано проявляти підвищену періоперативну пильність стосовно симптомів, характерних для неврального порушення (клас ІІ).
— Немає жодного прямого зв’язку з пошкодженням, якщо стеноз спинного мозку локалізується в ділянці далеко від рівня введення нейроаксіального анестетика (клас ІІІ).
— У разі, якщо заплановане проведення ней–роаксіальної анестезії, практикуючий медичний фахівець може розглянути питання про зменшення кількості місцевого анестетика (об’єм × концентрація). У багатьох повідомленнях зазначається про обумовлений взаємозв’язок між великим об’ємом та виникненням нейроаксіального пошкодження на фоні інших значних уражень, таких як, наприклад, епідуральний ліпоматоз (клас ІІІ).
— У науковій літературі було визначено зв’язок між стенозом спинного мозку та пошкодженням унаслідок нейроаксіальної блокади, що частіше за все виникає в пацієнтів, яким діагноз стенозу спинного мозку був установлений під час додаткового обстеження вже після пошкодження. Немає жодного переконливого доказу того, що стеноз спинного мозку сам по собі викликав зазначені пошкодження (клас ІІ).
— На сьогодні невідомо: розвиток нових або погіршення наявних неврологічних симптомів після нейроаксіальної анестезії чи знеболювання викликані хірургічними факторами, методом анестезії, природним прогресуванням патології спинного мозку або поєднанням усіх зазначених факторів (клас ІІ).
Ці рекомендації призначені для покращання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [1, 2].
Ішемія спинного мозку та пошкодження судин
Порушення кровотоку спинного мозку може виникнути внаслідок різних механізмів, включаючи травмування голкою, що впливає на судинне русло (рис. 4), компресивні об’ємні ураження (рис. 7) або судинні спазми (рис. 12). Кровотік спинного мозку може також порушуватися внаслідок деяких умов, за яких можуть виникнути виражена і тривала системна гіпотензія, емболічні процеси або судинний стеноз [1, 2].
/70-1.jpg)
Артеріальний кровотік у СМ надходить по сегментарних артеріях, що беруть початок від вертебральних, підключичних артерій або аорти. Сегментарні артерії віддають спинномозкові гілки, що проходять через міжхребцеві отвори, та формують сітку анастомозів із трьома поздовжніми артеріями (передньою та двома задніми спінальними артеріями). Нижньогрудний та поперековий відділи забезпечуються зазвичай найбільшою із сегментарних артерій — артерією Адамкевича. Сегментарні артерії далі продовжуються в передню та задню корінцеві артерії. Дві третини кровотоку речовини СМ забезпечує передня спінальна артерія [20]. Щоб її травмувати, голка має пройти через всю товщу СМ (рис. 11, 12). Травма однієї із задніх артерій не призводить до порушення кровотоку завдяки густій сітці анастомозів. Сегментарні артерії або спінальні гілки можуть бути травмовані при сильному відхиленні голки латерально або при проведенні паравертебральної блокади, блокади черевного сплетіння чи ін’єкції через міжхребцеві отвори в практиці медицини болю [21]. Порушення кровотоку спинного мозку також може виникнути після обумовленої процедурою гематоми або медикаментозно обумов–леного спазму судин, що пов’язаний із такими невро–літичними процедурами, як блокада сонячного сплетіння (рис. 12), проте точного підтвердження зазначених вище механізмів немає [2].
Спинномозкові інфаркти при трансфорамінальних ін’єкціях для лікування больових синдромів пов’язують із введенням стероїдів. Тому введення стероїдів протипоказане на шийному рівні, де наслідки можуть бути катастрофічні [22]. Ішемія або інфаркт СМ, що пов’язаний із НА, представлений синдромом передньої або задньої спинномозкової артерії, інфарктом у судинному басейні або невизначеним пошкодженням, що вказує на критично зменшений або відсутній кровотік спинного мозку. Як і пряма травма СМ, ці ускладнення вкрай рідкісні: із 821 випадку нейроаксіального ушкодження, за даними Американської асоціації анестезіологів, лише 10 були результатом ішемії [23]. Найбільший ризик виникнення періопераційного інфаркту СМ у хірургії аорти, спінальній хірургії, при втручаннях на серці та грудній клітці. Оскільки дві третини речовини СМ кровопостачається з передньої спінальної артерії, ішемія або інфаркт у цьому басейні є найбільш значними і мають назву «синдром передньої спинномозкової артерії» (СПСА). Проявляється як безболісний млявий параліч нижніх кінцівок із збереженням пропріорецепції та різноманітним сенсорним дефіцитом. Причинами СПСА, імовірно, є атеросклероз, хірургія аорти і/або тяжка гіпотензія [1].
Контроль артеріального тиску при проведенні нейроаксіальної анестезії
Усе більше уваги фахівців приділяється конт–ролю артеріального тиску під час нейроаксіальної анестезії. Незважаючи на те, що авторегуляція кровотоку спинного мозку відображає церебральний кровотік, мабуть, інфаркт спинного мозку трапляється рідше, ніж у визначеному коефіцієнті 0,1 % виникнення періоперативного церебрального інфаркту в пацієнтів, які перенесли оперативні втручання, за винятком кардіологічного та неврологічного напрямків [24, 25]. Рідко повідомляється про виникнення ішемії спинного мозку та інфаркту навіть після клінічних випадків довготривалого низького середнього артеріального тиску, наприклад при серцево-легеневому шунтуванні або індукованій гіпотензії до середнього артеріального тиску (САТ) 60 мм рт.ст. або нижче [26].
Тоді як у відносно рідкісних випадках у тих, хто вижив після зупинки серцевої діяльності, розвивається ішемічне ураження спинного мозку, у 46 % осіб, котрі померли від зупинки серцевої діяльності або тяжкого гіпотензивного випадку, при автопсії виявлялася ішемічна мієлопатія спинного мозку [27].
За аналогією із головним мозком СМ теж має межі САТ, при якому спрацьовують механізми авторегуляції, що дозволяють підтримувати спинномозковий кровообіг. Раніше межі авторегуляції СМ визначались як САТ від 50–60 до 120–135 мм рт.ст. [24, 28]. Протягом останніх років Drummond та його колеги поставили під сумнів прийняте попередньо судження щодо діапазону 50 мм рт.ст., що становить відповідну та сумісну нижню межу авторегуляції головного мозку в людини. Замість цього вони презентували підтвердження того, що нижня межа авторегуляції головного мозку значно варіює серед пацієнтів, а тому, імовірніше, у нормотензивної дорослої людини, якій не проводять анестезію, вона є ближчою до 60–65 мм рт.ст. [29]. За наявності гіпертензії (систолічний тиск вище від 160 мм рт.ст.) вона може бути ще вищою [2].
У клінічному дослідженні, в якому точно визначається нижня межа авторегуляції головного мозку в пацієнтів, які перенесли серцево-легеневе шунтування, середньою нижньою межею авторегуляції був середній артеріальний тиск 66 мм рт.ст., що значно коливався (інтервал передбачення — 95 %, 43–90 мм рт.ст.) [30]. В іншому дослідженні зазначалося, що в пацієнтів, які перенесли оперативне втручання на плечовому суглобі, часто досягалася нижня межа авторегуляції головного мозку при середньому артеріальному тиску 65–70 мм рт.ст., зокрема коли вони знаходилися в положенні пляжного крісла (напівсидяче положення) [31]. Хоча в цьому ж проспективному дослідженні повідомлялося про те, що пацієнти, яких було прооперовано в положенні пляжного крісла, часто переносили знижену авторегуляцію в широкому діапазоні середнього артеріального тиску (70 мм рт.ст.; міжквартильний діапазон — 55–80 мм рт.ст.), проте в них не проявлялися ознаки пошкодження головного мозку. Так само відмічалось при дослідженні собак, коли їм проводили анестезію спинного мозку, а потім у них різко розвивалася кровотеча, кровотік спинного мозку починав зменшуватися при середньому артеріальному тиску 66 мм рт.ст. [32].
Непрямий доказ про руйнівне значення гіпотензії можна виявити при хірургічному втручанні на деформованій ділянці хребта, де коригування гіпотензії орієнтоване на обернені електрофізіологічні ознаки дисфункції спинного мозку [33].
Фізіологічний резерв САТ, що нижчий від рівня авторегуляції, при якому починається пошкодження клітин, для СМ невідомий, але припустимо на 30–40 % менший від початкового рівня АТ [2, 26]. У дослідженні із залученням 48 241 пацієнта, яким проводилися оперативні втручання (за виключенням кардіохірургічних та нейрохірургічних), відзначалося, що хворі із зниженням САТ менше 30 % від початкового рівня мали значимо більший ризик виникнення періоперативного ішемічного інсульту, що також корелював із тривалістю гіпотензії [34].
За початковий рівень прийнято брати артеріальний тиск, що вимірювався в останній місяць до операції. Хоча теоретичне підґрунтя для спінальних ішемічних інсультів при системній гіпотензії існує. У практичних ситуаціях, таких як штучний кровообіг, керована гіпотензія, серцева легенева реанімація, за наявності тривалого низького тиску вони зустрічаються дуже рідко. Хоча низький артеріальний тиск є безпечним для більшості пацієнтів, очевидно, що існує непередбачувана група пацієнтів, які перебувають у групі ризику виникнення пошкодження спинного мозку, коли низький артеріальний тиск супроводжується стенозом спинномозкового каналу, анемією, гіпокапнією, підвищеним інтраторакальним тиском (наприклад, під час механічної вентиляції в пацієнтів із пошкодженими легенями), через надзвичайно високе положення пацієнта, хронічну гіпертензію, невстановлені патології судинної системи, коливання нижньої межі авторегуляції, а також невизначені обставини [1, 2, 29, 34].
На жаль, на сьогодні відсутні великі клінічні дослідження, що безпосередньо пов’язують низький артеріальний тиск із ішемією спинного мозку, і немає жодних вірогідних історичних або діагностичних критеріїв, які б ідентифікували чутливих до ішемії спинного мозку пацієнтів на фоні нейроаксіальної регіональної анестезії.
Для безпеки пацієнта, Американська асоціація анестезіологів рекомендує підтримувати САТ не менше ніж на 20–30 % від початкового рівня принаймні тривалий період [1, 2].
Діагностика і лікування
Якщо проявляються ознаки і симптоми ішемії спинного мозку, для виключення можливих коригувальних причин, таких як гематома спинного мозку або абсцес, є обов’язковим проведення негайної інтервенційної процедури. На основі клінічної картини анестезіолог може обрати зменшення чи припинення введення МА та зробити повторну оцінку стану пацієнта протягом години або як альтернатива перейти безпосередньо до візуалізаційного дослідження для виключення внутрішньо–хребтового утворення, що піддається лікуванню. Для діагностування ішемії магнітно-резонансне сканування необхідно виконати протягом перших кількох годин прояву симптомів [36].
При підозрі на ішемію рекомендуються нормалізація або індукування артеріального тиску в діапазоні верхньої норми та/або дренаж спинномозкової рідини, але ефективність цих методів наукова література підтримує не повністю [25].
Конкретні дані щодо значення кортикостероїдів у лікуванні нейроаксіального пошкодження, пов’язаного з анестетиком або процедурою медицини болю, відсутні, тому залишається екстраполювати наукову літературу про травматичне пошкодження головного та спинного мозку, а також цереброваскулярну ішемію з пошкодженнями в результаті проведення анестезії. Кортикостероїдні препарати мають свідчення Кокранівського огляду для покращання результатів лікування після гострого травматичного пошкодження спинного мозку [37]. З іншого боку, кортикостероїди не проявили ефективного терапевтичного ефекту в лікуванні гострої травми голови або інсульту головного мозку [38]. Більше того, значна і зростаюча кількість наукової літератури вказує на те, що кортикостероїди здійснюють нейротоксичний вплив на головний мозок людини після його травматичного пошкодження внаслідок збільшення концентрації глюкози в крові [39].
Ураховуючи, що введення стероїдних препаратів проявляло гірші результати у тварин і людей на фоні неврологічної ішемії, рекомендовано не застосовувати кортикостероїдні препарати у випадках підозри на ішемію спинного мозку або інфаркт [2]. У будь-якому випадку рекомендується підтримка нормоглікемії (наприклад, шляхом введення інсуліну пацієнтові з наявною поперед–ньою гіперглікемією). Рекомендовано провести неврологічну консультацію з метою підтримки при оцінці характеру та механізмів інсульту будь-якої форми та погодження можливих стратегій лікування.
Рекомендації: контроль артеріального тиску під час проведення нейроаксіальної анестезії
— Місцеві анестетики, допоміжні речовини, а також їх поєднання мають різний вплив на кровотік спинного мозку. Зменшення кровотоку спинного мозку під дією місцевих анестетиків і допоміжних речовин зазвичай відображають зменшення в метаболічній потребі після анестезії на спинному мозку. Не існує підтвердження щодо того, що внутрішньовенне або інтратекальне введення епінефрину (адреналіну) або фенілефрину (мезатону) негативно впливає на кровотік спинного мозку (клас І).
— Нещодавно розуміння нижніх меж авторегуляції кровотоку спинного мозку покращилося з урахуванням висновків, отриманих із досліджень нижньої межі авторегуляції головного мозку. Замість раніше прийнятої нижньої межі авторегуляції мозку за середнім артеріальним тиском 50 мм рт.ст. людини установили нову нижню межу авторегуляції головного мозку в пацієнтів, яким не проводять анестезію, — вона має бути при середньому артеріальному тиску 60–65 мм рт.ст. Проте у всіх суб’єктів нижня межа авторегуляції значно коливається. Вважається, що при вже наявній гіпертензії тяжко визначити нижню межу авторегуляції, за винятком випадків, коли показники гіпертонії знаходяться на верхній межі, наприклад при систолічному тиску > 160 мм рт.ст. (клас ІІ).
— Описи клінічних випадків свідчать про надзвичайно малу групу пацієнтів, які перенесли ішемію головного чи спинного мозку з періодами тяжкого або затяжного низького артеріального тиску. Ці рідкісні випадки різко контрастують зі звичайним періоперативним виникненням відносної гіпотензії, що не призводить до ішемії спинного мозку. Ймовірно, пошкодження не проявляється у зв’язку з фізіологічним резервом, що знаходиться між нижньою межею авторегуляції та порогами артеріального тиску, нижче яких розвивається неврологічне пошкодження (клас ІІІ).
— У випадку, коли досягнуто нижню межу авторегуляції кровотоку спинного мозку, специфічні умови пацієнта можуть збільшувати ризик виникнення пошкодження. До таких умов належать знижена здатність крові транспортувати кисень, послаблення кровотоку спинного мозку від обструктивних анатомічних уражень та/або збільшеного тиску спинномозкової рідини (клас І).
— За відсутності переконливих причин лікувати пацієнта інакше рекомендовано підтримувати артеріальний тиск під час проведення нейроаксіальної анестезії в межах норми або принаймні в межах 20–30 % від вихідного рівня середнього артеріального тиску. Якщо середній артеріальний тиск виходить за нижню межу цих показників, рекомендовано не підтримувати його на цьому рівні. Хоча й ці рекомендовані показники є умовними, вони прийняті на основі досліджень значних популяцій пацієнтів, що пов’язують як ступінь, так і тривалість гіпотензії з періоперативними пошкодженнями головного мозку, нирок або міокарда (клас ІІ).
— Якщо нейроаксіальна анестезія або знеболювання супроводжуються неочікуваною тривалою сенсорною чи моторною блокадою, появою слабкості чи змінами чутливості після першого введення анестетика або невральної блокади поза межами очікуваного поширення застосованої речовини, лікар-анестезіолог повинен оперативно виключити оборотні причини цих процесів. Це може призвести до зменшення або припинення інфузії місцевого анестетика, після чого необхідно провести повторне обстеження пацієнта протягом однієї години або термінове нейровізуалізаційне дослідження для виключення компресійного процесу (гематоми або абс–цесу). Якщо пацієнтові призначено візуалізаційні дослідження, то МРТ має перевагу над КТ, але визначення діагнозу не можна затримувати, якщо для дослідження доступна тільки КТ. Хоча, якщо КТ не виявить компресійне ураження, подальше МРТ буде необхідне, якщо є підозра на ішемію спинного мозку (клас І).
— Якщо візуалізаційні дослідження виключають операбельне об’ємне ураження і є підозра на ішемію спинного мозку, практикуючі лікарі мають пересвідчитися в тому, що артеріальний тиск у межах норми, або переглянути питання про індукований збільшений діапазон артеріального тиску. Ефективність модуляції спинномозкової рідини через поперекові дренажі при ішемії спинного мозку, пов’язаної з анестезією/процедурою медицини болю, залишається невідомою, але цей метод широко застосовується в лікуванні ішемії спинного мозку внаслідок оперативного втручання і вважається безпечним на фоні його ішемічного пошкодження (клас ІІІ).
— Значення кортикостероїдів при пошкодженнях після анестезії невідоме. Кортикостероїди можуть мати позитивний ефект після прямого травмування спинного мозку внаслідок інтервенційних процедур. Однак можливий позитивний ефект для цих пацієнтів слід збалансувати з пов’язаним ризиком виникнення гіперглікемії, пов’язаної з кортикостероїдами, тобто гіперглікемія погіршує ішемічне пошкодження головного мозку (і, можливо, спинного). Не рекомендовано застосування кортикостероїдів при ішемічному пошкодженні спинного мозку. Остаточний діагноз та лікування необхідно визначити після консультації з неврологами та нейрохірургами (клас ІІІ).
Ці рекомендації призначені для стимулювання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [2].
Трансфорамінальні процедури медицини болю
Ураховуючи те, що в Україні останнім часом спостерігається розвиток інвазивних технологій із лікування болю, хотілося б навести рекомендації Американської асоціації анестезіологів стосовно трансфорамінальних процедур.
Рекомендації:
трансфорамінальні методи введення
— З метою уникнення прямого введення в критичні структури остаточне положення нерухомої голки під час трансфорамінальної ін’єкції має бути зафіксовано за допомогою введеної контрастної речовини при флюороскопічному дослідженні в режимі реального часу та/або цифрової ангіографії із застосуванням передньозаднього зображення; перед введенням будь-якої речовини, що може бути шкідливою для пацієнта (клас ІІІ).
— Через те, що існує значно підвищений ризик виникнення критичних неврологічних пошкоджень, пов’язаних із трансфорамінальним введенням у шийний відділ, не слід застосовувати корпускулярні стероїдні препарати під час трансфорамінального введення з лікувальною метою (клас ІІІ).
— Хоча сам ризик розвитку неврологічного пошкодження є значно нижчим, якщо процедура здійснюється на рівні поперекового відділу, некорпускулярний стероїдний препарат (наприклад, дексаметазон) необхідно застосовувати для першого введення при трансфорамінальних епідуральних ін’єкціях поперекового відділу (клас ІІІ).
— Застосування корпускулярних стероїдних препаратів можна розглядати за певних умов для здійснення трансфорамінальних методів введення в поперекову ділянку, наприклад після неуспішної спроби досягти лікувального ефекту за допомогою некорпускулярного стероїдного препарату (клас ІІІ).
Ці рекомендації призначені для стимулювання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [1, 2].
Нейротоксичність місцевого анестетика, арахноїдит, синдром кінського хвоста
Нейротоксичність місцевого анестетика
«Нейроаксіальні» місцеві анестетики, наркотичні і допоміжні речовини, консерванти в клінічно рекомендованих дозуваннях є досить безпечними для значної кількості пацієнтів [1, 2]. Проте деякі поодинокі пацієнти можуть бути чутливими до місцевих анестетиків та додаткової нейротоксичності, навіть за нормальних клінічних умов. За останніми даними, ні місцеві анестетики, ні допоміжні речовини не будуть впливати на виникнення пошкодження спинного мозку. Вазоактивні медичні препарати, такі як адреналін та мезатон, не мають негативного впливу на кровотік спинного мозку незалежно від місця введення (інтратекально як допоміжну речовину чи в клінічно допустимих дозах внутрішньовенно) [40, 41].
Cauda equina має унікальні особливості, що можуть бути особливо важливими щодо викликаної місцевим анестетиком нейротоксичності [1, 2]. Ці особливості включають нервові структури, які неповністю захищені мієліном, мають значне відношення поверхні до об’єму та можуть піддаватися зниженому кліренсу через обмежене судинне постачання, а також мати обмежену дилюційну здатність спинномозкової рідини при введенні місцевого анестетика в рукав дурального корінця [42].
Синдром кінського хвоста пов’язаний із стенозом спинного мозку. У дослідженні V. Moen і його колег, що охоплювало 1,7 мільйона випадків проведення нейроаксіальної анестезії, було виявлено 32 випадки синдрому кінського хвоста, 9 з яких знайшли в пацієнтів із невизначеним попередньо стенозом спинного мозку [3]. Теоретично вузький спинномозковий канал міг призвести до тиск-індукованої ішемії спинного мозку або зниженого судинного кліренсу, які могли збільшити чутливість cauda equina до нейротоксичності місцевого анестетика. У 18 випадках синдрому кінського хвоста, що пов’язаний із проведенням спінальної анестезії, 8 пацієнтам вводили 5% лідокаїн, 10 — бупівакаїн, а 1 пацієнтові давали суміш двох.
Можливо більше занепокоєння в дослідженні V. Moen та його колег викликає те, що 23 із 32 випадків не супроводжувалися нічим примітним щодо діаметра спинномозкового каналу, дозування місцевого анестетика, можливого травмування голкою або патологічних результатів візуалізаційних досліджень після пошкодження [3]. Існує декілька відомих факторів ризику розвитку синдрому кінського хвоста — після інтратекального введення надмірної дози місцевого анестетика та/або порушення поширення місцевого анестетика всередині каудального інтратекального мішка [43]. Крім того, надзвичайно мала кількість пацієнтів може мати схильність до нейротоксичності від клінічно допустимої дози місцевого анестетика. Як альтернатива, патологічне невральне запалення може розвинутися як відповідь на вплив місцевого анестетика, допоміжної речовини, травмування голкою або інших факторів, не пов’язаних із введенням анестетика [1, 2].
Арахноїдит — дифузна запальна реакція трьох менінгеальних шарів, що проявляються клінічно в спектрі від болю та втрати працездатності до гідроцефалії та смерті. Арахноїдит пов’язаний з інфекцією, травмою, інтратекальною кровотечею, контрастною речовиною, нейроаксіальним гіпертонічним розчином NaCl та різними оперативними втручаннями на спині [44]. Існує декілька етіологічних факторів арахноїдиту. Алергічна, запальна або ідіосинкразична реакція на місцеві анестетики розглядається як етіологічний фактор арахноїдиту у вкрай рідких випадках [45]. Також має велике значення застосування дезінфікуючих засобів для шкіри. Згідно з даними літератури, велике занепокоєння викликають тяжкі форми арахноїдиту внаслідок спінальної або епідуральної анестезії, при якій «найбільш ймовірний механізм — потрапляння до нервових структур розчину хлоргексидину» [46]. Багато цих випадків дуже схожі: головний біль або відчуття печіння кінцівок відмічаються відразу після введення місцевого анестетика, через декілька днів спостерігаються ознаки підвищеного внутрішньочерепного тиску від гідроцефалії, яка потребує шунтування, потім через декілька тижнів — прогресивні моторні та сенсорні порушення, які досягають ступеня параплегії та хронічного болю. Зазначена затримка прояву симптомів ускладнює процес визначення таких випадків за допомогою традиційних механізмів контролю анестезії, проте свідчить на користь ідіосинкратичного механізму, що може бути викликаний ранньою незначною реакцією запалення оболонок головного мозку на препарат, дезінфікуючий засіб або інші тригерні агенти [2].
У той же час значення суміші хлоргексидину/спирту в етіології арахноїдиту залишається нечітким та несуттєвим. Численні сучасні дослідження вказують на очевидну перевагу хлоргексидину для асептики шкіри порівняно з повідон-йодом [45]. Ґрунтуючись на перевазі хлоргексидину як антисептика та надзвичайно низькій ймовірності, що він спричинить арахноїдит за нормальних клінічних умов, рекомендовано продовжувати застосовувати його як найефективніший дезінфікуючий засіб при нейроаксіальній блокаді та блокаді периферичного нерва [2]. Проте лікарям-практикам рекомендується фізично і тимчасово ізолювати хлоргексидин від самої процедури блокади. Це означає, що розчин може повністю висохнути перед введенням голки (2–3 хвилини). Слід також вжити заходів для уникнення забруднення хлоргексидином кювети та/або препаратів для інтратекального введення, оскільки воно може статися від бризок або крапель дезінфікуючого засобу, вилучення аплікатора пристрою поблизу місця встановлення блоку, а також залиття рідкого хлоргексидину в ємності, де його можуть помилково прийняти за інші медичні препарати [2].
Рекомендації: синдром кінського хвоста, нейротоксичність місцевого анестетика, арахноїдит
— Слід уникати введення початкової або повторної дози субарахноїдального місцевого анестетика вище максимально допустимої, що може збільшити ризик виникнення нейротоксичності для спинного мозку або корінця спинномозкового нерва. Крім цього, порушення поширення місцевого анестетика (зазвичай у крижовому відділі) необхідно виключити перед повторним введенням разової ін’єкції або перед постійним субарахноїдальним введенням анестетика (клас І).
— Необхідно провести аналіз співвідношення ризику з користю від застосування методів нейроаксіальної анестезії для пацієнтів, в яких діагностована помірна та тяжка форми стенозу спинного мозку, зокрема якщо він локалізується в межах вертебральної ділянки, де планується здійснити введення (клас ІІ).
— Рекомендується прибрати подалі від кювети та інструментів і тимчасово не застосовувати хлоргексидин протягом проведення процедур нейроаксіальної анестезії. Необхідно, щоб розчин повністю висохнув на шкірі перед введенням голки (2–3 хв). Слід також слідкувати за тим, щоб не сталося забруднення голки або катетера бризками чи краплями хлоргексидину під час вилучення аплікатора пристрою або на робочих поверхнях, оброблених антисептичними засобами (клас ІІ).
Ці рекомендації призначені для стимулювання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [2].
Проведення нейроаксіальних процедур в анестезованих пацієнтів або під дією глибокої седації
«Ми визначаємо анестезованого пацієнта як такого, який перебуває під дією загальної анестезії. Пацієнт, який перебуває під дією глибокої седації, визначається таким, що не в змозі розпізнавати та/або повідомляти про будь-які свої відчуття, які б лікар зміг тлумачити як атипові під час введення анестезуючої речовини» [47]. У будь-якому разі, стан агрипнії пацієнта не є достатнім для підтримки усвідомлення можливих шкідливих подій під час процедури. Доцільність проведення регіонарної анестезії та інтервенційних процедур медицини болю у пацієнтів без свідомості залишається об'єктом для дискусій. Наприклад, деякі європейські експерти схвалюють проведення регіонарної блокади (зокрема, периферичного нерва) в анестезованих пацієнтів або під дією глибокої седації, в той час як більшість фахівців Північної Америки не рекомендують застосовувати таку практику в пацієнтів дорослої групи [48].
Значна кількість наукової літератури вказує на розбіжні описи щодо того, як саме пацієнти розповідають про контактування голки із спинним мозком. У деяких звітних документах описуються парестезія або незвичайні відчуття, коли голка проникає до спинного мозку, особливо коли це проникнення супроводжується ін’єкцією. Саме пошкодження, якщо воно взагалі відбувається, часто супроводжується такими тривожними знаками. На відміну від цього також існують клінічні описи про пацієнтів, які були під мінімальною седацією або повністю у свідомості і перенесли нейроаксіальне пошкодження, але не повідомили про незвичні відчуття під час введення голки [2]. Тому можна стверджувати, що «не можна постійно покладатися на нейроанатомію спинного мозку та його покриття з метою забезпечення запобігання та травмування, викликаних голкою або катетером», як і не можна покладатися на агрипнічний синдром як важливу складову для виявлення виникнення пошкодження [2].
Рекомендації:
застосування нейроаксіальних методів в анестезованих або під дією глибокої седації пацієнтів
— Контроль і профілактика: немає жодних даних на підтримку концепції стосовно того, що ультразвуковий контроль введення голки зменшує ризик виникнення нейроаксіального пошкодження в пацієнтів під дією загальної анестезії або глибокої седації (клас ІІ).
— Осьова частина центральної нервової системи в дорослих: такі тривожні ознаки, як парестезія або біль під час введення місцевого анестетика, непослідовно попереджають про контактування голки із спинним мозком. Проте деякі пацієнти дійсно говорять про тривожні симптоми близькості голки до осьової частини нервової системи. Перебування пацієнта під дією загальної анестезії виключає будь-яку можливість для пацієнта визначити тривожні симптоми та повідомити про них. Це наводить на думку, що нейроаксіальну регіонарну анестезію або процедури інтервенційної медицини болю зрідка необхідно проводити тим пацієнтам, чиї центри почуттів порушуються при загальній анестезії або глибокій седації. Пацієнти дорослої групи із специфічними обставинами (наприклад, затримка розвитку, множинна травма кісток) можуть бути винятками для цих рекомендацій після аналізу ризику та користі (клас ІІІ).
— Осьова частина нервової системи в дітей: користь забезпечення контактності та нерухомості немовляти або дитини дошкільного віку, ймовірно, переважає ризик проведення нейроаксіальної регіонарної анестезії для пацієнтів дитячої групи при перебуванні під дією загальної анестезії або глибокої седації. Загальний ризик від проведення нейроаксіальної анестезії необхідно зіставити з очікуваною користю (клас І).
— Анестезованими вважаються пацієнти, які перебувають під дією загальної анестезії. Глибока седація визначається як стан пацієнта, при якому під час седації він доходить до рівня, коли не в змозі розпізнати або повідомити про будь-які свої відчуття, що лікар міг би тлумачити як нетипові під час введення анестезуючого засобу.
Ці рекомендації призначені для стимулювання надання ефективної медичної допомоги пацієнтові, але вони не можуть забезпечити уникнення негативних наслідків [2].
Висновки
Патофізіологія пошкодження осьової частини нервової системи, що пов’язане з проведенням регіонарної анестезії та процедур медицини болю, передбачає, що при ньому відбувається механічне, судинне, нейротоксичне або комбіноване ураження.
Важливо також зазначити, що багато з факторів, що можуть сприяти виникненню травми спинного мозку, не можна визначити в перспективі, що дозволяє припустити, що більша частина цих травм є невідворотними та їх усунення ґрунтується на наших поточних знаннях. На щастя, випадки пошкодження осьової частини нервової системи після виконання регіонарної анестезії або процедур медицини болю трапляються надзвичайно рідко.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Neal J.M. Anatomy and pathophysiology of spinal cord injuries associated with regional anesthesia and pain medicine // Reg. Anesth. Pain. Med. — 2008. — 33. — 423-434.
2. Neal J.M., Kopp S.L., Pasternak J.J., Lanier W.L., Rathmell J.P. Anatomy and pathophysiology of spinal cord injuries associated with regional anesthesia and pain medicine // Reg. Anesth. Pain. Med. — 2015. — 40. — 506-525.
3. Moen V., Dahlgren N., Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990–1999 // Anesthesiology. — 2004. — 101. — 950-959.
4. de Sèze M.P., Sztark F., Janvier G., Joseph P.A. Severe and long-lasting complications of the nerve root and spinal cord after central neuraxial blockade // Anesth. Analg. — 2007. — 104. — 975-979.
5. Kim J., Bahk J., Sung J. Influence of age and sex on the position of the conus medullaris and Tuffier’s line in adults // Anes–thesiology. — 2003. — 99. — 1359-1363.
6. Weed J., Finkel K., BeachM.L., Granger C.B., Gallag–her J.D., Sites B.D. Spinal anesthesia for orthopedic surgery. A detailed video assessment of quality // Reg. Anesth. Pain. Med. — 2011. — 36. — 51-55.
7. Lee A.J., Ranasinghe J.S., Chehade J.M. et al. Ultrasound assessment of the vertebral level of the intercristal line in pregnancy // Anesth. Analg. — 2011. — 113. — 559-564.
8. Chin K.J., Perlas A., Chan V., Brown-Shreves D., Koshkin A., Vaishnav V. Ultrasound imaging facilitates spinal anesthesia in adults with difficult surface anatomic landmarks // Anesthesiology. — 2011. — 115. — 94-101.
9. Hogan Q.H. Epidural anatomy examined by cryomicrotome section. Influence of age, vertebral level, and disease // Reg. Anesth. — 1996. — 21. — 395-406.
10. Reina M.A., Collier C.B., Prats-Galino A. Unintentional subdural placement of epidural catheters during attempted epidural anesthesia: an anatomic study of spinal subdural compartment // Reg. Anesth. Pain. Med. — 2011. — 36. — 537-541.
11. Neal J.M., Rathmell J.P. Complications in Regional –Anesthesia and Pain Medicine. — 2nd ed. — Philadelphia, PA: Lippincott Williams & Wilkins, 2013.
12. Horlocker T.T., McGregor D.G., Matsushige D.K., Schroeder D.R., Besse J.A. A retrospective review of 4767consecutive spinal anesthetics: central nervous system complications // Anesth. Analg. — 1997. — 84. — 578-584.
13. Horlocker T.T., Wedel D.J. Neurologic complications of spinal and epidural anesthesia // Reg. Anesth. Pain. Med. — 2000. — 25. — 83-98.
14. Kalichman L., Cole R., Kim D.H. et al. Spinal stenosis prevalence and associated symptoms: the Framingham Study // Spine J. — 2008. — 9. — 545-550.
15. Hebl J.R., Horlocker T.T., Kopp S.L., Schroeder D.R. Neuraxial blockade in patients with preexisting spinal stenosis, lumbar disk disease, or prior spine surgery: efficacy and neurologic complications // Anesth. Analg. — 2010. — 111. — 1511-1519.
16. Moen V., Irestedt L. Neurological complications following central neuraxial blockades in obstetrics // Curr. Opin. Anaesthesiol. — 2008. — 21. — 275-280.
17. Hirabayashi Y., Saitoh K., Fukuda H., Igarashi T., Shimizu R., Seo N. Magnetic resonance imaging of the extradural space of the thoracic spine // Br. J. Anaesth. — 1997. — 79. — 563-566.
18. Beloeil H., Albaladejo P., Hoen S., Eschwege P., Benhamou D. Bilateral lower limb hypoesthesia after radical prostatectomy in the hyperlordotic position under general anesthesia // Can. J. Anaesth. — 2003. — 50. — 653-656.
19. Gogarten W., Vandermeulen E., Van Aken H., Kozek S., Llau J.V., Samama C.M. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology // Eur. J. Anaesthesiol. — 2010. — 27. — 999-1015.
20. Biglioli P., Roberto M., Cannata A. et al. Upper and Lo–wer spinal cord blood supply: the continuity of the anterior spinal artery and the relevance of the lumbar arteries // J. Thorac. Cardiovasc. Surg. — 2004. — 127. — 1188-1192.
21. Elahi F., Wu W.Y., Callahan D., Bhandary A.K., Beutler B.C., Lassalle C.A. Images in anesthesiology: reversible anterior spinal artery spinal artery syndrome during celiac plexus block // Anesthesiology. — 2013. — 118. — 187.
22. Rathmell J.P., Benzon H.T., Dreyfuss P. et al. Safeguards to prevent neurologic complications after epidural steroid injections: consensus opinions from a multidisciplinary working group and national organization // Anesthesiology. — 2015. — 122. — 974-984.
23. Lee L.A., Posner K.L., Domino K.B., Caplan R.A., Cheney F.W. Injuries associated with regional anesthesia in the 1980s and 1990s // Anesthesiology. — 2004. — 101. — 143-152.
24. Hickey R., Albin M.S., Bunegin L., Gelineau J. Autoregulation of spinal cord blood flow: is the cord a microcosm of the brain? // Stroke. — 1986. — 17. — 1183-1189.
25. Mashour G.A., Shanks A.M., Kheterpal S. Perioperative stroke and associated mortality after noncardiac, nonneurologic surgery // Anesthesiology. — 2011. — 114. — 1289-1296.
26. Sum D.C., Chung P.C., Chen W.C. Deliberate hypotensive anesthesia with labetalol in reconstructive surgery for scoliosis // Acta Anaesthesiol. Scand. — 1996. — 34. — 203–207.
27. Duggal N., Lach B. Selective vulnerability of the lumbosacral spinal cord after cardiac arrest and hypotension // Stroke. — 2002. — 33. — 116-121.
28. Kobrine A.I., Doyle T.F., Martins A.N. Autoregulation of spinal cord blood flow // Clin. Neurosurg. — 1975. — 22. — 573-581.
29. Drummond J.C., Lee R.R., Owens E.L. Spinal cord ischemia occurring in association with induced hypotension for colonic surgery // Anesth. Analg. — 2012. — 114. — 1297-1300.
30. Joshi B., Ono M., Brown C. et al. Predicting the limits of cerebral autoregulation during cardiopulmonary bypass // Anesth. Analg. — 2012. — 114. — 503-510.
31. Laflam A., Joshi B., Brady K. et al. Shoulder surgery in the beach chair position is associated with diminished cerebral autoregulation but no differences in postoperative cognition or brain injury biomarker levels compared with supine positioning: the Anes–thesia Patient Safety Foundation Beach Chair Study // Anesth. Analg. — 2015. — 120. — 176-185.
32. Dohi S., Takeshima R., Naito H. Spinal cord blood flow during spinal anesthesia in dogs: the effects of tetracaine, epinephrine, acute blood loss, and hypercapnia // Anesth. Analg. — 1987. — 66. — 599-606.
33. Vitale M.G., Moore D.W., Matsumoto H. et al. Risk factors for spinal cord injury during surgery for spinal deformity // J. Bone Joint Surg Am. — 2010. — 92. — 64-71.
34. Bijker J.B., Persoon S., Peelen L.M. et al. Intraoperative hypotension and perioperative ischemic stroke after general surgery. A nested case-control study // Anesthesiology. — 2012. — 116. — 658-664.
35. de Sèze M.P., Sztark F., Janvier G., Joseph P.A. Severe and long-lasting complications of the nerve root and spinal cord after central neuraxial blockade // Anesth. Analg. — 2007. — 104. — 975-979.
36. Kumral E., Polat F., Güllüoglu H., Uzunköprü C., Tuncel R., Alpaydin S. Spinal ischaemic stroke: clinical and radiological findings and short-term outcome // Eur. J. Neurol. — 2011. — 18. — 232-239.
37. Bracken M.B. Steroids for acute spinal cord injury // Cochrane Database Syst. Rev. — 2012. — 10. — CD001046.
38. Dearden N.M., Gibson J.S., McDowall D.G., Gibson R.M., Cameron M.M. Effects of high-dose dexamethasone on outcome from severe head injury // J. Neurosurg. — 1986. — 64. — 81-88.
39. Edwards P., Arango M., Balica L. et al. Final results of MRC CRASH, a randomised placebo-controlled trial of intravenous corticosteroids in adults with head injury-outcomes at 6 months // Lancet. — 2005. — 1957-1959.
40. Iida H., Iida M. Effects of spinal analgesics on spinal circulation: the safety standpoint // J. Neurosurg. Anesthesiol. — 2008. — 20. — 180-187.
41. Neal J.M. Effects of epinephrine in local anesthetics on the central and peripheral nervous systems: neurotoxicity and neural blood flow // Reg. Anesth. Pain. Med. — 2003. — 28. — 124-134.
42. Hoy K., Hansen E.S., He S.-Z. et al. Regional blood flow, plasma volume, and vascular permeability in the spinal cord, the dural sac, and lumbar nerve roots // Spine (Phila Pa 1976). — 1994. — 19. — 2804-2811.
43. Auroy Y., Benhamou D., Bargues L. et al.Major complications of regional anesthesia in France. The SOS regional anesthesia hotline service // Anesthesiology. — 2002. — 97. — 1274-1280.
44. Rice L., Wee M.Y.K., Thomson K. Obstetric epidurals and chronic adhesive arachnoiditis // Br. J. Anaesth. — 2004. — 92. — 109-120.
45. Cook T.M., Counsell D., Wildsmith J.A. Royal College of Anaesthetists Third National Audit Project. Major complications of central neuraxial block: report of the Third National Audit Project of the Royal College of Anaesthetists // Br. J. Anaesth. — 2009. — 102. — 179-190.
46. Killeen T., Kamat A., Walsh D., Parker A., Aliashke–vich A. Severe adhesive arachnoiditis resulting in progressive paraplegia following obstetric spinal anaesthesia: a case report and review // Anaesthesia. — 2012. — 67.
47. Bernards C.M., Hadzic A., Suresh S., Neal J.M. Regio–nal anesthesia in anesthetized or heavily sedated patients // Reg. Anesth. Pain. Med. — 2008. — 33. — 449-460.
48. Kessler P., Steinfeldt T., Gogarten W. et al. Peripheral regional anesthesia in patients under general anesthesia: risk assessment with respect to paresthesia, injection pain and nerve da–mage // Anaesthesist. — 2013. — 62. — 483-488.
49. Вишневский А.С. Атлас периферической и центральной нервной и венозной систем / А.С. Вишневский, А.Н. Максименков; под. ред. В.Н. Шевкуненко. — М.: Медгиз, 1949. — С. 73.
50. Эпидуральное обезболивание в ортопедии / Хвисюк А.Н., Фесенко В.С., Завеля М.И. и др. — Харьков, 2010. — 169 с.

/62-1.jpg)
/62-2.jpg)
/63-1.jpg)
/66-1.jpg)
/65-1.jpg)
/67-1.jpg)
/68-1.jpg)
/69-1.jpg)
/70-1.jpg)