Введение
По данным Всемирной организации здраво–охранения, в мире ежегодно регистрируется более 500 тыс. случаев колоректального рака [1]. По данным Национального института рака, несмотря на все меры, которые предпринимаются в борьбе с онкозаболеваемостью, ее уровень с каждым годом статистически достоверно увеличивается. Среди десяти основных нозологических форм в структуре онкозаболеваемости в Украине злокачественные новообразования кишечника занимают 5-е место (6,3 %) среди мужчин и 4-е место (6,6 %) среди женщин. В структуре онкосмертности населения Украины колоректальный рак занимает 4-е место (6,3 %) среди мужского населения и 2-е место среди женщин (8,7 %) [2]. Ведущим методом лечения рака прямой кишки до настоящего времени остается хирургический. Данные вмешательства являются крайне травматичными, так как требуют выполнения операций, сопровождающихся массивной лимфодиссекцией, формированием трансплантатов для проведения сфинктеросохраняющих операций. В последнее время акценты сместились в сторону радикализма в отношении операбельности пациентов со злокачественными новообразованиями органов брюшной полости на поздних стадиях, увеличилось количество расширенных радикальных вмешательств, затрагивающих ряд стрессогенных органов и тканей. Чем массивнее повреждение тканей, тем более выражены сопровождающая его воспалительная реакция, высвобождение проболевых и провоспалительных медиаторов и, соответственно, интенсивность послеоперационного болевого синдрома [3]. Улучшение отдаленных результатов лечения рака прямой кишки может быть достигнуто за счет улучшения диагностики этого заболевания, с одной стороны, и разработки комбинированных и комплексных методов лечения — с другой. Соответственно, наиболее актуальными вопросами анестезиологического менеджмента у данной группы больных являются влияние метода интраоперационного обезболивания и послеоперационной аналгезии на процессы метастазирования и выживаемость онкологических больных, выбор наиболее щадящей тактики периоперационного ведения больных с сопутствующей патологией (так как подавляющее большинство пациентов данного профиля относятся к возрастной группе), нивелирование возможных послеоперационных осложнений у пациентов, требующих хирургического лечения.
Значительное уменьшение количества опиоидных аналгетиков и качество обезболивания у пациентов онкологического профиля за счет использования регионарных методик — это те вопросы, которые особенно актуальны, так как снижается выраженность отрицательных эффектов наркотических препаратов, в том числе угнетения иммунитета и устойчивости к метастазированию. Доказано прямое влияние агонистов µ-опиатных рецепторов на развитие и прогрессирование рака [4, 5].
Интерес к изучению свойств севофлурана, возросший в последнее время в связи с его влиянием на гемодинамику (системную, микроциркуляторную и центральную) [6], обусловливает целесообразность анализа структуры органов, непосредственно участвующих в реакциях на радикальные оперативные вмешательства по поводу колоректального рака. С учетом того, что прямое ультраструктурное исследование толстого кишечника является наиболее точным инструментом для оценки патоморфологических изменений при различной патологии, является актуальным электронно-микроскопическое изучение интраоперационных биоптатов участков толстой кишки [7, 8], прилежащих к неопластически пораженной колоректальной зоне, в условиях различных вариантов анестезиологического обеспечения радикальных вмешательств.
Цель: улучшить анестезиологический менедж–мент пациентов при хирургическом лечении колоректального рака путем выбора наиболее оптимизированной концепции периоперационной стратегии обезболивания на основании анализа данных об изменениях центральной гемодинамики и микрореологии.
Материалы и методы
Исследование проводилось на базе Днепропетровской городской многопрофильной клинической больницы № 4 (главный врач к.м.н. Чебанов К.О.), отделения анестезиологии с 12 койками для интенсивной терапии (заведующий отделением к.м.н. Новиков С.П.). В исследовании принимали участие 70 пациентов, которым планировалось радикальное оперативное вмешательство по поводу колоректального рака. Критериями включения были: информированное согласие пациента на участие в исследовании, соответствующем требованиям National Institutes of Health; операционно-наркозный риск ASA II–III; возможность радикального хирургического лечения; возраст пациента 60–75 лет. Критерии исключения: отказ от участия в исследовании; наличие гнойно-септических –осложнений; ургентные оперативные вмешательства; тяжелая сопутствующая патология в стадии декомпенсации; пациенты, у которых диагностированы отдаленные метастатические поражения. Пациенты методом слепого отбора были разделены на две клинические группы в зависимости от типа стратегии анестезиологического менеджмента (табл. 1).
/80-1.jpg )
1-ю группу составили пациенты (n = 35), анестезиологическое обеспечение которым проводилось в виде тотальной внутривенной анестезии (ТВВА): индукция осуществлялась введением сибазона в расчете 0,4 мг/кг внутривенно, тиопентала натрия 5 мг/кг внутривенно, фентанила в расчете 5 мкг/кг массы тела больного внутривенно. Миоплегия для интубации трахеи достигалась внутривенным введением сукцинилхолина в расчете 2 мг/кг. Для поддержания анестезии использовали сибазон в расчете 2,5 мг/кг/ч, фентанил 10 мкг/кг/ч в первый час анестезии, 5 мкг/кг/ч во второй час, 3 мкг/кг/ч в третий час; интраоперационно миоплегия поддерживалась введением пипекурония бромида –(ардуан) в дозе 0,4 мкг/кг/ч. Послеоперационное обез–боливание: декскетопрофен (дексалгин) 50 мг в/м 3 р/сут + опиоидные аналгетики (морфин) для достижения значений визуальной аналоговой шкалы до 4 баллов. Анестезиологический менеджмент у пациентов 2-й группы (n = 35) применялся в виде сочетанной анестезии с использованием ингаляционной и продленной эпидуральной аналгезии. Пункцию эпидурального пространства проводили на уровне L1–L2 с последующей катетеризацией эпидурального пространства в краниальном направлении: эпидурально вводился 0,25% раствор бупивакаина (лонгокаин) в объеме 12–15 мл с содержанием 0,05 мг фентанила. Индукция осуществлялась пропофолом 1,5–2,0 мг/кг и фентанилом 5,0 мкг/кг, миоплегия — дитилином 2 мг/кг. Поддержание анестезии проводили с помощью наркозной станции Leon (HEINEN, Austria), где создавали МАК севофлурана 0,5–0,6 в потоке кислородно-воздушной смеси 0,8–1,0 л/мин в комбинации с болюсным введением фентанила 0,2 мг/ч. После–операционное обезболивание у пациентов этой группы осуществляли в виде эпидуральной аналгезии 6–9 мл 0,125% изобарического бупивакаина (лонгокаин), в зависимости от антропометрических показателей и выраженности болевого синдрома, каждые 4 часа.
Качественную эффективность аналгезии в послеоперационном периоде в обеих группах оценивали с помощью визуально-аналоговой шкалы (ВАШ, рис. 1).
/81-1.jpg )
Мы предположили, что гемодинамические сдвиги на уровне центральной гемодинамики (ЦГ) и микроциркуляторного русла находятся в прямой патогенетической зависимости. Для определения основных показателей ЦГ (ударный и минутный объем кровотока, сердечный индекс, общее периферическое сосудистое сопротивление), существует множество методик, в том числе инвазивных, неинвазивных и расчетных. В нашей практике мы используем метод грудной реографии, так как он является неинвазивным и в то же время имеет минимальную погрешность полученных данных по сравнению даже с инвазивными методами (например, катетеризация по методу Swan — Ganz) [9]. Периоперационно параметры гемодинамики оценивались с помощью реографического комплекса «РЕОКОМ» XAI-Medic (использовалась модифицированная методика по Kubichek с расположением потенциальных электродов на спине в проекции дуги аорты и бифуркации на подвздошные артерии).
Для электронно-микроскопического исследования во время радикального оперативного вмешательства в течение не более шестидесяти секунд после резекции из участков макроскопически неизмененной толстой кишки, прилежащих к нео–пластически пораженной колоректальной зоне, извлекались биоптаты размером 1 мм3. Образцы в течение двух часов фиксировали при +2 °С в 3% растворе глутарового альдегида, приготовленного на 0,2 M фосфатном буфере (рН 7,4). Материал переносили для постфиксации в 1% забуференный (рН 7,4) раствор тетраоксида осмия (SPI, США) на один час. Обезвоживали образцы с помощью пропиленоксида в растворах возрастающей концентрации. Для изготовления эпоксидных блоков использовали композицию «эпон — аралдит». Ультратонкие срезы получали на ультрамикротоме УМТП-6М (SELMI, Украина). Исследования проводились с помощью трансмиссионного электронного микроскопа ПЭМ-100-01 (SELMI, Украина) при ускоряющем напряжении 65–90 кВ и первичных увеличениях от 2000 до 80 000. В целом электронно-микроскопическое исследование осуществляли по стандартной схеме.
Промежуточными точками контроля эффективности выбранной стратегии были послеоперационный озноб, аускультативные признаки появления перистальтики, эпизоды тошноты и рвоты в раннем послеоперационном периоде. Конечными точками контроля эффективности анестезиологического менеджмента были послеоперационная летальность, количество повторных госпитализаций в отделение анестезиологии и интенсивной терапии при ухудшении состояния больного и средний койко-день.
Весь материал статистически обработан с помощью программ Microsoft Excel 2007 и Statistica 6.0. Проверку данных на нормальность распределения проводили с помощью метода Шапиро — Уилка. Для данных, имеющих нормальное распределение, определяли величину степени вероятности (р) — критерий Стьюдента с достоверностью р ≤ 0,05.
Результаты и их обсуждение
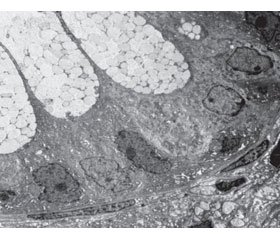
Морфологически в биоптатах визуально неизмененных участков толстой кишки, прилежащих к неопластической зоне, в обеих группах обнаруживалась сохраненная структура кишечной стенки. Однако при ТВВА под расширенной эпителиальной базальной мембраной формировались обширные зоны интерстициального отека в составе собственной пластинки слизистой оболочки (рис. 2). Единичные гладкие миоциты в данных зонах имели признаки чрезмерного сокращения (рис. 3).
В их цитоплазме наблюдались дистрофические нарушения, увеличение числа рибосом и полисом. Клетки Панета имели признаки активации внутриклеточного метаболизма, носящего, на наш взгляд, компенсаторный характер. Часть колоноцитов подвергалась внутриклеточной деструкции (рис. 4). Характерным было сужение гемокапилляров, заполненных деформированными эритроцитами. В большинстве наблюдений плазматические мембраны эритроцитов имели существенные повреждения.
В некоторых случаях поверхность эндотелия образовывала значительное количество микроворсинок, что указывало на наличие циркуляторной гипоксии. Цитоплазма отростков эндотелио–цитов истончена, в базальной части содержала нечеткие профили единичных митохондрий и рибосом. Плазматическая мембрана в данных участках не обнаруживалась и вместе с базальной мембраной образовывала гомогенный материал. Вокруг узких опустошенных гемокапилляров наблюдались обширные зоны периваскулярного отека и экссудации с характерной нейтрофильной инфильтрацией (рис. 5). Аналогичные зоны обнаруживались в составе подслизистой основы вокруг спазмированных артериол с проявлениями стаза и расширенных венул, содержащих сладжи эритроцитов (рис. 6).
В целом при проведении ТВВА изменения указывали на выраженную эндотелиальную дисфункцию, а тканевые проявления микроциркуляторных нарушений затрагивали все оболочки стенки толстой кишки вблизи пораженной колоректальной зоны.
При применении сочетанной анестезии с использованием севофлурана и эпидуральной аналгезии в интраоперационных биоптатах толстой кишки степень интерстициального отека в составе собственной пластинки слизистой оболочки была умеренной (рис. 7). Гладкие миоциты в данных зонах не имели признаков пересокращения (рис. 8).
В клетках кишечного эпителия внутриклеточная деструкция встречалась редко. Гемокапилляры собственной пластинки слизистой оболочки имели обычный просвет и были заполнены неизмененными эритроцитами (рис. 9). Цитоплазма эндотелия имела стабильную морфологическую структуру. Микроворсинки, указывающие на развитие гипоксии, не обнаруживались. Состояние гемокапилляров свидетельствовало об отсутствии выраженной эндотелиальной дисфункции, в просветах наблюдалось обычное содержание эритроцитов без сладжирования. Воспалительная инфильтрация лимфоцитами отсутствовала.
В отличие от ТВВА при применении сочетанной анестезии просветы венул оставались без признаков стаза, сладжа эритроцитов. Перивенулярный отек встречался редко. Артериолы не имели признаков спазма и периартериолярного отека, некоторые из них были умеренно расширенными и полнокровными.
Анализируя клиническую картину и параметры центральной гемодинамики, которые обусловили данные микрореологические изменения, мы выяснили, что показатели сердечного индекса (СИ), который является производным от сердечного выброса (л/мин) и площади поверхности тела (м2), явно имели тенденцию к снижению в группе атаралгезии на 20 % через 1 час (1-я группа — 2,8 л/мин/м2, 2-я группа — 3,5 л/мин/м2) и статистически достоверному снижению на 30–35 % (p < 0,05) начиная со второго часа оперативного вмешательства (1-я группа — 2,34 л/мин/м2, 2-я группа — 3,56 л/мин/м2). Второй взаимосвязанный с СИ компонент центральной гемодинамики — общее периферическое сосудистое сопротивление (ОПСС). При анализе полученных данных мы наблюдали снижение показателя в группе сочетанной аналгезии (1-я группа — 3064–3283 дин/см • с–5, 2-я группа — 2762–2904 дин/см × × с–5), однако направленность сдвигов не достигала степени достоверности (p > 0,05), и данное уменьшение ОПСС было вызвано вазодилатацией в ответ на эпидуральное введение местного анестетика, что компенсировалось вариабельностью минутного объема крови в допустимых пределах. При анализе двух последних показателей центральной гемодинамики, а именно СИ и ОПСС, можно сделать вывод, что сочетанная аналгезия обеспечивает эукинетический (нормоциркуляторный) тип гемодинамики, в то время как в группе атаралгезии наблюдается тенденция к ее угнетению до гипокинезии (гипоциркуляции), что играет особую роль у пациентов со скомпрометированной кардиальной патологией.
После экстубации мы наблюдали троекратное уменьшение значения боли по визуально-аналоговой шкале в группе сочетанной анестезии (1,53 против 4,5 балла), значительно быстрее регрессировали признаки остаточной седации (оценка производилась по модифицированной шкале Aldrete до достижения 8 баллов). До 95 % пациентов группы сочетанной методики были экстубированы в условиях операционной. Во 2-й группе мы наблюдали меньшую частоту послеоперационных ознобов, что, по нашему мнению, связано с низкой концентрацией бупивакаина 0,25%, за счет чего нет выраженного симпатического блока, отсутствием центрального угнетения терморегуляции, быстрым периодом пробуждения, а также качеством аналгезии, так как послеоперационная боль и озноб зачастую наблюдаются одновременно.
При исследовании промежуточных клинических точек контроля мы наблюдали появление единичных волн перистальтики в 1-й группе в период 62 ± 6 часов после лапаротомии против 24 ± 4 часа у пациентов 2-й группы. Полное восстановление работы кишечника и отхождение газов в 1-й группе отмечено к 88 ± 5 часов в послеоперационный период против 48 ± 4 часа во 2-й группе. Эпизоды тошноты и рвоты в раннем послеоперационном периоде в 1-й группе встречались у 13 пациентов (37,14 %) против 3 пациентов во 2-й группе (8,5 %). Учитывая конечные точки контроля эффективности анестезиологического менеджмента в нашей клинике за период с 2012 по 2014 г. на фоне внедренной методики сочетанной аналгезии и тактики послеоперационной аналгезии, мы выявили тенденцию к снижению послеоперационной летальности с 1,5 до 0,6 % (на 60 %), снижению количества оперативных вмешательств с осложнениями с 11 (1,4 %) до 9 (1,2 %). Уменьшилось количество повторных госпитализаций пациентов в отделение интенсивной терапии с 12 до 1. Сократился средний койко-день на 7,7 % — с 24,6 до 22,7 суток стационарного лечения.
Выводы
1. При комплексном подходе к периоперационному анестезиологическому менеджменту у больных колоректальным раком должно рассматриваться множество вопросов, в частности подготовка полноценной диагностики органов и систем пациента на этапе подготовки к хирургическому лечению; выбор наиболее оптимального анестезиологического пособия во время вмешательств с учетом всех особенностей и течения сопутствующей патологии; обеспечение наиболее безопасных методов в плане метастазирования и заживления оперированной кишки в участках наложенного анастомоза.
2. Центральным звеном в развитии патоморфологических изменений в стенке толстой кишки при анестезиологическом обеспечении оперативных вмешательств при лечении колоректального рака является система микроциркуляции, которая имеет прямую взаимосвязь с тенденцией к гипокинезу на уровне центральной гемодинамики.
3. При проведении радикального вмешательства на фоне ТВВА дистрофические и деструктивные изменения органелл эндотелиальных клеток вызывают выраженную эндотелиальную дисфункцию в микрососудах, а тканевые проявления значительных микроциркуляторных нарушений распространяются на все оболочки стенки толстой кишки вблизи пораженной колоректальной зоны. Одновременно с этим отмечается тенденция к стойкой гипокинезии интраоперационно, что может быть явным предиктором указанных ультрамикроскопических дисфункций.
4. Сочетанная низкопоточная ингаляционная анестезия севофлураном и эпидуральная аналгезия бупивакаином при радикальных оперативных вмешательствах по поводу колоректального рака имеют ряд преимуществ над атаралгезией. Ее применение позволяет обеспечить нормодинамический тип гемодинамики на протяжении всей операции; обеспечивает эффективную аналгезию после экстубации; быструю регрессию признаков посленаркозной седации и позволяет выполнить экстубацию пациента в операционной; снижает частоту послеоперационных ознобов. Преимущество этого вида анестезиологического менеджмента со стабилизацией центральной гемодинамики у пациентов с хирургическим лечением колоректального рака подтверждается морфологическими данными в виде снижения эндотелиальной дисфункции за счет ограничения дистрофических и деструктивных изменений органелл эндотелиальных клеток, стабилизации их мембран, предотвращения спазма артериол, явлений стаза и сладжирования эритроцитов.
5. Методика продленной эпидуральной аналгезии по сравнению с опиатной аналгезией позволяет проводить эффективную и качественную аналгезию в послеоперационном периоде. Немаловажными преимуществами также являются более раннее восстановление моторной функции кишечника и значительное снижение потребности в опиоидных аналгетиках.
6. Предложенный анестезиологический менедж–мент позволяет снизить количество осложнений, среднюю продолжительность койко-дня, частоту возвратов пациентов в отделение интенсивной терапии, послеоперационную летальность.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/80-1.jpg )
/81-1.jpg )
/81-2.jpg )
/82-1.jpg )
/83-1.jpg )
/83-2.jpg )