Вступ
За даними ВООЗ, мозковий інсульт (МІ) посідає ІІ місце серед чинників смерті у світі, ІІІ — у розвинутих країнах та є основним чинником інвалідизації населення. Щороку від 100 до 110 тис. мешканців України вперше переносять мозковий інсульт. У 2010 році ця цифра становила 282,3 особи на 100 тис. населення, а в 2013 р. — 299,5, що є більшим, ніж середній показник у європейських країнах (200 на 100 тис. населення). 33 % МІ трапляються в осіб працездатного віку, при цьому співвідношення геморагічних та ішемічних інсультів становить 1 : 4 (Міщенко Т.С., 2014).
За останні 10 років захворюваність на мозковий інсульт зросла на 5 % за рахунок осіб працездатного віку. Близько 20 000 хворих щороку стають інвалідами внаслідок МІ, і лише 10–20 % хворих, які перенесли інсульт, повертаються до своєї трудової діяльності. Інсульт є тяжким соціально-економічним тягарем суспільства. На думку вчених, якщо зазначені тенденції набудуть стійкого характеру, до 2030 р. кількість випадків смертності від мозкового інсульту, виходу на інвалідність, а також хворих, які вижили після інсульту, збільшиться вдвічі й становитиме близько 12, 200 і 70 млн випадків відповідно (Brooks M., 2013). Серед осіб, молодших за 45 років, частота виникнення інсульту становить 0,1–0,3 на 1000 осіб на рік, тоді як у осіб, старших за 75 років, вона досягає 12–20 випадків на 1000 осіб на рік (Feigin V.L., Laws C.M., Bennett D.A., 2003).
Провідну роль у загибелі нейронів відіграють: ексайтотоксичність (унаслідок неконтрольованого вивільнення амінокислотних медіаторів), порушення кальцієвого гомеостазу клітини, руйнівна дія вільних радикалів, активація внутрішньоклітинного метаболізму, запалення, апоптоз. Успіхи фундаментальних досліджень пошкодження мозку зародили надію на те, що лікувальний вплив, спрямований на усунення або пригнічення тих чи інших ланцюгів патогенезу, може запобігти пошкодженню мозку, а отже, знизити летальність внаслідок ішемічного інсульту, а також зменшити інвалідність.
Для підтримання нормального функціонування та життєздатності мозок потребує постійної доставки кисню та глюкози. Порушення їх доставки призводить до церебральної ішемії, для якої характерне зниження церебрального кровообігу нижче від рівня, необхідного для збереження метаболічної цілісності нейронів (40–45 % від загальної потреби О2 для мозку, або CMRО2) і підтримання нормальної функціональної активності нейронів, тобто їх здібності до регенерації та передачі нервових імпульсів (55–60 % CMRО2). Серед усіх органів мозок є найбільш чутливим до ішемії. Втрата свідомості відбувається через 15 секунд після зупинки кровообігу. Рівень фосфокреатиніну критично знижується через 1 хвилину. Запаси глюкози й аденозинтрифосфатів (АТФ) виснажуються через 4–5 хвилин. Критичним є рівень церебрального кровотоку (ЦК) у 18–20 мл/100 г/хв. Ізолінія на електроенцефалограмі з’являється при рівні ЦК у 15 мл/100 г/хв. Метаболічна недостатність виникає при рівні ЦК у 10 мл/100 г/хв.
Ішемія у своєму розвитку проходить дві стадії біоенергетичної гіпоксії: перша — оборотних змін та метаболічної гіпоксії, друга — необоротних змін.
Існує так звана ієрархія ішемічного пошкодження мозку, згідно з якою спочатку припиняється функціонування нейронів, а потім втрачається цілісність клітин. При ішемічному пошкодженні головного мозку навколо вогнища пошкодження формується зона пенумбри, або ішемічної напівтіні. Ішемічна напівтінь являє собою ділянку життєздатної тканини, що перфузується із субоптимальною швидкістю (16–18 мл/100 г/хв) та розташована навколо ішемічного осередку. Клітини, що знаходяться в центрі ішемічного осередку, гинуть протягом декількох хвилин від початку ішемії. Клітини ішемічної напівтіні піддаються вторинній дезінтеграції, що потенційно може призвести до їх загибелі. Для зони, що безпосередньо оточує первинну напівтінь, загибель менш ймовірна, оскільки її перфузія є кращою, незважаючи на те що вона нижча, ніж нормальний мінімум (50 мл/100 г/хв).
Патофізіологічні зміни, що відбуваються при ішемії, називаються ішемічним каскадом. Патобіохімічна сутність ішемічного каскаду полягає:
— у зниженні доставки О2 та глюкози, зменшенні напруги СО2;
— негайному розщепленні АТФ для забезпечення потреб клітин в енергії (триває 2–4 хвилини після повної ішемії);
— використанні фосфокреатиніну, рівень якого в мозку в 3 рази більший, ніж АТФ, для процесів ресинтезу АТФ з аденозиндифосфатів;
— зниженні внутрішньоклітинного рН і переході на анаеробний гліколіз, що призводить до підвищення вмісту молочної кислоти;
— перетворенні тривалентного заліза у двовалентне (за допомогою лактату), що сприяє утворенню вільних радикалів та окисленню ліпідів клітинних мембран;
— підвищенні рівня збуджуючих амінокислот-нейротрансмітерів — глутамату й аспартату. Глутамат активує всі типи рецепторів: NMDA (N-метил-D-аспартат) рецептори, локалізовані в корі гіпокампа, сприяють входженню в клітину Na, Cl, H2O і Ca. AMPA-рецептори, або рецептори до квізклавату, сприяють входженню в клітину Na (локалізовані в корі та таламусі). Рецептори каїнату сприяють входженню в клітину Na (локалізовані в стріатумі гіпокампа). Аспартат впливає тільки на NMDA-рецептори;
— підвищення позаклітинної концентрації глутамату призводить до загибелі клітин двома шляхами: по-перше, при активації глутаматом NMDA-рецепторів розвивається негайна нейротоксичність, що спричиняє входження в клітину натрію, хлору та води — відбувається клітинний набряк, лізис мембран та настає клітинна смерть. По-друге, у період від 24 до 72 годин після ішемії формується відстрочена нейротоксичність. Активація NMDA-рецепторів сприяє входженню в клітину іонів кальцію, внаслідок чого активуються фосфоліпази, протеази, вільні жирні кислоти, утворюються арахідонова кислота та вільні радикали, що призводить до окислення ліпідів та смерті клітин;
— підвищене входження іонів кальцію в клітину — рання та центральна подія ішемічного каскаду, оскільки виснаження запасів АТФ пошкоджує функцію енергозалежної натрій-калієвої АТФ-залежної іонної помпи, внаслідок чого іони натрію й хлору входять у клітину, а іони калію виходять з неї; вторинно підвищується надходження в клітину води та розвивається набряк, прогресуюча мембранна деполяризація відкриває заряд-чутливі кальцієві канали для додаткового входження –іонів кальцію в клітину; зниження рівня АТФ також призводить до вивільнення кальцію з ендоплазматичного ретикулуму; підвищений рівень вільних жирних кислот стимулює глутаматні рецептори та відкриває NMDA-залежні кальцієві канали; разом з тим виведення іонів кальцію з клітини є активним процесом, що припиняється при виснаженні запасів АТФ;
— численні ішемічні ефекти кальцію, якого в клітині надлишок, формують традиційний шлях ішемічного каскаду, руйнуючи нейроцити. Підвищення рівня внутрішньоклітинного кальцію активує фосфоліпази А1, А2 і С, що призводить до гідролізу мембранних фосфоліпідів і вивільнення вільних жирних кислот. Втрата мембранних фосфоліпідів спричиняє руйнування мітохондріальних і клітинних мембран. Арахідонова кислота метаболізується до простагландинів (через шлях циклооксигенази), лейкотрієнів (через шлях –ліпоксигенази) і вільних радикалів, які посилюють церебральну ішемію.
Тромбоксан А2 і простагландини, що утворилися з арахідонової кислоти, мають потужні судинозвужувальні властивості та сприяють агрегації тромбоцитів, викликають ішемію й залучаються до механізму реперфузійного пошкодження.
Супероксидні, пероксидні й гідроксильні радикали призводять до перокисного окислення ліпідів в середині мембрани нервової клітини. Це пошкоджує функції мембрани й вивільнює токсичні побічні продукти (альдегіди та гідрокарбонатні гази), що призводять до набряку клітин, порушують проникність гематоенцефалічного бар’єра, спричиняють запалення. Супероксидні радикали самі по собі можуть формувати запальну відповідь з утворенням судинних тромбів.
Вищесказане клінічно проявляється порушенням когнітивних функцій, до яких відносять: підтримання ясної свідомості та уваги, моторні та соматосенсорні функції, ініціацію та виконання реакцій на зовнішній стимул, мовну функцію, зорово-просторову орієнтацію, здібність міркувати та приймати рішення, пам’ять та здатність до навчання.
Порушення когнітивних функцій є найбільш частими та значущими наслідками, що призводять до інвалідизації хворих після ішемічного інсульту.
Запобігання дезадаптуючим наслідкам і прогредієнтному перебігу гострих цереброваскулярних розладів залежить від якості інтенсивної терапії гострого періоду, зокрема, від своєчасного застосування терапії, направленої на захист головного мозку від гіпоксії. Захистити головний мозок від згубної дії ішемії та гіпоксії можна завдяки: відновленню адекватної перфузії (комплекс неспецифічних заходів, спрямованих на збільшення доставки кисню) та фармакологічній нейропротекції, що складається:
а) із захисту мембрани клітин від пошкоджуючої дії ішемічного каскаду;
б) збільшення доставки енергетичних субстратів (захист від гіпоксії).
Метою фармакологічної нейропротекторної або нейрометаболічної терапії є збереження структури та/або функцій нейронів в умовах пошкодження головного мозку внаслідок ішемічного пошкодження (Casson R.J. із співавт., 2012).
Основними етапами нейрозахисного лікування при цереброваскулярних розладах є:
— церебральна протекція — запобіжний комплекс терапевтичних заходів для покращення неврологічних результатів у пацієнтів із ризиком виникнення церебральної ішемії; мета — запобігти згубній дії ішемії;
— церебральна ресусцитація — комплекс терапевтичних заходів, до яких вдаються після ішемічної атаки; мета — лікування ішемії та зменшення ступеня пошкодження нейронів;
— цитопротекція — комплекс терапевтичних заходів, які застосовують після ішемічної атаки; мета — відновлення пошкодженої мозкової тканини, включаючи як нейрони, так і нейрональні клітини;
— клінічна церебропротекція — лікування, спрямоване на забезпечення максимального надходження О2 у клітину за рахунок збільшення його доставки та зменшення потреби в О2; мета — принципово зберегти мозковий кровообіг та усунути гіпоксемію;
— нейропротекція — лікувальний вплив, що запобігає прогресуючій втраті нейронів або уповільнює її (Morales M.I., Pittman J., Cottrell J.E., 2007).
На переривання ішемічного каскаду впливають попередники холіну, а саме цитиколін та холіну альфосцерат, які в організмі є донаторами холіну. Це, у свою чергу, забезпечує відновлення та синтез фосфоліпідів клітинних мембран, а також сприяє синтезу нейромедіаторів ацетилхоліну та дофаміну (Saver J.L. et al., 2010).
Цитиколін (цитидин-5-холінфосфат) як складова нейрометаболічної терапії застосовується в Європі вже понад 30 років (Афанасьєв, 2016). Цитиколін забезпечує репарацію клітинних мембран, відновлює рівень фосфатидилхоліну в нейронах, що зазнали ішемії. Введення цитиколіну в умовах ішемії відновлює рівні сфінгомієліну (фосфоліпіду клітинної мембрани) та кардіоліпіну (структурного фосфоліпіду внутрішньої мембрани мітохондрій), руйнування яких відбувається за участю активованої фосфоліпази А2 (Ніконов В.В., Савицька І.Б., Бутко Л.В., 2013).
Холіну альфосцерат бере участь у синтезі ацетилхоліну, позитивно впливає на нейротрансмісію, є джерелом фосфатидилхоліну. Останній забезпечує біосинтетичні процеси мембранних фосфоліпідів, що покращує пластичність та щільність ней–ронів. Іншим механізмом дії холіну альфосцерату є анаболічний ефект, що проявляється в стимуляції мембранного й гліцероліпідного синтезу внаслідок утворення попередників фосфоліпідів мембран із продуктів його метаболічного розпаду (Khaselev N., Murphy R.C., 2000).
На жаль, наукових праць, що вивчають вплив комбінації цих препаратів на регрес порушень когнітивного статусу та відновлення нервової системи у хворих із гострим ішемічним інсультом, недостатньо. Тому вивчення впливу комбінованої нейрометаболічної терапії на вищезазначені параметри у таких хворих є актуальним та перспективним.
Мета дослідження: дослідити вплив комбінованої нейрометаболічної терапії на регрес порушень когнітивних функцій та швидкість відновлення нервової системи у хворих із гострим ішемічним інсультом.
Матеріали та методи
До проспективного рандомізованого дослідження увійшов аналіз лікування 48 пацієнтів з гострим порушенням мозкового кровообігу за ішемічним типом у відділенні інтенсивної терапії № 1 КЗ «Клінічне об’єднання швидкої медичної допомоги» ДОР.
Критерії включення: пацієнти з гострим ішемічним інсультом (6–20 балів за NIHSS), які госпіталізовані в перші 24 години від початку захворювання, наявність згоди родичів або хворих на участь у дослідженні.
Критерії виключення: геморагічний інсульт або повторний ішемічний інсульт, гостре порушення мозкового кровообігу в стовбурі головного мозку, термін від початку ішемічного інсульту понад 24 години, декомпенсація хронічних захворювань, відмова родичів або хворих від участі в дослідженні.
Діагностика та лікування на всіх етапах здійснювались за уніфікованим клінічним протоколом (наказ МОЗ України № 602 від 03.08.2012). Оцінка стану проводилась при надходженні хворих у стаціонар, на 1-шу, 3-тю, 5-ту, 7-му та 14-ту добу. Використовувались загальноклінічні (артеріальний тиск, частота серцевих скорочень, частота дихальних рухів, SpO2), лабораторні (загальний аналіз крові, рівень глікемії, коагулограма) та інструментальні методи дослідження (нейровізуалізація на спіральному комп’ютерному томографі Thoshiba Activion-16 TSX-031A, електрокардіографія). Для оцінки неврологічного статусу використовувалися NIHSS, шкала коми Глазго (ШКГ), FOUR, Coma Recovery Scale та шкала оцінки стадійності відновлення нервової системи (за Доброхотовою Т.А., 2006), а також The Rancho Los Amigos Scale (Martin S., Kessler M., 2007) для оцінки когнітивних функцій у хворих із пригніченням свідомості.
Для аналізу первинної бази даних використовували результати описової статистики. У випадку нормального закону розподілу даних статистичні характеристики були подані у вигляді: об’єму вибірки (n — кількість спостережень), середнього арифметичного (М), стандартної похибки середнього (m), 95% довірчого інтервалу для середнього. Відмінності вважали статистично значущими при р < 0,05.
Залежно від виду комбінованої нейрометаболічної терапії хворих було розподілено на 2 групи (за методом конвертів).
До 1-ї групи (контрольної) увійшли 23 хворі з гострим порушенням мозкового кровообігу за ішемічним типом, у лікуванні яких нейрометаболічною складовою був цитиколін. Його вводили внутрішньовенно по 1000 мг 2 рази на добу протягом 14 діб.
2-гу групу (основну) становили 25 хворих із гострим порушенням мозкового кровообігу за ішемічним типом. Їм до цитиколіну (2000 мг на добу протягом 14 діб) додавали холіну альфосцерат. Препарат вводили внутрішньовенно по 1000 мг на добу протягом 14 днів.
Серед обстежених було 30 (62 %) чоловіків та 18 (38 %) жінок. Середній вік пацієнтів коливався від 51 до 84 (68,0 ± 5,4) років. Групи не відрізнялися за віковим чи гендерним складом.
Результати та обговорення
При надходженні хворих до стаціонару систолічний артеріальний тиск становив 190 ± 10 мм рт.ст., діастолічний артеріальний тиск — 115 ± 5 мм рт.ст., частота серцевих скорочень — 92 ± 3 за хвилину. Усі хворі мали порушення свідомості за шкалою коми Глазго. У 20 (42 %) із них порушення свідомості за ШКГ дорівнювало 7–8 балам, що відповідало комі I ступеня. У 28 (58 %) пацієнтів порушення свідомості за ШКГ становило 9–12 балів (сопор). При нейровізуалізації головного мозку в усіх пацієнтів виключено геморагічний інсульт. На КТ у всіх пацієнтів діагностовані ішемічні вогнища: у 70 % пацієнтів — у системі середньої мозкової артерії (лобна, тім’яна та скронева частки), у 30 % — ураження артерій вертебробазилярної системи на різних рівнях. Міжгрупових відмінностей за локалізацією патологічного процесу не було. Тяжкість хворих також не мала міжгрупових відмінностей та становила за NYHSS 18,0 ± 2,5 бала, за шкалою FOUR — 11 ± 2 бали, за Coma Recovery Scale — 11,0 ± 2,5 бала. За шкалою оцінки стадійності відновлення нервової системи (за Доброхотовою Т.А., 2006) стан хворих при надходженні відповідав 1–3-й стадії, а когнітивний статус за The Rancho Los Amigos Scale (Martin S., Kessler M., 2007) — 2–4-ї стадії.
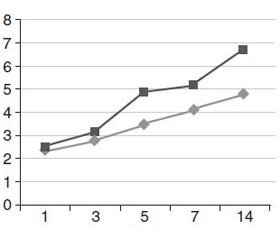
На 5-ту — 7-му добу спостереження в конт–рольній групі тяжкість хворих за NYHSS знизилась до 16,0 ± 1,3 бала, за шкалою FOUR — до 10,0 ± 1,2 бала, за Coma Recovery Scale — до 10,0 ± 1,5 бала. За шкалою оцінки стадійності відновлення нервової системи стан хворих відновився до 2–4-ї стадії (рис. 1), а когнітивний статус за The Rancho Los Amigos Scale — до 3–5-ї стадії (рис. 2).
/89-1.jpg )
В основній групі хворих, які отримували комбіновану нейрометаболічну терапію, на 5-ту — 7-му добу спостерігалося прискорення регресу неврологічної симптоматики. Так, за шкалою NYHSS кількість балів знизилась до 14,0 ± 1,5 бала (за рахунок відновлення сили м’язів верхньої кінцівки, зменшення вираженості афазії, дизартрії та відновлення рівня свідомості), за шкалою FOUR — до 8,0 ± 1,1 бала, за Coma Recovery Scale — до 8,0 ± 1,2 бала. У цій групі хворих спостерігалося прискорене відновлення нервової системи та когнітивних функцій. Так, відновлення нервової системи відповідало 3–6-й стадії, а відновлення когнітивного статусу підвищилося до 5–7-ї стадії.
Аналіз динаміки відновлення нервової системи на 14-ту добу захворювання показав, що в контро–льній групі його рівень не перевищував 4-ї стадії, що відповідало акінетичному мутизму з емоційними реакціями, тоді як при використанні комбінованої нейрометаболічної терапії рівень відновлення нервової системи досягав 6-ї стадії, або дезінтеграції (реінтеграції) мовлення на тлі сплутанної свідомості.
Аналіз відновлення когнітивного статусу за The Rancho Los Amigos Scale показав, що на тлі введення цитиколіну відновлення когнітивного статусу хворих не перевищувало 5-го рівня. Це відповідало сплутаній свідомості, але без постійного збудження, та початку орієнтації в навколишньому середовищі. На тлі комбінованої терапії цитиколіном із холіну альфосцератом відновлення когнітивних функцій було кращим та досягало 7-го рівня, що відповідало адекватній поведінці, автоматичному та неякісному виконанню звичних навичок.
Летальність на 7-му — 14-ту добу в контрольній групі становила 48 %, в основній — 35 %.
Висновки
Під впливом комбінованої нейрометаболічної терапії прискорюється відновлення психічної діяльності з 1–3-го до 3–6-го рівнів, когнітивного статусу — з 2–4-го до 5–7-го рівнів, що дозволяє рекомендувати її застосування з першої доби ішемічного інсульту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/89-1.jpg )