Современная детская ревматология достигла бесспорных успехов в изучении проблемы ювенильного артрита (ЮА), однако при рассмотрении этой сложной и многогранной патологии остаются дискуссионные и нерешенные вопросы. К ним относятся терминологические аспекты, вопросы нозологической принадлежности, этиологии и иммунопатогенеза, клинического полиморфизма дебюта и течения ЮА, его исходов. На сегодняшний день на первый план выходят проблемы, связанные с несовершенством критериев диагностики данного заболевания, вследствие чего отмечается большой процент диагностических ошибок [3, 25, 27]. Высокая распространенность ЮА в популяции, трудность ранней диагностики, нередкое вовлечение в патологический процесс внутренних органов, быстрое развитие инвалидности и неблагоприятный прогноз определяют актуальность проблемы ЮА [3, 4, 18–20].
ЮРА (МКБ-10: М08.0) относится к системным воспалительным заболеваниям соединительной ткани с преимущественной локализацией процесса в опорно-двигательном аппарате, в основе которого лежит дисфункция иммунной системы, выраженная аутоагрессия, что ведет к развитию патологических иммунных реакций. ЮРА развивается в возрасте до 16 лет, имеет хроническое тяжелое прогрессирующее течение и, как правило, неблагоприятный прогноз [3, 15, 17, 18].
Эпидемиология. ЮРА является одним из наиболее распространенных ревматических заболеваний (РЗ) в детском возрасте [2, 8, 30], частота встречаемости которого в различных регионах земного шара составляет от 0,05 до 0,8 % [2, 15, 17, 18, 30], заболеваемость — от 2 до 16–20 случаев в год на 100 000 детского населения [2, 13–15, 17], смертность — 0,5–1 % [15, 30].
В Украине распространенность ЮРА составляет 0,2–0,4 на 1000 детского населения [11, 21]. Показатели заболеваемости ЮРА отличаются в разных регионах Украины — с преимущественной встречаемостью в Черниговской области (0,48), г. Киеве (0,42), Днепропетровской области (0,34) [11, 21].
У четверти больных диагноз устанавливается при первом обращении к врачу, через год наблюдения возможные диагностические ошибки составляют также четверть случаев заболевания, что определяется сложностью клинической диагностики этой патологии у детей [20]. У половины больных развивается инвалидность после 3–5 лет болезни [5, 9, 14, 21].
Пик заболеваемости приходится на возраст 1–3 года и 8–10 лет, реже болеют дети до 1 года и старше 13 лет [20]. Девочки болеют в 1,5–2 раза чаще, чем мальчики [20]. Принято считать, что заболеваемость системным ювенильным артритом (сЮА) не имеет различий по полу и возрасту. Однако в большинстве случаев сЮА возникает у детей до 5 лет, хотя возможен дебют и в более старшем возрасте [16, 20].
Классификация и терминология. История изучения ЮРА ведет свой отсчет с середины прошлого столетия (Cornil M.V., 1864 г.; Diamantsberger M.S., 1891 г.) [3, 25, 27, 33, 36], когда M.S. Diamant-Вerger впервые обратил внимание на ряд особенностей течения заболевания у пациентов: гетерогенность клинической картины в дебюте заболевания, вовлечение в процесс преимущественно крупных суставов, поражение шейного отдела позвоночника, височно-нижнечелюстных суставов и органов зрения [27, 36]. В 1897 г. английский ученый Стилл и французский ученый Шаффар почти одновременно описали симптоматику заболевания, которая характеризовалась высокой лихорадкой, множественным поражением суставов, увеличением лимфатических узлов, печени, селезенки [17, 25, 27, 45]. Они высказали мнение, что это особая болезнь детского возраста, отличающаяся от суставной формы ревматоидного артрита (РА) у взрослых [17, 27]. Несмотря на данное мнение, длительное время РА у взрослых и детей рассматривали как единую нозологическую форму, встречающуюся в различные периоды жизни, хотя вопрос об идентичности болезни у взрослых и детей поднимался регулярно по мере развития педиатрической ревматологии [27]. Вариабельность клинических проявлений болезни в детском возрасте, а также их существенное отличие от симптоматики у взрослых дали основание американским ученым J.A. Coss и R.M. Boots в 1946 г. объединить все случаи хронических артритов у детей под единым названием «ювенильный (юношеский) ревматоидный артрит», тем самым отделив его от РА взрослых [17, 25, 27, 34]. Этот термин широко используется до настоящего времени.
Распознавание ЮРА нередко представляет немалые сложности. Это во многом объясняется большим сходством клинической картины суставного синдрома при многих РЗ, особенно на ранних стадиях заболевания [13, 26, 27]. Стремление свести к минимуму диагностические погрешности послужило причиной введения рядом авторов нового термина «ювенильный хронический артрит» (ЮХА), объединяющего все хронические воспалительные заболевания суставов у детей (1978 г.) [25, 27]. В семидесятых годах ХХ столетия Европейская лига против ревматизма (EULAR) приняла термин «ЮХА». «ЮРА» и «ЮХА» — это фактически два термина, которые обозначают одно заболевание [13, 17]. Зарубежные ученые используют термин «ЮХА» при наличии признаков хронического прогрессирующего артрита только в промежутках от дебюта заболевания до определения его четкой нозологической принадлежности [25]. Но, согласно классификации, только серопозитивный ЮРА составляет часть ЮХА [17, 25]. Однако классическая картина ЮРА может быть и без ревматоидного фактора (РФ), что не противоречит никак факту заболевания [25]. В классификации ЮХА не исключаются спондилоартропатии вследствие их частой встречаемости у детей при недифференцированной форме олигоартрита без поражения позвоночника (псориатический артрит, анкилозирующий спондилит) [17].
Согласно современной классификации Всемирной антиревматической лиги (ILAR) в 1997 г. введен термин «ювенильный идиопатический артрит» (ЮИА). При этом термины «ЮРА» и «ЮХА» исключаются, а все хронические воспалительные заболевания суставов у детей объединяются под термином «ЮИА» [7, 27, 42]. ЮИА представляет собой гетерогенную группу заболеваний, начавшихся до шестнадцатилетнего возраста, неясной этиологии, ведущим проявлением которых является хронический, преимущественно прогрессирующий суставной синдром, длящийся более 6 недель [7, 25, 27].
В основе любой классификации лежат классификационные диагностические критерии. Фактически набор критериев представляет собой описание картины классического заболевания. В США, в странах американского континента, Японии широко применяются Североамериканские диагностические критерии ЮРА (Brewer E.J., Bass J., Baum J., Cassidy J.T., 1977 г.; Cassidy J., Petty R., 1990 г.) [25, 32, 42]. К ним относятся:
1) начало заболевания до 16 лет;
2) артрит одного или более суставов, определяемый как отек или наличие выпота; кроме того, при этом необходимо учитывать наличие двух и более следующих признаков:
— ограничение объема движений,
— чувствительность или боль при движении,
— повышение местной температуры;
3) продолжительность болезни не меньше 6 недель;
4) тип начала болезни в течение первых 3–6 месяцев классифицируется как:
— полиартрит 5 и более суставов,
— олигоартрит 4 и менее суставов,
— системное начало (интермиттирующая лихорадка, ревматоидная сыпь, артрит, висцеральная патология);
5) исключаются другие РЗ.
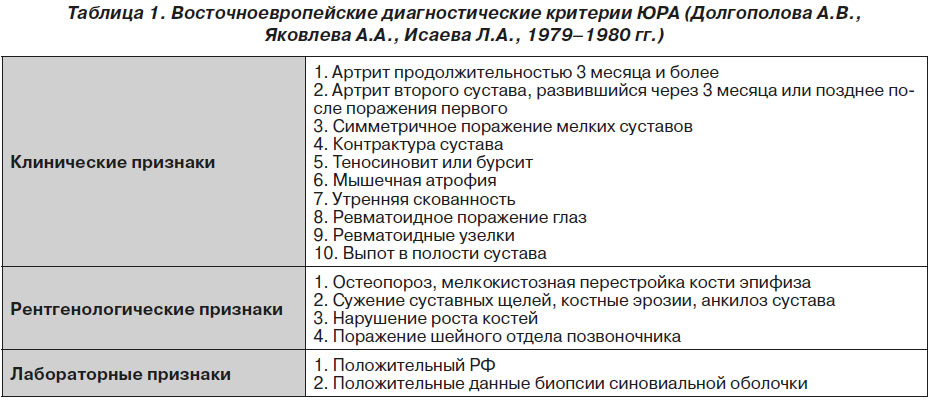
Рядом научных центров СССР и стран Восточной Европы в 1979 г. были разработаны диагностические критерии ЮРА, названные Восточноевропейскими (табл. 1) [13, 25, 26].
В отличие от Североамериканских эти критерии включали характерные рентгенологические признаки, данные биопсии синовиальной оболочки, наличие РФ в сыворотке крови. Однако разработанные критерии также стали объектом постоянного усовершенствования.
В 2008 г. С.О. Салугина и соавт. [25–27] опубликовали результаты исследования достоверности и специфичности тех или иных критериев ЮРА. Авторы пришли к выводу, что для дифференцировки ЮРА с ЮХА необходимо наличие как минимум 8 признаков Восточноевропейских критериев при обязательном наличии первого признака и исключении РЗ другой нозологической принадлежности. Эти критерии являются востребованными и используются детскими ревматологами на территории некоторых стран.
В мировой практике общепринятыми являются диагностические критерии РА Американской коллегии ревматологов (ACR/EULAR, 1987 г.), усовершенствованные в 2010 г. [25, 31]. Они разработаны специально для ранней диагностики, основаны на сочетании статистических расчетов и экспертной оценки, в них используется такой важный показатель, как АЦЦП — антитела к циклическому цитруллинированному пептиду, включают оценку характера поражения суставов (число и локализация), позволяют зафиксировать наличие активного воспаления и неблагоприятные прогностические факторы [31]. Однако их использование в педиатрической практике ограниченно с учетом вариабельности клинических проявлений болезни в детском возрасте, а также существенного отличия от симптоматики у взрослых [25].
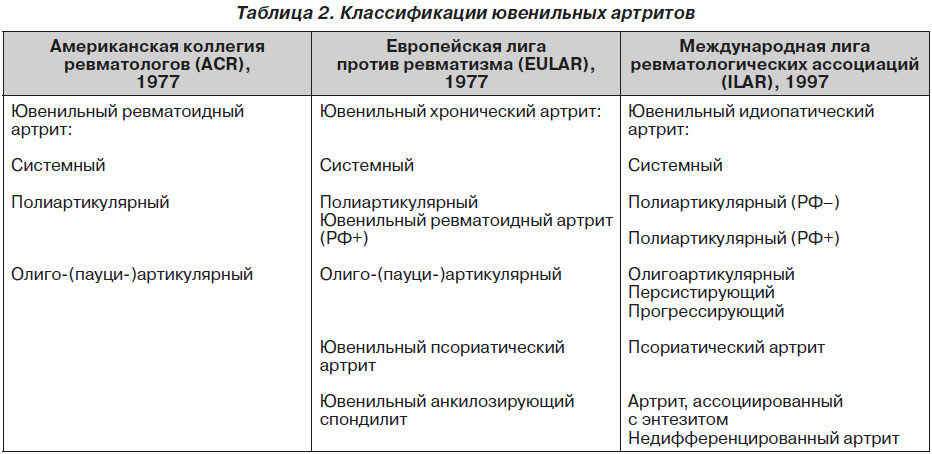
Основные различия наиболее распространенных классификаций ювенильных артритов приведены в табл. 2 [13, 21, 30, 32, 38, 42].
В современной классификации, разработанной ILAR, сохранено прежнее разделение ювенильных артритов на 3 варианта: системный, полиартикулярный и олигоартикулярный. РФ-положительный и РФ-отрицательный артриты выделяются в особые рубрики. Уточняется характер олигоартрита (персистирующий, прогрессирующий) [7, 17]. Предложенная классификация позволяет объединить под общим термином «ювенильный идиопатический артрит» как различные варианты ЮРА, так и ряд отдельных нозологических форм хронического артрита у детей — ювенильный спондилоартрит и даже ювенильный псориатический артрит. Это позволяет провести раннюю диагностику ЮРА с наименьшим количеством ошибок [7, 13, 17]. Классификация ILAR на сегодняшний день используется практически во всем мире [7].
В практическом здравоохранении диагностика РЗ и статистическая обработка структуры заболеваемости осуществляются в соответствии с Международной классификацией болезней (МКБ-10) [13, 17, 26, 30]. Принимая во внимание отсутствие в МКБ-10 термина «ювенильный идиопатический артрит», от широкого его использования следует воздержаться [13, 26, 27]. Согласно МКБ-10 выделяют:
— М08 — ювенильный (юношеский) артрит;
— М08.0 — ювенильный (юношеский) ревматоидный артрит;
— М08.1 — ювенильный спондилоартрит;
— М08.2 — ювенильный артрит с системным началом;
— М08.3 — ювенильный ревматоидный артрит, полиартрит;
— М08.4 — ювенильный ревматоидный артрит, пауциартрит;
— М08.8 — ювенильный хронический артрит;
— М08.9 — ювенильный хронический артрит, неуточненный;
— М09.0 — псориатический артрит.
Несмотря на упразднение термина «ювенильный ревматоидный артрит» в международной классификации артритов у детей, выделение ЮРА как самостоятельной нозологической формы диктуется временем и клиническим опытом, поскольку является практически единственной в детском возрасте вполне четко определенной нозологией, присутствующей в МКБ-10 и практике педиатра-ревматолога [27].
Этиология. Несмотря на значительные достижения в вопросах диагностики и лечения ЮРА, этиология и патогенез этого заболевания во многом остаются неясными [4, 7, 13, 17, 18].
Выделяют факторы, предрасполагающие к развитию ЮРА, и факторы, способствующие реализации ЮРА [3, 4, 18]. Предрасполагающие факторы, имеющие тропизм к тканям суставов, способны длительно в них персистировать, вызывая иммунное воспаление. К ним относятся артротропные персистирующие вирусы (ретровирусы, онкорнавирусы, парвовирусы), способные длительное время «бездействовать» и только в случае их инициации какими-либо провоцирующими факторами — осуществлять повреждения на уровне генома клетки [3, 4, 17, 18]. Вирусы Коксаки, Эпштейна — Барр, цитомегаловирус, вирусы герпеса, парвовирусы могут вызывать хроническую вирусную инфекцию на фоне иммунологических дефектов [3, 13, 18, 20]. Окончательно роль инфекции в развитии ЮРА до сих пор не доказана [7, 8, 13, 17]. Роль кишечной инфекции, гемолитического стрептококка в развитии ЮРА рядом ревматологов не признается [13, 17]. В литературе отмечаются данные о связи ЮРА с инфекцией, вызванной Mycoplasma pneumoniaе. Так, антитела IgG к микоплазме в диагностических титрах у больных ЮРА выявляются чаще (53 %), чем в популяции [13]. Роль хламидийной инфекции в развитии хронического воспаления в суставах у детей до конца не изучена. Около 80 % детей с ЮРА инфицированы Chlamydоphila pneumoniaе [13, 17]. Инициаторами развития воспаления могут быть частые острые респираторные вирусные инфекции, переохлаждение, инсоляция, профилактические прививки, гормональный дисбаланс, травмы суставов, неблагоприятные экологические факторы, хронические психоэмоциональные стрессы [3, 4, 13, 18].
Наследственная предрасположенность. Рядом авторов предполагается, что важную роль в возникновении и развитии ЮРА играют генетическая предрасположенность и особенности иммунной системы [4, 7, 8, 13, 17]. Иммуногенетические исследования подтвердили фундаментальные различия между ЮРА и РА взрослых, который может быть ассоциирован с антигенами гистосовместимости — DR4 и DRВ1-04 [3, 7, 12, 13, 17]. В качестве маркеров риска развития ЮРА называют А2, В27, А28, В35, DR5, DR8, DR1 [3, 13, 17]. По данным литературы [13, 17], протективный (защитный) эффект оказывают DR2 и DR7, которые достоверно реже встречаются у больных ЮРА. Кроме того, существуют сведения об ассоциации генов гистосовместимости HLA с ЮРА в целом и с отдельными формами и вариантами заболевания [3, 13, 17]. Так, HLA А2, DR5, DR8 являются маркерами олигоартрита у девочек, имеющих увеит, с серопозитивностью по антинуклеарному фактору [3, 6, 7, 13], HLA В27 — маркером риска развития ЮРА у мальчиков с олигоартритом или ограниченным полиартритом, с преимущественным поражением суставов нижних конечностей, с наличием энтезопатий в школьном или подростковом возрасте [6–8, 13, 30], HLA DR4, DR5, DRВ1-04 являются маркерами ЮРА у девочек с поражением мелких симметричных суставов кистей, серопозитивных (РФ+), с дебютом заболевания в старшем школьном возрасте [6, 7, 13].
Многие люди являются носителями генетической предрасположенности к РЗ, однако не болеют ими. Вирусы и бактерии считаются триггерными факторами, запускающими патологический процесс. Вследствие неадекватной реакции иммунной системы на эти возбудители развивается воспалительный процесс в суставах, а иногда и во внутренних органах. Развиваются так называемые аутоиммунные болезни, которые возникают вследствие агрессивного воздействия иммунной системы на собственные органы из-за потери ею способности различать «свои» и «чужие» клетки и ткани [3, 8, 13]. Таким образом, ЮРА является многофакторным заболеванием, которое развивается в результате сочетания генетической предрасположенности, особенностей иммунной системы и воздействия факторов внешней среды [3, 4, 8, 12].
Иммунопатогенез ЮРА. В патогенезе РЗ ключевую роль играют процессы аутоиммунитета и аутовоспаления, связанные с генетически детерминированными и индуцированными факторами внешней среды, дефектами активизации приобретенного и врожденного иммунного ответа [12, 22–24]. При активном воспалении у детей с разными вариантами ЮРА характерными являются вовлечение практически всех звеньев иммунной системы, активация клеточного и гуморального звена иммунитета [3, 4, 13, 17, 24]. В патогенезе ЮРА, особенно сЮА, превалируют аутовоспалительные механизмы, обусловленные реакциями врожденного иммунитета, в то время как у взрослых при РА превалируют аутоиммунные процессы [10, 23, 28, 35, 41]. Основу патогенеза составляют дефекты Т- и В-клеточных иммунных реакций, приводящие к гиперпродукции провоспалительных цитокинов и широкого спектра органоспецифических аутоантител, индуцирующих воспаление и деструкцию суставов и других тканей организма [17, 22–24, 30]. По современным представлениям, в патогенезе участвуют различные клетки и эффекторные молекулы иммунной системы, однако ключевую роль в развитии синовиального воспаления и суставной деструкции играют активированные CD4+Т-хелперные (Th) клетки, вызывающие активацию В-лимфоцитов и макрофагов, а также усиление продукции провоспалительных цитокинов и развитие хронического воспаления [1, 12, 17, 23, 24, 37]. Важной особенностью активации CD4+Т-клеток является поляризация иммунного ответа по Th1-типу с преобладанием синтеза провоспалительных цитокинов над противовоспалительными [19, 22, 24, 30, 37, 38]. Важное значение в нарушении иммунной толерантности к собственным белкам при РЗ имеют дефекты Т-регуляторных клеток [12, 22–24].
Цитокины, являясь низкомолекулярными белковыми молекулами, обеспечивают процесс межклеточных коммуникаций при воспалении, иммунном ответе и межсистемных взаимодействиях, участвуют в регуляции нормальных биологических процессов в организме [12, 17, 19, 29, 37].
Условно цитокины делятся на несколько групп, среди которых выделяют провоспалительные (интерлейкины (ИЛ)-1, -6, -8, -17, фактор некроза опухоли a (ФНО-a), интерферон-γ, хемокины) и противовоспалительные цитокины (ИЛ-4, -10, -13, фактор роста) [1, 17, 19, 37]. Гиперпродукция провоспалительных цитокинов лежит в основе повреждения синовиальной оболочки сустава, хряща, а также в основе развития системных проявлений болезни. Среди большого количества провоспалительных цитокинов центральное место в развитии ревматоидного синовита занимают ФНО-a, ИЛ-6, ИЛ-1b [4, 12–14, 19, 23].
ФНО-a является типичным провоспалительным цитокином, ведущим к развитию хронического воспаления, деструкции хряща и кости, потере костной ткани [4, 7, 12, 19, 32]. Это «ранний» цитокин, появляющийся в дебюте развития воспалительной реакции [29]. ФНО-a может непосредственно вызывать воспалительный эффект, а также вызывать индукцию других провоспалительных цитокинов (ИЛ-1, -6, -8) [4, 12, 19, 29]. Кроме того, ФНО-a способствует продукции металлопротеиназ (особенно стромелизина и коллагеназ), играющих значительную роль в разрушении костной и хрящевой ткани [4, 12, 17, 29]. С морфологических позиций маркером ЮРА является эрозия хряща, а количество и качество эрозий соответствуют тяжести процесса.
Ключевым цитокином в иммунопатогенезе сЮА является ИЛ-6 [5, 7, 10, 16, 28, 35]. С его гиперпродукцией связывают такие внесуставные проявления болезни, как лихорадка, гипохромная анемия, тромбоцитоз. ИЛ-6 стимулирует продукцию гепатоцитами острофазовых белков (С-реактивного белка (СРБ), фибриногена, амилоида А), секрецию гепсидина, который уменьшает всасывание железа и ингибирует его высвобождение из макрофагов, что приводит к дефициту железа и развитию анемии [5, 7, 16, 22, 28, 39].
Такие проявления системного действия ИЛ-6, как лихорадка и утренняя скованность, связаны с суточным ритмом секреции данного цитокина [10, 16, 22, 28, 29]. ИЛ-6 стимулирует дифференцировку остеокластов, активирует их, усиливает резорбцию кости и, как следствие, способствует развитию генерализованного остеопороза, эрозивных изменений в суставах [5, 12, 22, 29, 35]. ИЛ-6 способствует пролиферации и дифференцировке В-лимфоцитов в зрелые плазматические клетки, секретирующие аутоантитела (РФ, антитела к цитруллинированным белкам) [12, 22, 29]. ИЛ-6 блокирует выработку адренокортикотропного гормона, кортизола, гормона роста, что приводит к развитию усталости, сонливости, депрессии и отставанию в росте. Развитие амилоидоза при этом заболевании также ассоциируется с активностью данного цитокина [12, 16, 22, 28, 29, 35]. Отмечена также стимуляция выработки лептина — гормона, способствующего формированию анорексии [22].
Провоспалительное действие оказывает также ИЛ-1.
ИЛ-1b вызывает усиление пролиферации фибробластов, повышение продукции коллагеназ, металлопротеиназ, стимуляцию пенетрации синовиальных фибробластов в хрящ в области паннуса, индукцию синтеза ИЛ-6, -8, ИФН-γ [12, 29]. Играет роль ИЛ-1 в генезе сЮА [7, 17, 29, 32, 41]. В то же время высокая частота неудач при лечении больных с сЮА анти-ФНО-препаратами указывает на то, что роль цитокина ФНО-a при сЮА не является решающей в развитии патологического процесса [29, 35].
Состояние цитокиновой сети при различных вариантах ЮРА до конца не изучено. Некоторые авторы указывают на максимальное повышение ИЛ-6 и -1 при сЮА по сравнению с другими вариантами ЮРА [29, 32, 35, 41]. Выявлено значительное повышение ФНО-a в сыворотке у пациентов с полиартикулярным ЮРА [29, 43, 44]. ФНО-a играет роль в хронизации процесса [4]. Содержание ФНО-a значительно выше у больных с высокими значениями РФ [12]. Высокий уровень ФНО-a выявлен также при сЮА [4, 29, 44]. ФНО-a имеет значение в патогенезе поражения суставов при всех формах ЮРА, но не имеет прямого отношения к системным проявлениям заболевания [5, 29, 32, 41, 43]. Некоторые авторы [29, 40] указывают на то, что концентрация ФНО-a в крови зависит в большей степени от активности, чем от формы заболевания. Существует также точка зрения, что со значительным повышением уровня ФНО-a связано такое тяжелое осложнение сЮА, как синдром активации макрофагов, что подтверждается успешным использованием моноклональных антител к ФНО-a в лечении данного состояния. Однако описано развитие синдрома активации макрофагов как осложнения анти-ФНО-терапии [29, 35].
Уровень провоспалительных цитокинов коррелирует с активностью воспаления и отражает тяжесть заболевания, а также определяет дальнейший прогноз [1, 10, 29, 40]. Выявлена взаимосвязь между уровнем провоспалительных цитокинов (ИЛ-1b, -6), хемокинов (IP-10) и клинико-лабораторными показателями активности заболевания (скорость оседания эритроцитов, СРБ, количество пораженных суставов) [1, 10, 14, 29, 40]. Определяется более высокий уровень ИЛ-6 и IP-10 в группе пациентов с высокой активностью патологического процесса и группе пациентов, серопозитивных по IgM РФ, антителам к цитруллинированным белкам [1, 29]. Некоторые авторы рассматривают наличие СРБ и высокого уровня ИЛ-6 в качестве прогностического маркера прогрессирующего течения болезни и раннего развития системного остеопороза [3, 29].
У больных с олигоартикулярным ЮРА выявляется повышенный уровень ИЛ-4, -10, что ассоциируется с отсутствием развития значительных эрозивных изменений в суставах и более благоприятным течением [17, 26]. В силу того, что олигоартикулярный ЮРА представляет собой достаточно ограниченный воспалительный процесс с развитием воспаления в небольшом числе суставов, уровни провоспалительных цитокинов при нем ниже, чем при системном и полиартикулярном ЮРА [29, 43].
У детей с РЗ значимую роль играет не абсолютное количество образования тех или иных цитокинов, а дисбаланс про- и противовоспалительных цитокинов [17, 19, 29], который может возникнуть под действием повреждающего фактора, например вирусной инфекции. У большинства детей после ликвидации действия повреждающего фактора восстанавливается нормальное соотношение цитокинов, а у детей с генетической предрасположенностью дисбаланс сохраняется, что ведет к развитию РЗ [1, 17, 19, 29].
Таким образом, развитие хронического воспаления при РЗ опосредуется разнообразными нарушениями в системе иммунитета, активность воспаления коррелирует с изменениями синтеза широкого спектра иммунных медиаторов. По современным представлениям, в основе патогенеза иммуновоспалительных РЗ лежит сочетание генетически детерминированных (система HLA, полиморфизм генов цитокинов) и приобретенных дефектов (дисбаланс) иммунорегуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные факторы внешней среды, такие как инфекции, нарушение микробиоты кишечника, переохлаждение, инсоляция [12, 22, 23, 38]. Терминология и современная классификация остаются по-прежнему предметом постоянных дискуссий как среди ученых, так и практикующих ревматологов [25–27].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о вкладе каждого автора:
Чернышева Ольга Евгеньевна — анализ полученных данных, написание текста;
Конюшевская Алла Анатольевна — сбор и обработка материалов;
Вайзер Наталья Валерьевна — сбор и обработка материалов;
Балычевцева Ирина Вячеславовна — сбор и обработка материалов.
Список литературы
1. Авдеева А.С. и др. Связь уровней цитокинов с активностью заболевания, уровнем аутоантител и деструктивными изменениями суставов при раннем ревматоидном артрите // Научно-практическая ревматология. — 2015. — № 4(53). — С. 385-390.
2. Бзарова Т.М. и др. Опыт применения растворимых рецепторов к ФНО у больной тяжелым полиартикулярным вариантом ювенильного ревматоидного артрита // Вопросы современной педиатрии. — 2010. — Т. 9, № 3. — С. 88-96.
3. Беляева Л.М. Детская кардиология и ревматология: Практическое руководство. — М.: ООО «Медицинское информационное агентство», 2011. — 584 с.
4. Беляева Л.М. и др. Современные подходы к терапии ревматических болезней у детей // Международный журнал педиатрии, акушерства и гинекологии. — 2013. — Т. 3, № 3. — С. 25-34.
5. Бережний В.В. та ін. Тоцилізумаб у лікуванні ювенільного ревматоїдного артриту // Здоровье ребенка. — 2015. — № 2(61). — С. 151-157.
6. Бойко Я.Є. HLA В 27 у дітей з ювенільним ідіопатичним артритом: клінічна оцінка 72 хворих // Український ревматологічний журнал. — 2007. — № 2(28). — С. 61-64.
7. Бойко Я.Є. Еволюція поглядів на класифікацію та терапію ювенільного ідіопатичного артриту // Український ревматологічний журнал. — 2008. — № 1. — С. 30-39.
8. Бойко Я.Є. Ювенільний ревматоїдний артрит: що треба знати // Дитячий лікар. — 2011. — № 5(12). — С. 39-52.
9. Бойко Я.Є. Віддалені наслідки ювенільного ревматоїдного артриту: Результати спостереження 70 хворих // Український ревматологічний журнал. — 2014. — № 56(2). — C. 67-72.
10. Бойко Я.Є., Чернишов В.П. Цитокінові маркери та прогностичні фактори несприятливого перебігу ювенільного ідіопатичного артриту // Український ревматологічний журнал. — 2012. — № 49(3). — С. 16-22.
11. Волосовец О.П. Состояние оказания медицинской помощи детям с кардиоревматологической патологией // Здоровье ребенка. — 2015. — № 5(65). — С. 125-135.
12. Генно-инженерные биологические препараты в лечении ревматоидного артрита / Под ред. Е.Л. Насонова. — М.: ИМА-ПРЕСС, 2013. — 522 с.
13. Руководство по детской ревматологии / Н.А. Геппе, Н.С. Подчерняева, Г.А. Лыскина. — М.: ГЭОТАР-Медиа, 2011. — 720 с.
14. Дудник В.М., Вижга Ю.В. Оцінка фармакологічної ефективності базисної терапії ювенільного ревматоїдного артриту // Современная педиатрия. — 2014. — № 8(64). — С. 115-118.
15. Избранные лекции по педиатрии / Под ред. А.А. Баранова, Р.Р. Шиляева, Б.С. Каганова. — М.: ИД «Династия», 2005. — 640 с.
16. Каледа М.И., Никишина И.П., Родионовская С.Р. Клиническое наблюдение применения тоцилизумаба при рефрактерном системном ювенильном артрите с поражением легких и синдромом активации макрофагов // Научно-практическая ревматология. — 2015. — Т. 53, № 4. — С. 446-451.
17. Кардиология и ревматология детского возраста: Рук-во для врачей / Под ред. Г.А. Самсыгиной, М.Ю. Щербаковой. — М.: Медпрактика, 2004. — 744 с.
18. Кулик М.С., Барзилович В.Д., Минченко А.П. Ревматоидный артрит: Особенности этиопатогенеза // Український научно-медичний молодіжний журнал. — 2012. — № 1. — С. 71-74.
19. Марушко Т.В. та ін. Роль про- і протизапальних цитокінів у розвитку запального процесу при ювенільному ревматоїдному артриті // Український ревматологічний журнал. — 2006. — № 1(23). — С. 33-36.
20. Методичні вказівки для самостійної роботи студентів при підготовці до практичного (семінарського) заняття «Диференційна діагностика суглобового синдрому у дітей. Ювенільний ревматоїдний артрит, реактивні артрити». — Вінницький національний медичний університет ім. М.І. Пирогова, 2014. — 50 с.
21. Наказ МОЗ України від 22.10.2012 р. № 832 «Про затвердження уніфікованого протоколу медичної допомоги дітям, хворим на ювенільний артрит» // Современная педиатрия. — 2012. — № 6(46). — 19 с.
22. Насонов Е.Л. Достижения ревматологии в XXI в. // Научно-практическая ревматология. — 2014. — Т. 52, № 2. — С. 133-141.
23. Насонов Е.Л., Александрова Е.Н., Новиков А.А. Аутоиммунные ревматические заболевания: итоги и перспективы научных исследований // Научно-практическая ревматология. — 2015. — Т. 53, № 3. — С. 230-237.
24. Насонов Е.Л. и др. Т-регуляторные клетки при ревматоидном артрите // Научно-практическая ревматология. — 2014. — Т. 52, № 4. — С. 430-437.
25. Рейтмаєр М.Й. Ювенільний ревматоїдний артрит: сучасні термінологічні, класифікаційні та діагностичні розбіжності // Архів клінічної медицини. — 2012. — № 2. — С. 91-94.
26. Салугина С.О. Ювенильный артрит — клинические варианты, течение и исходы при многолетнем наблюдении: Автореф. дис… д-ра мед. наук: 14.00.39 / С.О. Салугина; НИИ ревматологии РАМН. — М., 2009. — 44 с.
27. Салугина С.О. Нозологическая диагностика ювенильного артрита на разных этапах наблюдения // Соврeменная ревматология. — 2010. — № 3. — С. 22-28.
28. Федеральные клинические рекомендации по оказанию медицинской помощи детям с юношеским артритом с системным началом / Под ред. А.А. Баранова. — М., 2015. — 24 с.
29. Федоров Е.С., Салугина С.О., Кузьмина Н.Н. Роль цитокиновой сети в регуляции воспаления при различных вариантах ювенильного артрита // Научно-практическая ревматология. — 2009. — № 3. — С. 74-89.
30. Ювенильный артрит: клинические рекомендации для педиатров. Детская ревматология / Под ред. А.А. Баранова, Е.И. Алексеевой. — М.: ПедиатрЪ, 2013. — 120 c.
31. Alves C. et al. Diagnostic performance of the ACR/EULAR 2010 criteria for rheumatoid arthritis and two diagnostic algorithms in an early arthritis clinic (REACH) // Ann. Rheum. Dis. — 2011. — Vol. 70. — P. 1645-1647.
32. Cassidy J.T. et al. Textbook of pediatric rheumatology. — 6th ed. — Philadelphia: Saunders Elsevier, 2010. — 794 р.
33. Cornil M.V. Memoire sur les coincidences pathologiques du rhumatisme articulaire chronique // Mem. Soc. Biol. (Pa-ris). — 1864. — Vol. 4. — Р. 3-25.
34. Coss J.A., Boots R.M. Juvenile rheumatoid arthritis // J. Pediatr. — 1946. — Vol. 29. — P. 143-156.
35. De Benedetti F. Inflammatory cytokines in the pathoge-nesis and treatment of systemic juvenile idiopathic arthritis // Pediatric Rheumatology Online J. — 2005. — Vol. 3. — P. 122-136.
36. Diamant-Вerger M.S. Du Rheumatisme noueux (polyarthrite deformante) chez les enfants. There pour le doctoralen medicine. — Paris: Lecrosnier et Babe, 1891.
37. Feldmann M., Maini S. Role of cytokines in rheumatoid arthritis: an education in pathophysiology and therapeutics // Immunological Reviews. — 2008. — Vol. 223. — P. 7-19.
38. Horneff G. Juvenile arthritides // Z. Rheumatology. — 2010. — Vol. 69, № 8. — P. 719-736.
39. Lipsky P. Interleukin-6 and rheumatic diseases // Arthritis. Res. Ther. — 2006. — Вd. 8. — S. 2.
40. Ou L.S. et al. Association between serum inflammatory cytokines and disease activity in juvenile idiopathic arthritis // Clin. Rheumatology. — 2002. — Vol. 1. — P. 52-56.
41. Pascual V. et al. Role of interleukin-1 (IL-1) in the patogenesis of systemic onset juvenile idiopathic arthritis and clinical response to IL-1 blockade // J. Experimental Medicine. — 2005. — Vol. 201. — P. 1479-1486.
42. Petty R.E. et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: se-cond revision, Edmonton, 2001 // Journal of Rheumatology. — 2004. — Vol. 31. — P. 390-392.
43. Roony M. et al. Tumor necrosis factor alpha and it so-luble receptor in juvenile chronic arthritis // Rheumatology. — 2000. — Vol. 39. — P. 432-438.
44. Shahin A.A. et al. Circulating interleukin-6, so-luble interleukin-2 receptors, tumor necrosis factor alpha, and interleukin-10 levels in juvenile chronic arthritis: correlations with soft tissue vascularity assessed by power Doppler sonography // Rheumatology Int. — 2002. — Vol. 22. — P. 8.
45. Still G.F. On a from of chronic joint disease in children // Reprinted in Clin. Orthop. — 1990. — Vol. 259. — P. 4-10.