Целіакія (celiac disease, CD), за визначенням Європейської спілки дитячих гастроентерологів, гепатологів і нутриціологів (ESPGHAN), — це імуно–опосередковане системне захворювання, індуковане впливом глютену та інших проламінів, що виникає у генетично схильних осіб і характеризується присутністю варіабельної комбінації глютензалежних клінічних проявів, наявністю специфічних антитіл, HLA-DQ2 або HLA-DQ8 гаплотипів та ентеропатії [1]. За даними систематичного обзору та метааналізу Prashant Singh та співавт. (2018), поширеність целіакії, підтвердженої морфологічно, у світі варіює від 0,3 % у Південній Америці до 0,8 % у країнах Європи [2]. Спостерігається зростання глобальної поширеності целіакії з 0,6 % (1991–2000 рр.) до 0,8 % (2001–2016 рр.) із значним переважанням поширеності хвороби серед дітей порівняно з дорослими (0,9 % проти 0,5 % відповідно). У зв’язку з мінливістю та варіабельністю клінічних проявів целіакії, можливістю безсимптомного перебігу більшість випадків захворювання лишаються своєчасно недіагностованими, що значно погіршує якість життя та прогноз перебігу захворювання у цих пацієнтів [3].
Популяційне дослідження, проведене у Швеції, до якого ввійшли 10 903 хворих на целіакію дітей, продемонструвало, що порівняно з загальною популяцією діти з целіакією мають 1,4-кратне підвищення ризику розвитку психічних розладів [4]. Дитяча целіакія визнана фактором ризику виникнення тривожних станів, розладів поведінки, харчування, настрою, синдрому дефіциту уваги та гіперактивності, інтелектуальної недостатності, розладів аутистичного спектра (autism spectrum disorder, ASD). Маніфестація психічних порушень зазвичай випереджає появу гастроінтестинальних симптомів. Серологічний скринінг, проведений серед 382 італійських дітей з ASD дошкільного віку, встановив поширеність целіакії 2,62 %, що перевищувало показник загальної педіатричної популяції. Практично половина з цих дітей не мала жодних інших симптомів чи факторів ризику, пов’язаних із CD [5]. Jonas F. Ludvigsson та співавт. (Швеція, 2013) у когорті з 40 018 пацієнтів виявили асоціацію ASD з позитивними CD-специфічними серологічними тестами й продемонстрували 1,5–2-кратне збільшення ризику формування ASD у хворих на CD з характерними змінами слизової оболонки тонкого кишечника та 3-кратне підвищення ризику у пацієнтів з незміненою слизовою та позитивними серологічними тестами [6]. Обсерваційне дослідження, проведене в Колумбійському університетському медичному центрі, показало, що хворі з ASD становлять переважну більшість серед пацієнтів без целіакії, прихильних до безглютенової дієти, що може свідчити про її корисність для цих хворих, незважаючи на недостатність доказів її ефективності [7].
За даними епідеміологічних досліджень, у 20–70 % дітей, хворих на ASD, виявляються гастроінтестинальні симптоми, серед яких найчастіше спостерігаються метеоризм, здуття живота, діарея, запор [8]. Тяжкість шлунково-кишкових проявів у дітей з ASD зазвичай корелює зі ступенем вираженості симптомів основного захворювання, але в певних випадках гастроінтестинальні розлади можуть не діагностуватися через нетиповий перебіг або труднощі у спілкуванні з невербальними пацієнтами [9].
Наявність зв’язку ASD та CD є приводом для дискусій науковців протягом 40 років. На сьогодні питання «чи мають ASD спільні з CD або відмінні патогенетичні молекулярні механізми?» залишається остаточно не визначеним. Підвищена імунна реактивність хворих з ASD до глютену пояснюється гіпотезою зміненої проникності слизової оболонки кишечника (leaky gut) внаслідок CXCR3-асоційованого MyD88-залежного вивільнення зонуліну, дезінтеграції щільних контактів, підвищення парацелюлярного транспорту токсичних (аа31–43) та імуногенних (аа56–87) пептидів гліадину [10], а також безпосередньою здатністю фрагментів гліадину підвищувати збудливість нейронів [11] та індукувати запальну відповідь в нервовій тканині. Діти з ASD, що супроводжуються гастроінтестинальними симптомами, характеризуються вірогідним підвищенням TLR4-залежної продукцїї прозапальних мукозасоційованих цитокінів (інтерлейкін-5, -15, -17) та експресії гена зонуліну [12]. На відміну від американських дослідників Jan Jozefczuk та співавт. не виявили серологічних маркерів порушення інтестинального бар’єру у хворих з ASD, а продемонстрували, що 27,3 % хворих на ASD реагують на глютен продукцією антитіл до нативного гліадину (AGA IgG), 5,2 % — продукцією антитіл до невральної трансглутамінази 6 (anti-TG6) при відсутності CD-специфічних антитіл [13]. У дослідженні Nga M. Lau та співавт. також встановлено, що діти з аутизмом характеризуються підвищенням IgG до гліадину, не асоційованим з підвищенням антитіл до тканинної трансглутамінази 2 та гаплотипом HLA-DQ2/DQ8 [14].
Через відсутність достатньої доказової бази ряд авторів вважають, що рутинний скринінг на целіакію та глютен-асоційовані захворювання в усіх пацієнтів з ASD на даний момент не є достатньо обґрунтованим та економічно ефективним [15, 16]. На сьогодні діти з захворюваннями аутистичного спектра не входять до переліку асоційованих із CD станів, рекомендованих для проведення обов’язкового скринінгу на CD, згідно з діагностичним алгоритмом, запропонованим ESPGHAN у 2012 році [1].
Незважаючи на суперечливість висновків дослідників, більшість науковців одностайна у визнан–ні присутності глютен-асоційованих захворювань у певної частки хворих з ASD. Ретельний диференціально-діагностичний пошук гастроінтестинальних та екстраінтестинальних проявів дозволить своєчасно діагностувати глютензалежні захворювання у дітей з ASD.
Для ілюстрації наводимо клінічний випадок діагностики целіакії у дитини з аутизмом.
Хлопчик, 2009 року народження, надійшов до відділення дитячої гастроентерології ДУ «Інститут гастроентерології НАМН України» у лютому 2018 року зі скаргами на запори з відсутністю самостійного випорожнення протягом 5 діб, 1 раз на 2 тижні спостерігалось блювання після прийому їжі без порушень загального самопочуття, підвищення апетиту.
Анамнез захворювання. Запори спостерігаються з 6-го місяця життя, після введення прикорму. Скарги на періодичне блювання — з 3-річного віку.
Анамнез життя. Народився від другої вагітності, що перебігала без ускладнень; других пологів шляхом кесарського розтину (перші пологи — мертвонароджена дитина), з масою тіла 4000 г, зростом 55 см, з оцінкою за шкалою Апгар 8–9 балів. На грудному вигодовуванні перебував до 4 міс., потім переведений на штучне вигодовування адаптованою сумішшю. На першому році життя у фізичному та психомоторному розвитку не відставав: сидіти почав з 6 міс., стояти, тримаючись за опору, з 8 міс., ходити — з 11 міс., гуління та лепет вчасно. Маса тіла в 1 рік — 10,8 кг, зріст — 78,5 см. На третьому році життя з’явились симптоми затримки мовного розвитку, порушення комунікативних здібностей. З відповідними скаргами мама звернулася до невролога у квітні 2013 року (вік дитини — 4 роки 1 міс.). Встановлено діагноз «когнітивна недостатність, загальний недорозвиток мовлення». З 14.10.2014 по 20.10.2014 обстежений у КЗ «Дніпропетровська клінічна психіатрична лікарня» ДОР, діагноз змінено на «атиповий аутизм з помірною когнітивною недостатністю (F84.1)».
Об’єктивний стан. Загальний стан дитини при надходженні у відділення середньої тяжкості за рахунок диспептичного синдрому, психоневрологічних розладів. Фізичний розвиток середній, індекс маси тіла = 16,22 (+0,25 SD). Шкіра бліда, чиста, помірно волога. Тургор м’яких тканин збережений. Підшкірно-жирова клітковина розвинена достатньо, розподілена рівномірно. Периферичні лімфатичні вузли не збільшені. У легенях дихання везикулярне. Серцеві тони гучні, ритмічні. Живіт м’який, помірно здутий, безболісний. Печінка не збільшена. Селезінка не збільшена. Сечовиділення вільне, безболісне. Дефекація утруднена, болісна, кал типу 2 за Бристольською шкалою.
Психологічний статус. Продуктивний контакт відсутній. Увага не фіксована. Дитина не реагує на своє ім’я, прості вербальні інструкції не виконує. Словарний запас обмежений. Мовлення погано розбірливе, стерте. Порушена та недостатньо комунікативна функція мовлення: використовує склади замість слів, речення не формує, словосполучення утворює погано. Порушення комунікації близьке до соціальної дезадаптації. Невербальна комунікація також порушена та не використовується для пояснення своїх потреб (не використовує жестів, міміки). Поведінка дитини з елементами рухової розгальмованості, плесканням в долоні, не утримується на місці. Часом спостерігається негативізм, може виявляти емоційні реакції: гнів, страх, роздратованість, вираженість яких може бути значною, до самотравмування. Хода хитка. В інтелектуальному розвитку відмічається помірне відставання, когнітивний дефіцит. Пізнавальна цікавість значно редукована, вибіркова. Кругозір обмежений. Проте вміє читати по складах, рахувати до 100. Порушень сну немає. Порушення харчової поведінки у вигляді підвищеного апетиту (відсутність відчуття насичення). Ігрова поведінка дитини характеризується несоціалізованістю, нефункціональністю. Активно протестує проти різноманітних змін у повсякденному розкладі життя, маршрутів прогулянок, оточуючих умов.
Дані лабораторних та інструментальних методів обстеження
Загальний аналіз крові від 06.02.2018: гемоглобін — 114 г/л; еритроцити — 4,1 Т/л; кольоровий показник — 0,83; тромбоцити — 308 г/л; лейкоцити — 3,6 г/л; швидкість осідання еритроцитів — 8 мм/год; сегментоядерні — 60 %; еозинофіли — 1 %; лімфоцити — 38 %; моноцити — 1 %; гематокрит — 35 %.
Біохімічний аналіз крові від 06.02.2018: загальний білок — 69 г/л; білірубін загальний — 7,0 мкмоль/л; аланінамінотрансфераза — 11,2 Од/л; аспартатамінотрансфераза — 16,5 Од/л; лужна фосфатаза — 203,9 Од/л; гамма-глютамілтранс–пептидаза — 13,1 Од/л; амілаза — 25,6 Од/л; сечовина — 3,66 ммоль/л; креатинін — 56,7 мкмоль/л; глюкоза крові — 4,8 ммоль/л; залізо сироватки — 13,8 мкмоль/л; натрій — 139 ммоль/л; калій — 4,3 ммоль/л; хлор — 103 ммоль/л, кальцій сироватки загальний — 2,31 ммоль/л (нижня межа норми).
IgA до тканинної трансглутамінази від 06.02.2018: індекс позитивності — 10,63 (норма — < 1,0).
IgG до гліадину від 06.02.2018: 21,3 Од/мл.
Антитіла до ендомізію IgA від 10.02.2018 у титрі 1 : 100 (перевищує 10 норм).
Загальний аналіз сечі від 06.02.2018: прозора; питома вага — 1007; реакція нейтральна; білок не знай–дений; глюкоза не знайдена; лейкоцити — 2–4 в полі зору (п/зору); епітелій плаский — 2–4 в п/зору; діастаза сечі — 94,8 Од/л (норма — до 360 Од/л).
Копрограма від 06.02.2018: м’язові волокна перетравлені та неперетравлені — помірної кількості, нейтральний жир — «–» , мила — «–». Аналіз калу на яйця гельмінтів негативний.
Ультразвукова діагностика органів черевної порожнини від 06.02.2018: дисхолія, підсилений судинний рисунок печінки, дифузні зміни підшлункової залози.
Генотипування алелей локусу HLA-DQA1 та HLA-DQB1 головного комплексу гістосумісності людини II класу від 12.02.2018: DQA1*0501 позитивний; DQB1*0201-03 позитивний; DQB1*0302 негативний.
Фіброгастродуоденоскопія від 07.02.2018: катаральна гастропатія, катаральна дуоденопатія; уреазний тест негативний; рН 1,0, взята біопсія в антрумі та позацибулинному просторі.
Патоморфологічний висновок: нормальна гістоструктура слизової оболонки антрального відділу шлунка.
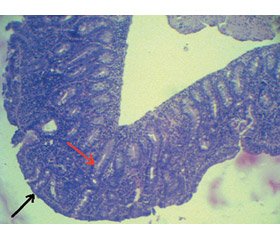
Патоморфологічний висновок біоптату слизової оболонки дванадцятипалої кишки (ДПК) та позацибулинного відділу ДПК: тотальна атрофія кишкових ворсинок (тяжкого ступеня); гіперплазія крипт (рис. 1); підвищена кількість міжепітеліальних лімфоцитів (більше 30 лімфоцитів/100 епітеліальних клітин); сплощення покровного епітелію (рис. 2).
Встановлено клінічний діагноз «целіакія, типова форма, період активних проявів. Латентна залізодефіцитна анемія 1-го ст. Атиповий аутизм з помірною когнітивною недостатністю».
Обговорення
Наведений нами клінічний випадок є яскравим прикладом пізньої діагностики целіакії у симптомного пацієнта. Особливістю клінічного фенотипу захворювання у представленого хлопчика є поєднання (overlap) гастроінтестинальних проявів целіакії з характерними для ASD симптомами (дефіцит соціального спілкування та взаємодії, повторювані патерни поведінки й діяльності, рестриктованість інтересів). Саме труднощі у вербальній і невербальній комунікації, а також зміни сприйняття болю у хворих з ASD зазвичай ускладнюють інтерпретацію та оцінку симптомів з боку шлунково-кишкового тракту. Тому слід пам’ятати, що спонтанне погіршення невербальної поведінки дитини (ажитація, тривога, агресія, самотравматизація, порушення сну) може бути альтернативною ознакою гастроінтестинальних розладів й стимулом до пошуку супутньої патології [17].
Маніфестація клінічних симптомів при аутизмі звичайно відбувається у віці 18–30 місяців. Приблизно 30 % дітей, хворих на ASD з типовим раннім розвитком, демонструють регресію, або втрату соціальних, комунікативних, моторних навичок на першому році життя [18]. Шлунково-кишкові симптоми приєднуються пізніше або супроводжують маніфестацію психоневрологічних розладів. У нашому випадку дебют специфічної симптоматики спостерігався на третьому році життя, а гастроінтестинальні прояви передували появі психоневрологічної регресії й мали чіткий зв’язок з віковими змінами харчування, що може свідчити на користь целіакії. Таким чином, тривалість персистенції гастроінтестинальних симптомів, зв’язок їх появи з маніфестацією основних проявів ASD, особливостями харчування та віком дитини повинні братися до уваги при плануванні диференційно-діагностичного пошуку.
Розвиток системних (позакишкових) проявів при целіакії має спільні з ураженням нервової системи при ASD патогенетичні механізми [11], тому відсутність типової гастроінтестинальної симптоматики у хворого з ASD не виключає ймовірності поєднання цих захворювань, що вимагає проведення скринінгових досліджень для виключення целіакії у цих хворих. Згідно з консенсусом з діагностики целіакії ESPGHAN, тестом першої ланки для асимптомних хворих з ASD може бути HLA-генотипування [1].
В описаному нами клінічному випадку практично 10-кратне підвищення рівнів анти-TG2 та антиендомізіальних антитіл було достатнім діагностичним критерієм для встановлення діагнозу целіакії. Виявлення CD-специфічних гаплотипів підтвердило діагноз. Результати морфологічного дослідження слизової позацибулинного відділу дванадцятипалої кишки надали безсумнівні докази присутності специфічних змін слизової (тотальної атрофії кишечних ворсин, гіперплазії крипт, інтраепітеліальної лімфоцитарної інфільтрації).
Таким чином, пацієнти з ASD є групою підвищеного ризику щодо поєднання з целіакією. У дітей з ASD слід приділяти особливу увагу своєчасному виявленню та інтерпретації гастроінтестинальних та інших симптомів з метою виявлення кишкових та позакишкових проявів глютензалежних захворювань. Тестом першої ланки для діагностики целіакії у симптомних хворих з ASD може бути визначення CD-специфічних серологічних маркерів, при відсутності характерної гастроінтестинальної симптоматики рекомендовано визначення CD-специфічних HLA-гаплотипів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про фінансування: фінансування не отримувалось.
Інформація про внесок кожного з авторів
Н.Ю. Завгородня — концепція роботи, аналіз літературних джерел і клінічних даних, узагальнення матеріалів, написання тексту, оформлення для публікації.
О.Ю. Лук’яненко — збір та аналіз літературних джерел і клінічних даних, написання тексту.
Н.О. Жигір — збір та аналіз клінічних даних, написання тексту.
Ю.А. Гайдар — підготовка та оформлення ілюстративного матеріалу.
Список литературы
1. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease / S. Husby, S. Koletzko, I. Korponay-Szabo [et al.] // Journal of pediatric gastroenterology and nutrition. — 2012. — Vol. 54, № 1. — P. 136-160. — doi: 10.1097/MPG.0b013e31821a23d0.
2. Global prevalence of celiac disease: systematic review and meta-analysis / P. Singh, A. Arora, T.A. Strand [et al.] // Clinical Gastroenterology and Hepatology. — 2018. — Vol. 1542–3565, № 1. — P. 30783-30788. — doi: 10.1016/j.cgh.2017.06.037.
3. NASPGHAN clinical report on the diagnosis and treatment of gluten-related disorders / I.D. Hill, A. Fasano, S. Guandalini [et al.] // Journal of pediatric gastroenterology and nutrition. — 2016. — Vol. 63, № 1. — P. 156-165. — doi: 10.1097/MPG.0000000000001216.
4. Celiac disease is associated with childhood psychiatric disorders: a population-based study / A. Butwicka, P. Lichtenstein, L. Frisén [et al.] // The Journal of pediatrics. — 2017. — Vol. 184. — P. 87-93. — doi: 10.1016/j.jpeds.2017.01.043.
5. Serological screening for Celiac Disease in 382 pre-schoolers with Autism Spectrum Disorder / S. Calderoni, E. Santocchi, Del Bianco Calderoni S. [et al.] // Italian journal of pediatrics. — 2016. — Т. 42, № 1. — Р. 98. — doi: 10.1186/s13052-016-0308-x.
6. A Nationwide Study of the Association Between Celiac Disease and the Risk of Autistic Spectrum Disorders / Jonas F. Ludvigsson [et al.] // JAMA Psychiatry. — 2013. — Vol. 70, № 11. — P. 1224-30. — doi: 10.1001/jamapsychiatry.2013.2048.
7. Characteristics and comorbidities of inpatients without celiac disease on a gluten-free diet / J.W. Blackett, M. Shamsunder, N.R. Reilly [et al.] // European journal of gastroenterology &hepatology. — 2018. — Vol. 30, № 4. — P. 477-483. — doi: 10.1097/MEG.0000000000001071.
8. Chaidez V. Gastrointestinal problems in children with autism, developmental delays or typical development / V. Chaidez, R.L. Hansen, I. Hertz-Picciotto // Journal of autism and developmental disorders. — 2014. — Vol. 44, № 5. — P. 1117-1127. — doi: 10.1007/s10803-013-1973-x.
9. Microbiota Transfer Therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study / D.W. Kang, J.B. Adams, A.C. Gregory [et al.] // Microbiome. — 2017. — № 1. — P. 10. — doi: 10.1186/s40168-016-0225-7.
10. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity / A. Sapone, K.M. Lammers, V. Casolaro [et al.] // BMC medicine. — 2011. — Vol. 9, № 1. — P. 23. — doi: 10.1186/1741-7015-9-23.
11. The gliadin peptide 31-43 exacerbates kainate neurotoxicity in epilepsy models / E. Gerace, F. Resta, E. Landucci [et al.] // Scientific Reports. — 2017. — Vol. 7, № 1. — P. 15146. — doi: 10.1038/s41598-017-14845-4.
12. Differential immune responses and microbiota profiles in children with autism spectrum disorders and co-morbid gastrointestinal symptoms / D.R. Rose, H. Yang, G. Serena [et al.] // Brain, behavior, and immunity. — 2018. — № 18. — P. 30078-3. — doi: 10.1016/j.bbi.2018.03.025.
13. The Occurrence of Antibodies Against Gluten in Children with Autism Spectrum Disorders Does Not Correlate with Serological Markers of Impaired Intestinal Permeability / J. Józefczuk, E. Konopka, J.B. Bierła [et al.] // Journal of medicinal food. — 2018. — Vol. 21, № 2. — P. 181-187. — doi: 10.1089/jmf.2017.0069.
14. Markers of celiac disease and gluten sensitivity in children with autism / N.M. Lau, P.H. Green, A.K. Taylor [et al.] // PloSone. — 2013. — Vol. 8, № 6. — P. e66155. — doi: 10.1371/journal.pone.0066155.
15. Autism spectrum disorder and celiac disease: no evidence for a link / I.C. Batista, L. Gandolfi, Y.K.M. Nobrega [et al.] // Arquivos de neuro-psiquiatria. — 2012. — Vol. 70, № 1. — P. 28-33. — doi: 10.1590/S0004-282X2012000100007.
16. The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis / E. Lionetti, R. Francavilla, P. Pavone [et al.] // Developmental Medicine & Child Neurology. — 2010. — Vol. 52, №. 8. — P. 700-707. — doi: 10.1111/j.1469-8749.2010.03647.x.
17. Wasilewska J. Gastrointestinal symptoms and autism spectrum disorder: links and risks — a possible new overlap syndrome / Jolanta Wasilewska, Mark Klukowski // Pediatric. Health Med. Ther. — 2015. — № 6. — Р. 153-166. — doi: 10.2147/PHMT.S85717.
18. Ruggieri V.L. Autistic regression: clinical and aetiological aspects / Ruggieri V.L., Arberas C.L. // Rev. Neurol. — 2018. — Vol. 66. — P. S17-S23.

/127-1.jpg)
/128-1.jpg)