Резюме
Актуальність. У пацієнтів із цукровим діабетом (ЦД) 2-го типу виявляють підвищену реактивність тромбоцитів (Тц), причини якої не з’ясовані. Перевіряється гіпотеза залежності функціональної активності рецепторів Тц від індивідуальної реактивності організму. Мета дослідження: встановити, чи відрізняється індивідуальна реактивність Тц у пацієнтів із діабетичною непроліферативною ретинопатією (ДНПР). Матеріали та методи. Дослідження включало 19 хворих (19 очей) із ЦД 2-го типу, у яких за результатами клініко-інструментального обстеження та відповідно до класифікації ETDRS виявлена ДНПР. Офтальмологічне обстеження проводилось до початку лікування і включало збір анамнезу, дослідження гостроти зору з оптимальною оптичною корекцією, тонометрію, гоніоскопію, біомікроскопію, офтальмоскопію, оптичну когерентну томографію (апарат Stratus OCT). Для активації Тц використовували агоністи: аденозиндифосфат (АДФ; 2,5 мкМ), адреналін (2,5 мкМ), ангіотензин 2 (Ан-2; 1,0 мкМ), фактор активації тромбоцитів (ФАТ; 75,0 мкМ) і колаген (2,0 мг/мл). Оцінку агрегації Тц проводили спектрофотометричним методом на агрегометрі ChronoLog (США). Результати. Виявлена індивідуальна реактивність Тц у пацієнтів із ДНПР, що проявлялася особливостями індукції тромбогенезу. Встановлена гіперреактивність Тц стосовно трьох агоністів: адреналіну, колагену і Ан-2, яка характерна для протромбогенного фенотипу. Залежно від функціональної активності досліджених рецепторів виявили два основних кластери рецепторів Тц, які збігалися за активністю α2-адренорецепторів і ангіотензинових рецепторів 1-го типу, але відрізнялися реакцією Тц на колаген. Висновки. Визначення протромбогенного фенотипу і кластерів функціонально активних рецепторів Тц відкриває можливість оцінки проагрегантного впливу етіологічних і патогенетичних чинників ЦД 2-го типу з метою встановлення факторів прогресування діабетичної ретинопатії.
Актуальность. У пациентов с сахарным диабетом (СД) 2-го типа выявляют повышенную реактивность тромбоцитов (Тц), причины которой остаются не выясненными. Проверяется гипотеза зависимости функциональной активности рецепторов Тц от индивидуальной реактивности организма. Цель исследования: установить, отличается ли индивидуальная реактивность Тц у пациентов с диабетической непролиферативной ретинопатией (ДНПР). Материалы и методы. Исследование включало 19 больных (19 глаз) с СД 2-го типа, у которых по результатам клинико-инструментального обследования и в соответствии с классификацией ETDRS обнаружена легкая стадия ДНПР. Офтальмологическое обследование проводилось до начала лечения и включало сбор анамнеза, исследование остроты зрения с оптимальной оптической коррекцией, тонометрию, гониоскопию, биомикроскопию, офтальмоскопию, оптическую когерентную томографию (аппарат Stratus OCT). Тромбоциты выделяли путем центрифугирования из цитратной периферической крови пациентов. Для активации Тц использовали агонисты: аденозиндифосфат (АДФ, 2,5 мкМ), адреналин (2,5 мкМ), ангиотензин 2 (Ан-2; 1,0 мкМ), фактор активации тромбоцитов (ФАТ; 75,0 мкМ) и коллаген (2,0 мг/мл). Оценку агрегации Тц проводили спектрофотометрическим методом на агрегометре ChronoLog (США). Результаты. Выявленная индивидуальная реактивность Тц у пациентов с легкой стадией ДНПР проявлялась особенностями индукции тромбогенеза. Обнаружена гиперреактивность Тц в отношении трех агонистов: адреналина, коллагена и Ан-2, которая была характерна для протромбогенного фенотипа. В зависимости от функциональной активности исследованных рецепторов выделили два основных кластера рецепторов Тц, которые совпадали по активности α2-адренорецепторов и ангиотензиновых рецепторов 1-типа, но отличались реакцией Тц на коллаген. Выводы. Определение протромбогенного фенотипа и кластеров функционально активных рецепторов Тц открывает возможность оценки проагрегантного влияния этиологических и патогенетических факторов СД 2-го типа с целью установления факторов прогрессирования ДР.
Background. Patients with type 2 diabetes mellitus (DM) have increased reactivity of thrombocytes (Tc), the causes of which remain unclear. The hypothesis of the dependence of Tc receptors functional activity on the individual reactivity of the organism is tested. The purpose of the study was to establish whether the individual reactivity of Tc differs in patients with diabetic nonproliferative retinopathy (DNPR). Materials and methods. The study included 19 patients (19 eyes) with type 2 DM, who, according to the results of the clinical and instrumental examination and according to the Early Treatment of Diabetic Retinopathy Study classification, had mild DNPR. Ophthalmological examination was performed before the beginning of treatment and included the collection of anamnesis, visual acuity study with optimal optical correction, tonometry, gonioscopy, biomicroscopy, ophthalmoscopy, optical coherence tomography (Stratus OCT apparatus). Thrombocytes were isolated by centrifugation from citrated peripheral blood of patients. To activate Tc, agonists were used: adenosine diphosphate (2.5 μM), adrenaline (2.5 μM), angiotensin II (1.0 μM), platelet activating factor (75.0 μM) and collagen (1.0 mg/ml). The Tc aggregation was evaluated by a spectrophotometric method on the ChronoLog aggregometer (USA). Results. The revealed individual reactivity of Tc in patients with DNPR was manifested by the features of thrombogenesis induction. A hyperreactivity of Tc to three agonists was detected: adrenaline, collagen and angiotensin II, which was characteristic of prothrombogenic phenotype. Depending on the functional activity of the investigated receptors, two main clusters of Tc receptors were identified, which were equal by the activity of α2-adrenoreceptors and angiotensin type 1 receptors, but differed by the response of Tc to collagen. Conclusions. Determination of the prothrombogenic phenotype and clusters of functionally active Tc receptors opens the possibility for evaluating the proaggregant effect of etiological and pathogenetic factors of type 2 DM in order to establish the factors of diabetic retinopathy progression.
Вступ
Удосконалення профілактики і лікування ускладнень цукрового діабету (ЦД) потребує нових знань, що стосуються причин порушення мікроциркуляції органів. Останніми роками акцент досліджень був перенесений на аналіз тромбоцитарної ланки гемостазу [1]. Це цілком логічно з огляду на участь тромбоцитів (Тц) у формуванні циркулюючих агрегатів і тромбогенезі, що обумовлює оклюзію судин мікроциркуляторного русла, геморагії, набряк і лейкоцитарну інфільтрацію [2]. Наявність аналогічних морфологічних змін в судинній оболонці при ЦД 2-го типу [3] обґрунтовує актуальність дослідження функціонального стану Тц при діабетичній ретинопатії (ДР). Відомо, що у хворих на ЦД часто реєструється гіперреактивність Тц [4]. У зв’язку з цим залишається нез’ясованою низка питань: чи відрізняється індивідуальна реактивність Тц у пацієнтів із ДР; чи змінюється сенситивність рецепторів Тц на тлі керованої глікемії, чи відрізняється функціональна активність рецепторів Тц при прогресуванні ДР та після проведеної лазерної коагуляції сітківки? Інтерес до функціонального стану рецепторів пов’язаний із можливістю зростання проагрегантного стану Тц під впливом гуморальних чинників [5, 6]. На увагу заслуговують ранні стадії розвитку ДР, оскільки залишається без відповіді питання: чому в одних пацієнтів відбувається швидке, а в інших — повільне прогресування захворювання? Можна припустити, що реакція Тц на різні агоністи відрізняється, а отже, у пацієнтів із ЦД мають місце різні кластери функціональної активності рецепторів. Така гіпотеза ґрунтується на індивідуальній реактивності організму, за якою індукція програгентного статусу Тц у пацієнта буде залежати від конкретного спектра діючих патогенетичних факторів ЦД.
Мета роботи — встановити, чи відрізняється індивідуальна реактивність тромбоцитів у пацієнтів із непроліферативною діабетичною ретинопатією.
Матеріали та методи
Дослідження включало 19 хворих (19 очей) із ЦД 2-го типу, у яких за результатами клініко-інструментального обстеження та відповідно до класифікації ETDRS [7] виявлена непроліферативна ДР. Середній вік пацієнтів становив 69,7 ± 2,1 року; найбільша кількість хворих — 11 (57,9 %) перебувала у віковому діапазоні 70–80 років, який розглядається як фактор ризику атеросклеротичного ураження великих судин голови. Глікемія досягала рівня 8,51 ± 0,55 ммоль/л. Усі хворі, включені в дослідження, оглядалися ендокринологом і нефрологом. Офтальмологічне обстеження проводилось до початку лікування і містило візометрію за допомогою комп’ютеризованого фороптера (Refractor RT-5100, Nidek, Японія) та проектора оптичних знаків (CP-770, Nidek, Японія), пневмотонометрію (NT-530, Nidek, Японія, та тонометр Гольдмана), кераторефрактометрію (ARK-1000 OPD-Scan II, Nidek, Японія), біомікроскопію переднього відрізку (щілинна лампа Haag-Streit BQ 900, Швейцарія), біомікроретиноскопію за допомогою ширококутної лінзи Super Pupil XL (Volk Optical, США), оптичну когерентну томографію (Optovue RTVue, Optovue, США). Група контролю включала 10 здорових осіб, які проходили діагностичне обстеження і не мали клініко-лабораторних ознак цереброваскулярної та кардіальної патології. Контрольна група була порівнянна за віком із хворими, у яких діагностована непроліферативна ДР.
Тц виділяли шляхом центрифугування із цитратної периферичної крові пацієнтів і використовували для оцінки функціональної активності рецепторів. У дослідженні застосовували агоністи: АДФ (2,5 мкМ); адреналін (2,5 мкМ); ангіотензин 2 (Ан-2, 1 мкМ); фактор активації тромбоцитів (ФАТ, 75 мкМ) і колаген (2,0 мг/мл). Агоністи (Sigma, США) використовували в ефективній концентрації (ЕС50), що викликала у здорових осіб (10 донорів) агрегацію Тц (АТц) на рівні 50 ± 5 %. Оцінку АТц проводили спектрофотометричним методом на агрегометрі ChronoLog (США). При проведенні аналізу використовували статистичний пакет Medstat. Точкова оцінка величин, що підлягали аналізу, проводилася шляхом розрахунку медіани (Mе) та її похибки (m). Для узагальнення отриманих результатів розраховувався 95% довірчий інтервал (95% ДІ). При аналізі міжгрупових розбіжностей у випадку двох груп застосовували критерій Стьюдента (у випадку нормального закону розподілу та кількісних характеристик), критерій Вілкоксона (у випадку відмінності закону розподілу від нормального й якісних характеристик). У всіх випадках відмінність вважалася статистично значущою при рівні значущості р < 0,05.
Результати
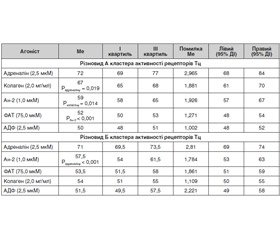
Проведене дослідження показало, що порівняно з контролем (здорові індивіди) відзначалася гіперреактивність Тц стосовно трьох агоністів: адреналіну, колагену і Ан-2 (табл. 1), тобто визначався протромбогенний фенотип Тц.
/30-1.jpg)
При цьому реакція Тц на адреналін перевищувала таку в контрольній групі на 42,6 % (р < 0,001), Ан-2 — на 25,7 % і колагену — на 18,4 % (р < 0,001). Отже, у хворих із непроліферативною ДР виявлені особливості реакції Тц на агоністи, які відбивають роль етіопатогенетичних чинників (активацію симпатоадреналової і ренін-ангіотензинової систем та експозицію колагену базальної мембрани судин) в індукції тромбогенезу. Необхідно підкреслити, що саме адреналін є провідним індуктором АТц, підтвердженням чого були значення агрегації, які увійшли до першого і третього квартилів, — відповідно 69 і 74 %; ефект інших агоністів був значно менший. Виявлений факт відбивав гіперадренореактивний стан організму, тобто підвищену реакцію α2-адренорецепторів на клітинах — мішенях до катехоламінів, і, що важливо, цей стан може бути верифікованим в тесті in vitro на Тц.
До цього часу залишається нез’ясованим, чи можна класифікувати кластери (об’єднання) функціонально активних рецепторів при ДР. Проведені дослідження показали, що у обстежених пацієнтів із непроліферативною ДР існували два основних кластери рецепторів Тц, що враховували функціональний стан досліджених рецепторів (α2-адренорецеп–торів і пуринових рецепторів, GPVI-рецепторів до колагену, ангіотензинових рецепторів 1-го типу (АТ1-рецепторів) і ФАТ-рецепторів). Встановлено, що у 8 (42,1 %) пацієнтів реакція Тц на адреналін перевищувала таку на колаген і Ан-2 — на 7,5 і 22 % відповідно (р < 0,05).
Функціональна активність рецепторів знижувалася в ряду досліджених агоністів наступним чином: α2-адренорецептор > GPVI-рецептор > АТ1-ре–цеп–тор > ФАТ-рецептор = пуринові рецептори (різновид А кластера активності рецепторів; табл. 2).
У 11 (57,9 %) пацієнтів також спостерігалася гіперадренореактивність; реакція Тц на адреналін перевищувала таку на Ан-2, колаген, ФАТ і АДФ — відповідно на 23,5, 31,5, 32,7 і 37,9 % (р < 0,001). Кластер активності рецепторів змінювався і виглядав так: α2-адренорецептор > АТ1-рецептор > GPVI-рецептор = ФАТ-рецептор = пуринові рецептори (різновид Б кластера функціонального стану рецепторів).
Таким чином, кластери співпадали за високою активністю α2-адренорецепторів і АТ1-рецепторів, але відрізнялися реакцією Тц на колаген. У різновиді кластера А реактивність Тц стосовно колагену перевищувала таку в різновиді кластера Б на 24,1 % (р < 0,001), тоді як реакція Тц на адреналін, Ан-2, ФАТ і АДФ статистично значуще не відрізнялася (р > 0,05). Причому активність пуринових (Р2Y1 і P2Y12) і ФАТ-рецепторів відповідала діапазону нормореактивності.
Обговорення
При аналізі функціонального стану Тц, які обумовлюють дисфункцію мікроциркуляторного русла, необхідно враховувати сталість дії етіологічних факторів ЦД на клітини крові і можливість взаємодії різних рецепторів в ініціації АТц [8]. У межах цих міркувань було визначено стан: а) α2-адренорецепторів, що дозволило контролювати вплив активації симпато-адреналової системи на агрегацію Тц [9]; б) GPVI-рецепторів, оскільки необхідно було враховувати вплив субендотеліального колагену базальної мембрани судин на тромбогенез [10]; в) АТ1-рецепторів, які відображають реактивність Тц стосовно Ан-2 за наявності гіпертензії [11]; г) пуринових P2Y1- и P2Y12-рецепторів, сенситивність яких визначає ефективність автокринної стимуляції Тц [12]; ФАТ-рецепторів, оскільки необхідно контролювати вплив запалення на тромбогенез. Відомо, що ФАТ секретується активованими лейкоцитами і вважається паракринним стимулятором Тц при запаленні [13].
У пацієнтів із непроліферативною ДР вперше виявлено протромбогенний фенотип Тц, який характеризується гіперреактивністю Тц до адреналіну, колагену і Ан-2. Причому домінуючий ефект адреналіну (стосовно дії інших агоністів) дозволяє характеризувати даний фенотип Тц як гіперадренореактивний. Виявлений фенотип Тц демонстрував наявність двох кластерів функціонального стану рецепторів, які відрізнялися різним ступенем індукуючого впливу колагену на АТц. Доказ відмінності функціонального стану рецепторів Тц у хворих із ДР підводив до необхідності ідентифікації кластерів рецепторів, що відбивало спектр патогенетичних факторів ЦД 2-го типу, здатних підвищувати реактивність Тц. Така концепція вкладається в рамки індивідуальної реактивності організму. Так, якщо у пацієнта з ЦД 2-го типу генетично детермінована підвищена експресія α2-адренорецепторів Тц, то в розвитку ускладнень захворювання адреналін відіграє істотну роль. За цих умов відмінності в проагрегантній активації Тц у двох різних пацієнтів з ЦД можуть залежати від стимулюючої дії колагену, якщо експресія GPVI-рецепторів до колагену відрізняється. Основою для формування кластерів рецепторів може бути їх взаємодія при стимуляції Тц. Так, адреналін, Ан-2, АДФ і ФАТ зв’язуються з рецепторами, які асоційовані із Gi- і Gq-білками внутрішньоклітинних сигнальних шляхів, причому всі вони, включаючи рецептор GPVI до колагену, модулюють активність фосфоліпази С(β). Отже, ці агоністи (вони ж фактори патогенезу ЦД 2-го типу) можуть взаємодіяти і тим самим посилювати тригерний сигнал, що активує Тц [14]. У цьому контексті наслідком гіперреактивності Тц до адреналіну і колагену може бути ініціація тромбогенезу і порушення мікроциркуляції судинної оболонки та сітківки ока.
Таким чином, визначення кластерів функціонально активних рецепторів Тц відкриває можливість оцінки проагрегантного впливу патогенетичних чинників ЦД з метою виявлення факторів прогресування ДР.
Висновки
1. Зростання реактивності тромбоцитів до адреналіну, Ан-2 та ФАТ відбивало участь симпа–тоадреналової і ренін-ангіотензинової систем, а також формування лейкоцитарно-тромбоцитарних агрегатів при реалізації запалення в патогенезі початкової стадії ДР.
2. У хворих з початковою стадією непроліферативної ДР виявився протромбогенний фенотип Тц, який характеризувався двома кластерами функціонального стану рецепторів, що відрізняються різним ступенем індукуючого впливу колагену на АТц.
3. Індивідуальна реактивність Тц до колагену може бути фактором ризику прогресування ДР, оскільки розвиток при ЦД ендотеліальної дисфункції і підвищена експозиція субендотеліального колагену базальної мембрани судин можуть провокувати тромбогенез і геморагії у мікроциркуляторному руслі сітківки ока.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Alterations in insulin-signaling and coagulation pathways in platelets during hyperglycemia-hyperinsulinemia in healthy non-diabetic subject / A.K. Rao, R.J. Freishtat, G. Jalagadugula [et al.] // Thromb. Res. — 2014. — Vol. 134(3). — Р. 704-710.
2. Rodrigues S.F. Synergistic effects of high blood cholesterol and hypertension on leukocyte and platelet recruitment in the cerebral microcirculation / S.F. Rodrigues, L.D. Almeida-Paula, D.N. Gran–ger // Hypertension. — 2014. — Vol. 63(4). — Р. 747-752.
3. Optic disc morphology in unilateral branch retinal vein occlusion using spectral domain optical coherence tomography / A. Szigeti, M. Schneider, M. Ecsedy [et al.] // BMC Ophthalmol. — 2015. — Vol. 15. — Р. 178.
4. Platelet function profiles in patients with diabetes mellitus / F. Rollini, F. Franchi, A. Muñiz-Lozano [et al.] // J. Cardiovasc. Transl. Res. — 2013. — Vol. 6(3). — Р. 329-345.
5. Better detection of platelet aggregation in patients with me–tabolic syndrome using epinephrine and ADP // L. Perez-Campos-Mayoral, E. Pérez-Campos, E. Zenteno [et al.] // Diabetol. Metab. Syndr. — 2014. — Vol. 6(1). — Р. 93.
6. Hayes C. Decreased Threshold of Aggregation to Low-Dose Epinephrine is Evidence of Platelet Hyperaggregability in Patients with Thrombosis / C. Hayes, S. Kitahara, O. Tcherniantchouk // Hematol. Rep. — 2014. — Vol. 6(3). — Р. 5326.
7. Early Treatment Diabetic Retinopathy Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified Airlie House classification. ETDPS report number 10 // Ophthalmology. — 1991. — Vol. 98. — Р. 786-806.
8. Hyperreactive platelet phenotypes: relationship to altered serotonin transporter number, transport kinetics and intrinsic response to adrenergic co-stimulation / J.S. Berger, R.C. Becker, C. Kuhn [et al.] // Thromb. Haemost. — 2013. — Vol. 109(1). — Р. 85-92.
9. Analysis of platelet alpha2-adrenergic receptor activity in stable coronary artery disease patients on dual antiplatelet therapy / B.J. Béres, E. Tóth-Zsámboki, K. Vargová [et al.] // Thromb. Haemost. — 2008. — Vol. 100(5). — Р. 829-838.
10. Novel pharmacological inhibitors demonstrate the role of the tyrosine kinase Pyk2 in adhesion and aggregation of human platelets / G.F. Guidetti, M. Zarà, I. Canobbio [et al.] // Thromb. Haemost. — 2016. — Vol. 116(5). — Р. 904-917.
11. Eggers A.E. A new theory of essential hypertension based on analysis of the association between a polymorphism of the α2-adrenoceptor at the 10q24-q26 locus and hypertension in African-Americans // Med. Hypotheses. — 2015. — Vol. 85(5). — Р. 603-606.
12. Effects of P2Y(1) and P2Y(12) receptor antagonists on platelet aggregation induced by different agonists in human whole blood / R.F. Storey, L.J. Newby, S. Heptinstall [et al.] // Platelets. — 2001. — Vol. 12(7). — Р. 443-447.
13. SIRT1 prevents pulmonary thrombus formation induced by arachidonic acid via downregulation of PAFreceptor expression in platelets / Y.H. Kim, J.U. Bae, I.S. Kim [et al.] // Platelets. — 2016 Jun 8. — Р. 1-8 [Epub ahead of print].
14. Баринов Э.Ф. Взаимодействие гуморальных агонистов в активации тромбоцитов при хронической ишемии мозга / Э.Ф. Баринов, С. Мамедалиева, Т.А. Твердохлеб // Вестник Российской академии медицинских наук. — 2015. — Т. 70, № 3. — С. 328-333.

/30-1.jpg)
/31-1.jpg)