Журнал «Медицина неотложных состояний» №4(91), 2018
Пирексия и антипиретическая терапия у больных при критических состояниях
Авторы: Мальцева Л.А.(1), Мосенцев Н.Ф.(2), Лисничая В.Н.(2), Козаченко И.В.(2)
(1) — ГУ «Днепропетровская медицинская академия», г. Днепр, Украина
(2) — КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова», г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Резюме
Підвищення температури ядра тіла є однією з найчастіших аномальних ознак у пацієнтів, що надійшли у відділення інтенсивної терапії (ВІТ), і це пов’язано зі збільшенням смертності серед деяких груп пацієнтів із тяжкими захворюваннями. Підвищена температура тіла виявляється приблизно у 50 % дорослих пацієнтів, що надійшли у ВІТ. Підвищена температура тіла класифікується як пірексія або гіпертермія. Пірексія (також називається лихоманкою) розглядається як адаптивна відповідь на фізіологічний стрес, що регулюється через ендогенні пірогенні і антипіретичні шляхи та пов’язаний зі збільшенням гіпоталамічного заданого значення. Гіпертермічні синдроми включають: гіпертермію навколишнього середовища, в тому числі тепловий удар; гіпертермію, викликану лікарськими засобами; нейролептичний злоякісний синдром; синдром серотоніну і ендокринні причини, включаючи тиреотоксикоз, феохромоцитому і наднирковий криз. Багато епізодів пірексії викликані інфекціями. Найбільш поширеними джерелами інфекції є нижні дихальні шляхи, внутрішньочеревні інфекції, інфекції сечових шляхів та інші, що включають інфекцію шкіри та м’яких тканин, кісток або суглобів, інфекцію центральної нервової системи, етмоїдних і верхньощелепних пазух. Пірексія неінфекційної етіології також є поширеною причиною лихоманки у пацієнтів у ВІТ. Для боротьби з пірексією можуть використовуватися антипіретики, головним чином парацетамол і нестероїдні протизапальні препарати, а також фізичні методи охолодження. Жарознижувальна терапія поширена у ВІТ. Дослідження жарознижувальної терапії, що включали як септичних, так і несептичних пацієнтів, не виявили істотного покращення 28-денної госпітальної летальності у дорослих критичних пацієнтів із сепсисом або без нього. Додаткові дослідження поліпшать розуміння патофізіології пірексії і сприятимуть розвитку даного напрямку.
Повышение температуры ядра тела является одним из наиболее часто встречающихся аномальных признаков у пациентов, поступивших в ОИТ, и это связано с увеличением смертности среди некоторых групп пациентов с тяжелыми заболеваниями. Повышенная температура тела обнаруживается примерно у 50 % взрослых пациентов, поступивших в отделение интенсивной терапии (ОИТ). Повышенная температура тела классифицируется как пирексия или гипертермия. Пирексия (также ее называют лихорадкой) рассматривается как адаптивный ответ на физиологический стресс, который регулируется через эндогенные пирогенные и антипиретические пути и связан с увеличением гипоталамического заданного значения. Гипертермические синдромы включают: гипертермию окружающей среды, в том числе тепловой удар; гипертермию, вызванную лекарственными средствами; нейролептический злокачественный синдром; синдром серотонина и эндокринные причины, включая тиреотоксикоз, феохромоцитому и надпочечниковый криз. Многие эпизоды пирексии вызваны инфекциями. Наиболее распространенными источниками инфекции являются нижние дыхательные пути, внутрибрюшные инфекции, инфекции мочевых путей и другие, которые включают инфекцию кожи и мягких тканей, костей или суставов, центральной нервной системы, этмоидных и верхнечелюстных пазух. Пирексия из-за неинфекционной этиологии также является распространенной причиной лихорадки у пациентов в ОИТ. Для борьбы с пирексией могут использоваться антипиретики, главным образом парацетамол и нестероидные противовоспалительные препараты, а также физические методы охлаждения. Лечение с помощью жаропонижающих препаратов распространено в ОИТ. Было показано, что исследования жаропонижающей терапии, которые включали как септических, так и несептических пациентов, не обнаружили значительного улучшения 28-дневной госпитальной летальности у взрослых критических пациентов с сепсисом или без него. Дополнительные исследования улучшат понимание патофизиологии пирексии и будут способствовать развитию данного направления.
Elevation of core body temperature is one of the most common abnormal signs in patients admitted to the intensive care unit (ICU) and is associated with increased mortality among some groups of critically ill patients. Elevated body temperature is detected in approximately 50 % of adult patients admitted to the ICU. Elevated body temperature is classified as pyrexia, or hyperthermia. Pyrexia, also referred to as fever, is an adaptive response to a physiologic stress that is regulated through endogenous pyrogenic and antipyretic pathways and is associated with an increase in the hypothalamic set-point. The hyperthermia syndromes include: environmental hyperthermia, and heatstroke as well, drug-induced hyperthermia, neuroleptic malignant syndrome, serotonin syndrome and endocrine causes, in particular thyrotoxicosis, pheochromocytoma and adrenal crisis. Many episodes of pyrexia are due to infections. The most common sources of infection are lower respiratory, intra-abdominal, urinary tract infections and other that include the skin and soft tissue, bone/joints, central nervous system and ethmoid and maxillary sinuses. Pyrexia due to non-infectious origin is also common cause of fever in ICU patients. Antipyretic agents, mainly paracetamol and non-steroidal anti-inflammatory drugs, and physical cooling methods can be used to control pyrexia. Treatment with antipyretic therapies is common in the ICU. Studies of antipyretic therapy that included both septic and non-septic patients did not reveal any significant improvement of 28-day hospital mortality in adult critically ill patients with and without sepsis. Additional studies will improve understanding of pyrexia pathophysiology and will contribute to the development of this direction.
Ключевые слова
пірексія; лихоманка; гіпертермія; антипіретична терапія; огляд
пирексия; лихорадка; гипертермия; антипиретическая терапия; обзор
pyrexia; fever; hyperthermia; antipyretic therapy; review
Лихорадка полезна, как и полезен огонь,
когда он согревает, а не обжигает.
Ф. Висмонт
Актуальность
Еще врачам древности было известно, что повышение температуры тела является одним из признаков многих заболеваний, которые часто называли просто лихорадкой. После того как в 1868 г. немецкий клиницист Wunderlich указал на значение измерения температуры тела, термометрия стала одним из немногих простых методов объективизации и количественной оценки заболевания [1]. Измерение температуры тела рассматривается как часть стандартной оценки состояния взрослых пациентов, поступивших в отделение интенсивной терапии (ОИТ). Повышение температуры тела обнаруживается примерно у 50 % взрослых пациентов, поступивших в ОИТ. У 35 % пациентов в стационаре развивается пирексия, это количество увеличивается до 70 % среди пациентов в критическом состоянии [2–6]. Инфекционный генез лихорадки наблюдается у 74 % госпитализированных пациентов [7].
Определение понятия, терминология, классификация
Термины гипертермия, пирексия, лихорадка часто используются в литературе как аналогичные понятия, но для полного понимания физиологических процессов, наблюдаемых при повышении температуры тела, эти понятия необходимо дифференцировать. Гипертермия — это повышение температуры ядра тела, которое не сопровождается увеличением гипоталамического заданного значения (hypothalamic set-point), наблюдается при тепловом ударе, злокачественной гипертермии, тиреотоксикозе. При пирексии наблюдается увеличение температуры как ядра тела, так и заданной температурной точки гипоталамуса в ответ на множество факторов инфекционной и неинфекционной природы. Понятия пирексии и лихорадки считают тождественными [8, 9]. Абсолютные значения температуры тела и реакция на медикаментозную антипиретическую терапию позволяют нам отличить гипертермию от пирексии у критических пациентов. Температура тела, которая превышает 41 °С и не реагирует на фармакологическую антипиретическую терапию, чаще наблюдается у пациентов с гипертермией. Тогда как более мягкое повышение температуры тела или отчетливый ответ на проведение фармакологической антипиретической терапии указывают на явление пирексии [10].
Гипертермия — это повышение температуры тела, которое происходит без увеличения гипоталамического заданного значения и определяется как температура ядра выше 38,2 °С. Гипертермический синдром включает в себя реакцию на медикаментозные препараты (злокачественная гипертермия, злокачественный нейролептический синдром, серотониновый синдром), эндокринные причины (тиреотоксикоз, феохромоцитома, адреналовый криз), экзогенное воздействие (тепловой удар). Явление пирексии в основном связано с инфекцией, но существуют и неинфекционные причины. Неинфекционный генез пирексии не берут во внимание, за исключением наличия явных симптомов, пока не доказано отсутствие влияния инфекционного агента на возникновение лихорадки. Внегос–питальными причинами неинфекционной пирексии могут быть: синдром Стивенса — Джонсона, венозный тромбоэмболизм, субарахноидальное кровоизлияние, острый панкреатит, системная красная волчанка, нео–пластический синдром, синдром отмены опиоидов. К госпитальным причинам пирексии относят: медикаментозную гипертермию, гемотрансфузионную реакцию, венозный тромбоэмболизм, субарахноидальное кровоизлияние, синдром отмены опиоидов. Пирексию инфекционного генеза разделяют на внегоспитальную и госпитальную в зависимости от сроков появления симптомов — до 48 часов от госпитализации пациента в стационар или после 48 часов [4, 11–14].
Диагностика
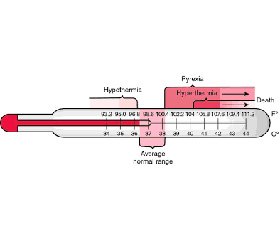
Нормальная температура тела составляет от 36 до 37,5 °C с внутрииндивидуальной изменчивостью 0,5–1 °C в зависимости от времени суток (низкая ранним утром, пик в начале дня/поздний вечер). Пирексия у взрослых пациентов в критическом состоянии определяется как повышение температуры тела до 38,3 °C и выше. Следует учитывать, что температура тела с меньшим значением, но выше 37 °C может также рассматриваться как состояние пирексии у иммуноскомпрометированных пациентов [15, 16]. Гипотермия — это снижение температуры ядра ниже 36 °C. Важность избегания гипотермии в любой стратегии лечения не должна быть занижена [17]. Рекомендации для взрослых критических пациентов предлагают измерять температуру с помощью центрального термометра, который обеспечивает прямое измерение температуры ядра. Центральные термометры включают: катетер легочной артерии, мочевого пузыря, пищевода и ректальные термометры. Периферические термометры: барабанная перепонка, височная артерия, подмышечная впадина, ротовая полость. Систематический обзор и метаанализ показали, что по сравнению с центральными термометрами чувствительность и специфичность термометров для обнаружения лихорадки составила 64 % (95% ДИ 55–72 %) для периферических и 96 % (95% ДИ 93–97 %) для центральных [4, 16, 18]. Контроль температуры безопасен и эффективен при септическом шоке [19].
Патофизиология пирексии. Пирогенная лихорадка является распространенным ответом на сепсис у критических пациентов. Возникновение лихорадки происходит с помощью каскада реакций. При взаимодействии экзогенных пирогенов (например, микроорганизмов) и/или эндогенных (например, IL-1, IL-6, TNF-α) происходит синтез PGE2 посредством активации фермента COX-2 PGE2, который действует через нейроны на центр терморегуляции в гипоталамусе. Увеличивается чувствительность холодовых рецепторов гипоталамуса, что приводит к новому заданному значению повышенной температуры. Активируется механизм теплопродукции и снижается эффективность механизма теплоотдачи. Замедляется скорость обжига тепловых чувствительных нейронов, что приводит к повышению температуры тела. Гомеостатические механизмы поддерживают новое заданное значение. Дополнительные системы обратной связи предотвращают чрезмерное повышение температуры тела через антипиретические цитокины [17, 20–23].
Наличие пирексии не всегда отражается на организме пациента негативно, лихорадка имеет и положительные свойства. Было обнаружено, что температура выше 38,2 °C играет защитную роль при инвазивных грибковых инфекциях в ОИТ. Повышенная температура тела может обеспечить защиту несколькими механизмами. Во-первых, человеческие инфекционные патогены часто демонстрируют оптимальную репликацию при температуре ниже 37 °C, таким образом, температура препятствует их воспроизведению. Во-вторых, повышение температуры in vitro c 35 до 41,5 °C повышает антимикробную активность многих классов антибиотиков. В-третьих, повышение температуры также может быть связано с усиленным ответом врожденного иммунитета для разрушения микроорганизмов [24, 25].
Негативные свойства лихорадки. При температуре выше 40 °C наблюдается увеличение смертности, связанное с тем, что на этой стадии вредные эффекты лихорадки на органы и клеточную функцию превышают любую выгоду, которую получали при контролируемой пирексии в диапазоне 38,3–39,5 °C. У пациентов с острым повреждением головного мозга пирексия может увеличить внутричерепное давление и, как следствие, усугубить вторичное ишемическое повреждение. Пирексия сопровож–дается метаболическими затратами, повышение температуры у пациентов в ОИТ на 1 °C увеличивает потребление кислорода на 10 %. Повышение температуры на 1 °C увеличивает частоту сердечных сокращений (ЧСС) на 10 ударов в 1 минуту, что приводит к ухудшению трофической способности миокарда из-за сокращения времени диастолы [26, 27]. Эндогенные пирогены IL-1, IL-6, TNF-α усиливают катаболизм мышечной ткани, что приводит к снижению массы тела и отрицательному азотистому балансу. При лихорадке снижается секреция желудочного, панкреатического и кишечных соков. Это сопровождается снижением моторики желудка и парезом кишечника. Вследствие данных процессов увеличивается проницаемость слизистой желудочно-кишечного тракта, что увеличивает скорость транслокации абдоминальных патогенов [28].
Гипертермия, пирексия и нозологические формы
Гипертермические синдромы, обычно характеризующиеся резко повышенной температурой тела, подразделяются: на гипертермию вследствие повышения температуры окружающей среды, включая тепловой удар; индуцированную гипертермию, включая злокачественную, нейролептический злокачественный синдром и синдром серотонина; эндокринные причины, включая тиреотоксикоз, фео–хромоцитому и надпочечниковый криз [29].
Тепловой удар определяется клинически как повышение температуры ядра более 40 °C, которое связано с нарушением регуляции температуры тела центральной нервной системой и сопровождается полиорганной недостаточностью. Классический тепловой удар чаще встречается у пожилых, хронически больных и ослабленных людей во время тепловых ванн, где высокая внешняя температура подавляет терморегуляторную способность организма для рассеивания тепла. При физической нагрузке тепловой удар обычно встречается у молодых и здоровых людей, проявляющих сильную физическую активность, когда чрезмерное выделение тепла нарушает обычный тепловой гомеостаз. Осложнения теплового удара включают: рабдомиолиз, диссеминированную внутрисосудистую гиперкоагуляцию, почечную и печеночную недостаточность, тяжелые метаболические расстройства (гипогликемия, лактоацидоз и гиперкалиемия) [30, 31].
Злокачественная гипертермия встречается у пациентов с наследственными мутациями в рианодиновом рецепторе. Характеризуется острым началом, ригидностью мышц, гипертермией и ацидозом в ответ на воздействие ингаляционных анестетиков или деполяризующих миорелаксантов. Нейролептический злокачественный синдром характеризуется быстрым началом, ригидностью мышц, гипертермией и изменениями психического статуса, которые возникают из-за введения антагонистов центрального действия допамина, обычно типичных или атипичных антипсихотиков, но также могут включать противотошнотные препараты, такие как метоклопрамид [32, 33].
Синдром серотонина представляет собой быстрое развитие гипертермии и других признаков вегетативной нестабильности, включая тахикардию, мидриаз и потоотделение, а также когнитивные и нервно-мышечные изменения, которые могут включать тремор, гиперрефлексию и клонус у пациентов с избыточным центральным и периферическим серотонинергическим агонизмом. Как правило, синдром серотонина развивается после преднамеренного употребления препаратов, содержащих серотонинергические агенты (терапевтическое или нецелевое использование), но может также возникать во время терапии другими лекарственными препаратами (включая антибиотикотерапию линезолидом), также возможно непреднамеренное взаимодействие лекарственных средств [34].
Эндокринные неотложные состояния иногда сопровождаются гипертермией. Нередко она наблюдается при феохромоцитоме и надпочечниковом кризе, является симптомом тяжелого тиреотоксикоза и одним из диагностических признаков тиреотоксического криза [35, 36].
Лихорадка при черепно-мозговой травме (ЧМТ) наблюдается более чем у 70 % пациентов и более чем у 50 % пациентов с субарахноидальным кровоизлиянием (САК). В данном случае повышение температуры тела связано с неврологическим повреждением, а не с инфекцией. Было доказано, что смертность после инсульта увеличивается при температуре выше 37,9 °C и выше 38 °C после ЧМТ. Гипертермия способна вызвать когнитивные нарушения, которые могут сохраняться длительное время или стать постоянными. Системные эффекты гипертермии: нарушение гематоэнцефалического барьера и развитие отека головного мозга; нарушение церебрального кровотока и обмена веществ; увеличение проницаемости слизистой желудочно-кишечного тракта, что повышает скорость транслокации абдоминальных патогенов [28, 37].
При сепсисе лихорадка не оказывает негативного влияния и может быть защитной. Пирексия усиливает воспаление, но уменьшает бактериальную и вирусную нагрузку. Этот двойной эффект был выделен у животных с пневмонией и показывает, что лечение пирексии выгодно для выживания только тогда, когда антибиотики позволяют эффективно контролировать бактериальную нагрузку [38]. У пациентов с сепсисом жаропонижающая терапия не снижает 28-суточную летальность. Антипиретическая терапия снижает температуру тела, но не сопровождается снижением пульса или минутной вентиляции [7].
Антипиретическая терапия
Несмотря на отсутствие доказательств, свидетельствующих о преимуществах жаропонижающей терапии, лечение лихорадки является обязательным в ОИТ. Сторонники лечения лихорадки утверждают, что основным преимуществом антипиретической терапии у критически больных пациентов является снижение метаболической нагрузки, обычно связанной с повышенной температурой тела [39].
Пирексия сопровождается метаболическими затратами, так что охлаждение лихорадящих пациентов в ОИТ уменьшает потребление кислорода на 10 % на 1 °C. Небольшие исследования среди седированных пациентов продемонстрировали значительное снижение VO2 (скорость потребления кислорода) и VCO2 (скорость удаления углекислого газа) во время охлаждения. При септическом шоке снижение температуры с помощью ибупрофена было связано с увеличением лактатного клиренса. Физические методы охлаждения являются безопасными и эффективными при септическом шоке. У пациентов с острым повреждением головного мозга пирексия может повысить внутричерепное давление и увеличить вторичное ишемическое повреждение [39, 41].
Методы лечения пирексии. Нефармакологическая терапия: воздушно-циркулирующие одеяла; водоохлаждаемые одеяла; водоохлаждаемые прокладки с гидрогелем; эндоваскулярные охлаждающие устройства. Фармакологическая терапия: ацетаминофен; нестероидные противовоспалительные препараты (НПВП) [42, 43].
Парацетамол является наиболее часто применяемым антипиретическим средством в клинической практике. У пациентов с ЧМТ стандартная доза (3 г/день) парацетамола часто является неэффективной. Это оправдывает увеличение дозы до 6 г/день, то есть выше рекомендуемой максимальной суточной дозы 4 г. Показано, что эта более высокая доза снижает температуру тела на 0,8 °C в течение 4 часов по сравнению с плацебо. В исследовании «PAIS» парацетамол 6 г/день, вводимый энтеральным путем у пациентов с инсультом, обеспечивал болшее снижение средней температуры тела, чем плацебо. Эта разница была ограничена 0,86 °C (95% ДИ 0,85–0,89) в течение 24 часов [44].
Сочетание 1 г парацетамола и 800 мг ибупрофена испытывали на его способность контролировать лихорадку у 79 неврологических пациентов в ОИТ. Наблюдалось значительное снижение температуры у группы с комбинированным лечением по сравнению с пациентами, получавшими только парацетамол. В исследовании «HEAT», проведенном при сепсисе, эффективность внутривенного парацетамола 4 г/день была разочаровывающей по сравнению с плацебо. Отрицательный результат этого исследования можно объяснить недостаточной разницей температур [45, 46].
НПВП регулярно используются в ОИТ, несмотря на отсутствие адекватной оценки их безопасности. НПВП имеют хорошо известный профиль побочных эффектов, включая гипотензию, нарушения функции печени и почек, удержание натрия и воды, желудочно-кишечные кровотечения и дисфункцию тромбоцитов. В попытке избежать некоторых из этих эффектов была предложена низкая доза непрерывной инфузии диклофенака. Наблюдалось меньшее количество эпизодов пирексии по сравнению со стандартной дозой для болюсного введения [47].
У пациентов с сепсисом контроль лихорадки при поверхностном охлаждении является более эффективным, чем применение антипиретиков. Применение НПВП должно быть ограниченно при сепсисе до тех пор, пока не будет оценена безопасность их использования в связи с риском ухудшения течения тяжелых инфекций [48].
Выводы
1. Антипиретическое лечение значительно не улучшает 28-дневную/госпитальную летальность у взрослых пациентов с сепсисом.
2. Не существует идеального антипиретического средства для лечения лихорадки.
3. Контроль температуры безопасен и эффективен при септическом шоке.
4. Лечение пирексии является полезным при черепно-мозговой травме.
5. Гипертермия при остром повреждении мозга ухудшает исход.
6. Один эпизод гипертермии может вызвать кратко–временную неврологическую и когнитивную дисфункцию, которая может быть продолжительной или стать постоянной.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Walter E.G. The neurological and cognitive consequences of hyperthermia / E.G. Walter, M. Carraretto // Critical Care. — 2016. — № 20. — 199. doi: 10.1186/s13054-016-1376-4.
2. Loke A.Y. Comparing the effectiveness of two types ofcooling blankets for febrile patients / A.Y. Loke, H.C. Chan, T. Chan // Nurs. Crit. Care. — 2005. — № 10 (5). — P. 247-254.
3. Young P.J. Fever management in intensive care patients with infections / P.J. Young, M. Saxena // Crit. Care. — 2014. — № 18. — 206.
4. Niven D.J. Accuracy of peripheral thermometers for estimating temperature: a systematic review and meta-analysis / D.J. Niven, J.E. Gaudet, K.B. Laupland, K.J. Mrklas, D.J. Ro–berts, H.T. Stelfox // Ann. Intern. Med. — 2015. — № 163 (10). — P. 768-777.
5. Laupland K.B. Fever in the critically ill medical patient / K.B. Laupland // Crit. Care Med. — 2009. — № 37 (7). — P. 273-280.
6. B. Circiumaru. A prospective study of fever in the intensive care unit / B. Circiumaru, G. Baldock, J. Cohen // Intensive Care Med. — 2009. — № 25 (7). — P. 668-673.
7. Drewry A.M. Antipyretic Therapy in Critically Ill Septic Patients: A Systematic Review and Meta-Analysis / A.M. Drewry, E.A. Ablordeppey, E.T. Murray, S.R. Izadi et al. // Critical
Care Medicine. — 2017. — № 45 (5). — P. 806-813. doi: 10.1097/CCM.0000000000002285.
8. Hocker S.E. Indicators of central fever in the neurologic intensive care unit / S.E. Hocker, L. Tian, G. Li, J.M. Steckelberg et al. // JAMA Neurol. — 2013. — № 70. — Р. 1499-1504.
9. Daniel J. Pyrexia: aetiology in the ICU / J. Daniel, D. Niven, B. Kevin, K.B. Laupland // Critical Care. — 2016. — № 20. — 247. doi: 10.1186/s13054-016-1406-2.
10. Niven D.J. Fever in the critically ill: a review of epidemiology, immunology, and management / D.J. Niven, C. Leger, H.T. Stelfox, K.B. Laupland // J. Intensive Care Med. — 2012. — № 27. — P. 299-306.
11. Niven D. Diagnosis and management of temperature abnormality in icus: a Eurobact Investigators Survey / D. Niven, K. Laupland, A. Tabah, A. Vesin, J. Rello, D. Koulenti et al. // Crit. Care. — 2013. — № 17. — R289.
12. Tenner A.G. Endocrine causes of dangerous fever / A.G. Tenner, K.M. Halvorson // Emerg Med. Clin. North Am. — 2013. — № 31. — P. 969-986.
13. Bouchama A. Prognostic factors in heat wave related deaths: a meta-analysis / A. Bouchama, M. Dehbi, G. Mohamed, F. Matthies, M. Shoukri, B. Menne // Arch. Intern. Med. — 2007. — № 167. — P. 2170-2176.
14. Boyer E.W. The serotonin syndrome / E.W. Boyer, M.N. Shannon // Engl. J. Med. — 2005. — № 352. — P. 1112-1120.
15. O'grady N.P. Guidelines for evaluation of new fever in critically ill adult patients: 2008 update from the American College of Critical Care Medicine and the Infectious Diseases Socie–ty of America / N.P. O'grady P.S. Barie, J.G. Bartlett, T. Bleck, K. Carroll, A.C. Kalil et al. // Crit. Care Med. — 2008. — № 36. — P. 1330-1349.
16. Gazendam J.A. Altered circadian rhythmicity in patients in the ICU / J.A. Gazendam, H.P. Van Dongen, D.A. Grant, N.S. Freedman, J.H. Zwaveling, R.J. Schwab // Chest. — 2013. — № 144 (2). — P. 483-490.
17. Walter E.G. The pathophysiological basis and consequences of fever / E.J. Walter, H.J. Sameer, M. Carraretto, L. Forni // Critical. Care. — 2016. — № 20. — 200. doi: 10.1186/s13054-016-1375-5.
18. Laupland K.B. Fever in the critically ill medical patient / K.B. Laupland // Crit. Care Med. — 2009. — № 37. — S273-8.
19. Doyle J. F. Should we treat pyrexia? And how do we do it? / J.F. Doyle, F. Schortgen // Critical. Care. — 2016. — № 20. — 303. doi: 10.1186/s13054-016-1467-2.
20. Sanchez-Alavez M. Ceramide mediates the rapid phase of febrile response to IL-1β / M. Sanchez-Alavez, I.V. Taba–rean, M.M. Behrens, T. Bartfai // Proc. Natl. Acad. Sci USA. — 2006. — № 103 (8). — P. 2904-2908.
21. Gross L. Anatomy of a Fever / L. Gross // PLoS Biol. — 2006. — № 4 (9). — e305.
22. Launey Y. Clinical review: Fever in septic ICU patients — friend or foe? / Y. Launey, N. Nesseler, Y. Mallédant, P. Seguin // Crit. Care. — 2011. — № 15. — 222.
23. Young P.J. Early peak temperature and mortality in critically ill patients with or without infection / P.J. Young, M. Saxena, R. Beasley et al. // Intensive Care Med. — 2012. — № 38. — P. 437-444.
24. Leroy O. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005–2006) / O. Leroy, J. Gangneux, P. Montravers, J. Mira, F. Gouin, J. Sollet et al. // Crit. Care Med. — 2009. — № 37. — P. 1612-1618.
25. Rice P. Febrile-range hyperthermia augments neutrophil accumulation and enhances lung injury in experimental Gram negative bacterial pneumonia // P. Rice, E. Martin, J. He, M. Frank, L. DeTolla, L. Hester et al. // J. Immunol. — 2005. — № 174. — P. 3676-3685.
26. Fernandez A. Fever after subarachnoid hemorrhage: risk factors and impact on outcome / A. Fernandez, J.M. Schmidt, J. Claassen et al. // Neurology. — 2007. — № 68 (13). — P. 1013-1019.
27. Sacho R.H. The effect of spontaneous alterations in brain temperature on outcome: a prospective observational cohort study in patients with severe traumatic brain injury / R.H. Sacho, A. Vail, T. Rainey, A.T. King, C.J Childs // Neurotrauma. — 2010. — № 27 (12). — P. 2157-2164.
28. Lambert G.P. Role of gastrointestinal permeability in exertional heatstroke / G.P. Lambert // Exerc. Sport Sci Rev. — 2004. — № 32. — P. 185-190.
29. Slettedal J.K. Brain pathology in fatal serotonin syndrome: presentation of two cases / J.K. Slettedal, D.O. Nilssen, M. Magelssen et al. // Neuropathology. — 2011. — № 31. — P. 265-270.
30. Walter E.J. Exertional heat stroke — the athlete’s ne–mesis / E.J. Walter, R. Venn, T. Stevenson // JICS. — 2012. — № 13. — P. 304-308.
31. Protasi F. Calsequestrin-1: a new candidate gene for malignant hyperthermia and exertionl/environmental heat stroke / F. Protasi, C. Paolini, M. Dainese // J. Physiol. — 2009. — № 587. — P. 3095-3100.
32. Rosebush P.I. Neuroleptic malignant syndrome and the acute phase response / P.I. Rosebush, R.E. Anglin, C. Richards et al. // J. Clin. Psychopharmacol. — 2008. — № 28. — P. 459-461.
33. Anglin R.E. Neuroleptic malignant syndrome: a neuroimmunologic hypothesis / R.E. Anglin, P.I. Rosebush, M.F. Mazurek // CMAJ. — 2010. — № 182 (18). — P. 834-838.
34. Walter E.J. Drug-induced hyperthermia in critical care / E.J. Walter, M. Carraretto // JICS. — 2015. — № 16 (4). — P. 306-311.
35. Akamizu T. Diagnostic criteria, clinical features, — and incidence of thyroid storm based on nationwide surveys / T. Akamizu, Satoh, O. Isozaki et al. // Thyroid. — 2012. — № 22. — P. 661-679.
36. Alvarez-Crespo M. Essential role of UCP1 modulating the central effects of thyroid hormones on energy balance / M. Alvarez-Crespo, R.I. Csikasz, N. Martínez-Sánchez, C. Diéguez, B. Cannon, J. Nedergaard // Mol. Metab. — 2016. — № 5. — P. 271-282.
37. Kiyatkin E.A. Permeability of the blood-brain barrier depends on brain temperature / E.A. Kiyatkin, H.S. Sharma // Neuroscience. — 2009. — № 161 (3). — P. 926-939.
38. Rice P. Febrile-range hyperthermia augments neutrophil accumulation and enhances lung injury in experimental gram-negative bacterial pneumonia / P. Rice, E. Martin, J.R. He, M. Frank, L. Hester et al. // J. Immunol. — 2005. — № 174 (6). — P. 3676-3685.
39. Badjatia N. Hyperthermia and fever control in brain injury / N. Badjatia, E. Strongilis, M. Prescutti, L.Fernandez et al. // Crit. Care Med. — 2009. — № 37 (7). — P. 250-257.
40. Schmidt J.M. Metabolic benefits of surface counter war–ming during therapeutic temperature modulation / J.M. Schmidt, S.A. Ma–yer // Crit. Care Med. — 2009. — № 37 (6). — P. 1893-1897.
41. Shah N.G.Nonpharmacologic approach to minimi–zing shivering during surface cooling: a proof of principle study / N.G. Shah, M.J. Cowan, E. Pickering, H. Sareh, M. Afshar et al. // J. Crit. Care. — 2012. — № 27 (6). — 746.e741-748.
42. Polderman K.H. How to stay cool in the intensive care unit? Endovascular versus surface cooling. / K.H. Polderman // Circulation. — 2015. — № 132 (3). — P. 152-157.
43. Polderman K.H. Therapeutic hypothermia and controlled normothermia in the intensive care unit: practical considerations, side effects, and cooling methods / K.H. Polderman, I. Herold // Crit. Care Med. — 2009. — № 37 (3). — P. 1101-1120.
44. Den Hertog H.M. The Paracetamol (Acetaminophen) In Stroke (PAIS) trial: a multicentre, randomised, placebo-controlled, phase III trial / H.M. den Hertog, H.B. van der Worp, H.M. van Gemert, A. Algra, L.J. Kappelle et al. // Lancet Neurol. — 2009. — № 8 (5). — P. 434-440.
45. Young P. Acetaminophen for fever in critically ill patients with suspected infection / P. Young, M. Saxena, R. Bellomo, R. Freebairn, N. Hammond et al. // N. Engl. J. Med. — 2015. — № 373 (23). — P. 2215-2224.
46. Janz D.R. Randomized, placebo-controlled trial of aceta–minophen for the reduction of oxidative injury in severe sepsis: the Acetaminophen for the Reduction of Oxidative Injury in Severe Sepsis trial / D.R. Janz, J.A. Bastarache, T.W. Rice, G.R. Bernard et al. // Crit. Care Med. — 2015. — № 43 (3). — P. 534-541.
47. Cormio M. Continuous low dose diclofenac sodium infusion to control fever in neurosurgical critical care / M. Cormio, G. Citerio // Neurocrit. Care. — 2007. — № 6 (2). — P. 82-89.
48. Hoedemaekers C.W. Comparison of cooling methods to induce and maintain normo- and hypothermia in intensive care unit patients: a prospective intervention study / C.W. Hoedemaekers, M. Ezzahti, A. Gerritsen, J.G. van der Hoeven // Crit. Care. — 2007. — № 11 (4). — R91.