Резюме
Мета даного дослідження — вивчення ефективності контрольованої нормотермії в комплексі інтенсивної терапії у пацієнтів з черепно-мозковою травмою (ЧМТ), ускладненою розвитком гіпертермії центрального генезу, рефрактерною до фармакологічної терапії, та оцінка її впливу на фактори, що опосередковано визначають реологічні властивості крові. Матеріали та методи. У дослідження було включено 80 пацієнтів віком від 20 до 64 років (середній вік 41,05 ± 2,90 року), які перебували на лікуванні у відділенні інтенсивної терапії з діагнозом «тяжка черепно-мозкова травма», з розвитком стійкої гіпертермії > 38,3 °С, що була рефрактерною до фармакологічної терапії антипіретиками. Пацієнти були розділені на 2 групи: I (n = 40) — з проведенням контрольованої нормотермії з цільовим значенням температури тіла 37 °С за допомогою гіпотерма Blanketrol II; II група (n = 40) — пацієнти з гіпертермією > 38,3 °С обстежувалися ретроспективно, лікування гіпертермії проводилося шляхом обкладення тіла пакетами з льодом в проекціях проходження магістральних судин. Результати. Було виявлено вірогідне збільшення рівня фібриногену на етапі розвитку гіпертермії в I групі пацієнтів з 2,92 ± 0,64 до 5,24 ± 1,37 г/л (Р = 0,00001), у II групі — з 2,99 ± 0,67 до 5,32 ± 2,06 г/л (Р = 0,00006) порівняно з вихідним рівнем. У пацієнтів I групи при проведенні контрольованої нормотермії виявлено зниження рівня фібриногену, який на етапі 48 годин вірогідно не відрізнявся від початкового рівня (Р = 0,47). Навпаки, у пацієнтів II групи на всіх етапах відзначалося підвищення рівня фібриногену, та на етапі 48 годин збільшення даного показника порівняно з вихідним рівнем носило вірогідний характер (Р = 0,00015). Відмінності за рівнем фібриногену на етапі 48 годин спостереження між групами пацієнтів також були вірогідними (p < 0,05). Висновки. Контрольована нормотермія нормалізує рівень фібриногену до вихідних значень, що опосередковано може свідчити про поліпшення реологічних властивостей крові і, відповідно, системної мікроциркуляції при тяжкій ЧМТ.
Цель данного исследования — изучение эффективности контролируемой нормотермии в комплексе интенсивной терапии у пациентов с черепно-мозговой травмой (ЧМТ), осложненной развитием гипертермии центрального генеза, рефрактерной к фармакологической терапии, и оценка ее влияния на факторы, опосредованно определяющие реологические свойства крови. Материалы и методы. В исследование было включено 80 пациентов в возрасте от 20 до 64 лет (средний возраст 41,05 ± 2,90 года), находившихся на лечении в отделении интенсивной терапии с диагнозом «тяжелая черепно-мозговая травма», с развитием стойкой гипертермии > 38,3 °С, рефрактерной к фармакологической терапии антипиретиками. Пациенты были разделены на 2 группы: I (n = 40) — с проведением контролируемой нормотермии с целевым значением температуры тела 37 °С при помощи гипотерма Blanketrol II; II группа (n = 40) — пациенты с гипертермией > 38,3 °С изучались ретроспективно, лечение гипертермии у них включало обкладывание тела пакетами со льдом в проекциях прохождения магистральных сосудов. Результаты. Было выявлено достоверное увеличение уровня фибриногена на этапе развития гипертермии в I группе пациентов с 2,92 ± 0,64 до 5,24 ± 1,37 г/л (Р = 0,00001), во II группе — с 2,99 ± 0,67 до 5,32 ± 2,06 г/л (Р = 0,00006) по сравнению с исходным уровнем. У пациентов I группы при проведении контролируемой нормотермии выявлено снижение уровня фибриногена, который на этапе 48 часов достоверно не отличался от исходного уровня (Р = 0,47). Напротив, у пациентов II группы на всех этапах отмечалось повышение уровня фибриногена, и на этапе 48 часов увеличение данного показателя по сравнению с исходным уровнем носило достоверный характер (Р = 0,00015). Различия по уровню фибриногена на этапе 48 часов наблюдения между группами пациентов также были достоверными (p < 0,05). Выводы. Контролируемая нормотермия нормализует уровень фибриногена до исходных значений, что опосредованно может свидетельствовать об улучшении реологических свойств крови и, соответственно, системной микроциркуляции при тяжелой ЧМТ.
Background. The objective was to study the effectiveness of controlled normothermia in the intensive care of patients with severe traumatic brain injury (TBI) complicated by central hyperthermia refractory to pharmacological therapy, to evaluate its influence on the factors that indirectly determine the rheological properties of the blood. Materials and methods. Eighty patients were divided into 2 groups. Group I (n = 40) — individuals with hyperthermia > 38.3 to 39.5 °C refractory to pharmacological therapy with antipyretics; controlled normothermia was achieved by means of Blanketrol II. With the development of hyperthermia > 39.5 °C, the induction of cooling was primarily carried out by the fastest infusion of 4% Ringer’s lactate solution in a dose of 20–23 ml/kg of body weight through the central vein, followed by maintenance of controlled normothermia with Blanketrol II. Controlled normothermia was performed with a target temperature of the body corresponding to 37 °C. Group II (n = 40) — patients with hyperthermia > 38.3 °C without using technology of controlled normothermia, they were retrospectively examined, hyperthermia was suppressed in them by pharmacological antipyretic therapy, ice packs in the projections of the main vessels. Patients of both groups were mechanically ventilated. Results. Despite development of severe hyperthermia in both groups of patients, there was no significant increase in leukocyte count at all stages of the study, which was indicative of the central origin of hyperthermia syndrome in patients with severe TBI. There was a significant increase in fibrinogen content from 2.92 ± 0.64 g/l to 5.24 ± 1.37 g/l (P = 0.00001) at the stage of hyperthermia in group I and from 2.99 ± 0.67 g/l to 5.32 ± 2.06 g/l (P = 0.00006) in group II of patients compared with baseline. In patients of group I, under controlled normothermia, a decrease in the level of fibrinogen was revealed, which did not differ significantly from the baseline at the stage of 48 hours (P = 0.47). In contrast, patients in group II showed an increase in fibrinogen content, and by 48 hours, an increase in this index compared to the baseline was significant (P = 0.00015). Differences in the level of fibrinogen at the stage of 48 hours of observation between groups of patients were also significant (p < 0.05). Conclusions. Controlled normothermia normalizes the level of fibrinogen to the initial values, which indirectly may indicate improvement of rheological properties of the blood and, accordingly, systemic microcirculation in severe TBI.
Введение
Развитие гипертермии, под которой понимают повышение температуры тела ≥ 38,3 °C, является наиболее распространенным синдромом при травматическом и нетравматическом повреждении головного мозга. Так, при черепно-мозговой травме (ЧМТ) гипертермия имеет место у более чем 70 % пациентов [1] и более чем 50 % пациентов с субарахноидальным кровоизлиянием (САК) [2]. Сообщается, что развитие лихорадки ассоциируется с плохим исходом в виде повышения уровня инвалидизации и смертности как после инсульта [3], так и после САК [4]. При этом неблагоприятные эффекты возникают уже при повышении температуры мозга всего на 1 °C, что, как показали исследования, может критически влиять на степень вторичного повреждения головного мозга после первичного повреждения [3]. Температура ≥ 37,5 °С на момент поступления в отделение реанимации и интенсивной терапии (ОРИТ) ассоциирована с тенденцией к плохому неврологическому исходу, и достоверное ухудшение неврологического статуса отмечается при температуре выше 38,5 °С.
Это обусловлено тем, что центральная нервная система уязвима при гипертермии, особенно при длительной или чрезмерной. Только при сепсисе существует вероятность того, что повышение температуры может обеспечить повышение уровня выживаемости, однако температура выше 40 °C ассоциирована с ухудшением исходов [5].
Тепловой стресс может приводить к некрозу или апоптозу клеток. Гибель клеток, в зависимости от их типа, развивается при температуре > 40–41 °С и увеличивается в геометрической прогрессии при удлинении времени воздействия температуры. Риск апоптоза, по-видимому, выше в развивающихся клетках, чем в уже сформированных клетках взрослого головного мозга, и может стать только угрозой развития при значимо высоких температурах. Каспаз-опосредованная гибель клеток может быть стимулирована целым рядом механизмов, и напротив, ингибиторы каспаз продлевают выживаемость нейронов после теплового стресса. К системным эффектам гипертермии относят проницаемость гематоэнцефалического барьера (ГЭБ), которая является температурно зависимой. Так, было отмечено значительное увеличение транспорта веществ при температуре > 38–39 °С с дальнейшим прогрессивным усилением проницаемости ГЭБ при повышении температуры выше указанного уровня [6].
Одним из факторов, влияющих на течение травматического повреждения головного мозга, является состояние микроциркуляции, которая, в свою очередь, зависит от реологического состояния крови. Основным фактором, определяющим рео–логические свойства крови как неньютоновской жидкости, является ее вязкость. Вязкость крови обу–словливают: уровень гематокрита и гемоглобина, белковый состав плазмы крови, клеточный состав крови, включая деформируемость и агрегируемость эритроцитов, агрегационную способность тромбоцитов, а также лейко–цитарную адгезивность [7].
Основным плазменным белком, обусловливающим повышение вязкости крови, является фибриноген, на втором месте стоят протеины (прежде всего при развитии гипериммуноглобулинемии), в то время как альбумин оказывает минимальное влияние на вязкость крови. Выраженность лейкоцитоза прямо пропорционально связана с повышением вязкости крови [7, 8].
Целью данного исследования явилось изучение эффективности контролируемой нормотермии в комплексе интенсивной терапии у пациентов с ЧМТ, осложненной развитием гипертермии центрального генеза, рефрактерной к фармакологической терапии, и оценка ее влияния на факторы, опосредованно определяющие реологические свойства крови.
Материалы и методы
Было обследовано 80 пациентов в возрасте от 20 до 64 лет (средний возраст 41,05 ± 12,90 года) с диагнозом «тяжелая черепно-мозговая травма», которым проводилась интенсивная терапия в ОРИТ политравмы КУ «Днепропетровская областная клиническая больница им. И.И. Мечникова».
Пациенты были разделены на 2 группы. Первая группа (n = 40) — данным пациентам осуществлялась контролируемая нормотермия c использованием неинвазивной технологии охлаждения с помощью гипотерма Blanketrol II (CSZ). Гипотерм конструктивно имеет одеяло, располагающееся над пациентом или под ним, в котором циркулирует охлажденная вода. Он автоматически обеспечивает достижение и поддержание целевой температуры путем обратной связи, а также осуществляет динамический мониторинг температуры тела пациента (поверхностной или ядра), воды в одеяле и заданных параметров. Показанием к применению данного варианта контролируемой нормотермии было развитие гипертермии от > 38,3 до 39,5 °С, которая не поддавалась фармакологической коррекции антипиретиками.
В случае развития гипертермии > 39,5 °С исходно проводилась индукция охлаждения капельной максимально быстрой инфузией 4 °С раствора Рингера лактата в дозе 20–23 мл/кг массы тела через центральную вену с последующим поддержанием контролируемой нормотермии гипотермом Blanketrol II.
Контролируемая нормотермия проводилась с целевым значением температуры тела, соответствующей 37 °С.
Вторая группа (n = 40) — пациенты с гипертермией > 38,3 °С без использования технологии контролируемой нормотермии. Обследование было проведено ретроспективно, гипертермия купировалась обкладыванием тела пакетами со льдом в проекциях прохождения магистральных сосудов.
В исследование не включались пациенты, которые имели на момент его начала неврологический дефицит ≤ 4 баллов по шкале комы Глазго. Указанные группы были репрезентативными по основным клиническим и половозрастным характеристикам (табл. 1).
Показаниями к применению контролируемой нормотермии выступали фебрильные и гектическая лихорадки неинфекционного генеза у пациентов с ЧМТ. Противопоказаниями к использованию комбинации охлаждения гипотермом и инфузии 4 °С кристаллоидов являлись кардиогенный шок и все состояния, при которых опасно проводить волемическую нагрузку большими объемами инфузионных растворов (тяжелая сердечная недостаточность и т.д.).
Пациентам всех групп проводилась механическая вентиляция легких через эндотрахеальную трубку или трахеостомическую канюлю. Непрерывно мониторировалась поверхностная температура тела при помощи кардиомонитора. При проведении контролируемой нормотермии поверхностная температура тела измерялась посредством датчика, подключенного к гипотерму Blanketrol II. Для контроля периодически измерялась тимпанитная температура при помощи инфракрасного термометра (Omron).
Всем пациентам анализировали уровень температуры тела (учитывалось максимальное значение показателя за сутки), гематокрита, содержания лейкоцитов и тромбоцитов крови, уровень фибриногена на следующих этапах: исходно в первые сутки поступления в ОРИТ, на момент развития рефрактерной к фармакологической антипиретической терапии гипертермии > 38,3 °С (длительностью минимум 4 ч/сут), 24 и 48 часов с момента развития стойкой гипертермии.
Статистическую обработку результатов ис–следования проводили с использованием табличного процессора LibreOffice.org (версия 5.3.5.1.) и статистических онлайн-калькуляторов (http://www.socscistatistics.com).
Результаты и обсуждение
При анализе демографических данных было выявлено, что группы пациентов были репрезентативными (табл. 1). У пациентов обеих групп не было выявлено достоверных различий исходного уровня неврологического дефицита и средних значений температуры тела при развитии гипертермии.
При анализе динамики температуры в I группе пациентов было отмечено ее повышение на 5,3 % (Р = 0,38) по сравнению с исходным уровнем и последующее ее снижение на фоне проводимого лечебного охлаждения на 4,06 % (Р = 0,49) на этапе 24 ч и на 4,6 % (Р = 0,42) на этапе 48 ч наблюдения по сравнению с этапом развития стойкой гипертермии (табл. 2). Во II группе пациентов отмеченное повышение температуры на 5,4 % по сравнению с исходным уровнем (Р = 0,30) сохранялось на этапе как 24, так и 48 часов. При анализе динамики температуры тела на этапах исследования между группами не было выявлено достоверных различий.
Снижение уровня гематокрита на исходном этапе с момента поступления пациентов в ОРИТ — на 18,2 и 11,8 % в I и II группах пациентов соответственно по сравнению с этапом развития гипертермии, объяснялось кровопотерей как в остром периоде после получения ЧМТ, так и в интраоперационном периоде при проведении нейрохирургических вмешательств у ряда пациентов. Последующее увеличение данного показателя обусловлено восполнением дефицита глобулярного объема, причем указанные изменения не носили достоверного характера. Аналогичная динамика была выявлена по уровню гематокрита и на остальных этапах в обеих группах пациентов. Таким образом, изменения гематокрита не носили достоверного характера на этапах исследования в обеих группах пациентов, как и между группами исследования.
При анализе содержания лейкоцитов в крови выявлена тенденция к увеличению данного показателя по сравнению с исходным уровнем на 2,5 % (Р = 0,37) и 0,6 % (Р = 0,29) в I и II группах пациентов соответственно. При этом, несмотря на развитие выраженной гипертермии в обеих группах пациентов, не было выявлено достоверного увеличения содержания лейкоцитов на всех этапах исследования. Таким образом, отсутствие достоверного нарастания лейкоцитоза на указанных этапах исследования свидетельствует в пользу центрального генеза развития гипертермического синдрома у пациентов с тяжелой ЧМТ.
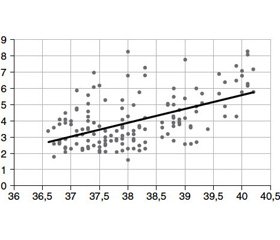
Напротив, анализ изменений уровня фибриногена выявил достоверное его увеличение на этапе развития гипертермии на 44,3 % (Р = 0,00001) в I и на 47,8 % (Р = 0,00006) — во II группе пациентов. На рис. 1 представлена прямо пропорциональная корреляция между температурой тела и уровнем фибриногена. Необходимо отметить, что у пациентов I группы при осуществлении контролируемой нормотермии отмечено снижение уровня фибриногена, который на этапе 48 часов достоверно не отличался от исходного уровня (Р = 0,47). Таким образом, нормализация температурного гомеостаза у пациентов данной группы исследования обеспечивала возврат к исходным значениям уровня фибриногена. Напротив, у пациентов II группы отмечалось повышение уровня фибриногена также и на этапе 48 часов наблюдения, при этом увеличение данного показателя по сравнению с исходным уровнем продолжало носить достоверный характер (Р = 0,00015). Различия по уровню фибриногена на этапе 48 часов наблюдения между группами обследованных пациентов также были достоверными (p < 0,05).
/141-1.jpg)
Проведенное исследование уровня тромбоцитов не выявило достоверных различий как на этапах исследования у пациентов в обеих группах, так и между группами обследованных пациентов.
Ограничениями данного исследования являются малая выборка пациентов и гетерогенность травматического повреждения головного мозга, что требует проведения дополнительных исследований.
Таким образом, продолжая цикл исследований, посвященный влиянию состояния температурного гомеостаза на течение тяжелой ЧМТ, полученные нами результаты дополняют ранее полученные сведения об эффективности использования в комплексе интенсивной терапии технологии контролируемой нормотермии [6]. Проведенное исследование показало, что при развитии длительного гипертермического синдрома отсутствуют достоверные изменения уровня гематокрита, содержания лейкоцитов и тромбоцитов — факторов, которые определяют реологические свойства крови. Напротив, была выявлена сильная корреляция между повышением температуры тела и увеличением уровня фибриногена. Использование вышеописанной технологии, обеспечивающей возвращение и последующее поддержание нормотермии тела, обеспечивает также нормализацию уровня фибриногена до исходных значений, что опосредованно может свидетельствовать о нормализации реологических свойств крови и, соответственно, системной микроциркуляции, таким образом, потенциально влиять на исходы лечения тяжелой ЧМТ.
Выводы
1. Несмотря на развитие выраженной гипертермии в обеих группах пациентов, не было выявлено достоверного увеличения содержания лейкоцитов на всех этапах исследования, что свидетельствовало в пользу центрального генеза гипертермического синдрома у пациентов с тяжелой ЧМТ.
2. Выявлено достоверное увеличение фибриногена на этапе развития гипертермии в I группе пациентов с 2,92 ± 0,64 до 5,24 ± 1,37 г/л (Р = 0,00001), во II группе — с 2,99 ± 0,67 до 5,32 ± 2,06 г/л (Р = 0,00006) по сравнению с исходным уровнем.
3. У пациентов I группы при проведении контролируемой нормотермии выявлено снижение уровня фибриногена, который на этапе 48 часов достоверно не отличался от исходного уровня (Р = 0,47). Напротив, у пациентов II группы на всех этапах отмечалось повышение уровня фибриногена, и на этапе 48 часов увеличение данного показателя по сравнению с исходным уровнем носило достоверный характер (Р = 0,00015). Различия по уровню фибриногена на этапе 48 часов наблюдения между группами пациентов также были достоверными (p < 0,05).
4. Контролируемая нормотермия обеспечивает нормализацию уровня фибриногена до исходных значений, что опосредованно может свидетельствовать об улучшении реологических свойств крови и, соответственно, системной микроциркуляции при тяжелой ЧМТ.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/140-1.jpg)
/141-1.jpg)