Спинальная амиотрофия, или спинальная мышечная атрофия (СМА) Верднига — Гоффмана, — это наследственная патология, связанная с «поломкой» в генетическом аппарате на уровне локуса 5q13 5-й хромосомы. Ген, в котором происходят мутации, получил название survival motor neuron gene (SMN) — «ген, ответственный за выживание мотонейронов». У 95 % пациентов с болезнью Верднига — Гоффмана отмечается делеция теломерной копии этого гена [1].
Тяжесть СМА прямо коррелирует с протяженностью участка делеции и сопутствующим наличием изменений (рекомбинации) в генах H4F5, NAIP, GTF2H2. Результатом аберрации SMN-гена является недоразвитие мотонейронов спинного мозга, локализующихся в его передних рогах, демиелинизация передних корешков. Часто имеются аналогичные изменения в двигательных ядрах и корешках V, VI, VII, IX, X, XI и XII черепных нервов. В скелетных мышцах нейрогенные изменения характеризуются пучковой атрофией, чередованием атрофированных и сохранных пучков мышечных волокон, а также нарушениями, типичными для первичных миопатий (гиалиноз, гипертрофия отдельных мышечных волокон, гиперплазия соединительной ткани). Следствием этого становится недостаточная иннервация мышц, приводящая к их выраженной атрофии с потерей мышечной силы и прогрессирующим угасанием способности совершать активные двигательные акты. Основную опасность представляет слабость мышц грудной клетки, без участия которых невозможны движения, обеспечивающие дыхательную функцию. При этом сенсорная сфера на всем протяжении заболевания остается интактной [2].
СМА Верднига — Гоффмана — наиболее злокачественная спинальная мышечная атрофия, развивающаяся с рождения или в первые 1–1,5 года жизни ребенка. Характеризуется нарастающими диффузными мышечными атрофиями, сопровож-дающимися вялыми парезами, вплоть до полной плегии. Она, как правило, сочетается с костными деформациями и врожденными аномалиями развития. Диагностическую основу заболевания составляют анамнез, неврологический осмотр, электрофизиологические и томографические исследования, анализ ДНК, изучение морфологического строения мышечной ткани. Лечение малоэффективно, в основном направлено на оптимизацию трофики нервной и мышечной тканей.
Распространенность СМА находится на уровне 1 случая на 6–10 тыс. новорожденных. Носителем измененного гена, обусловливающего возникновение заболевания, является каждый 50-й человек. Но благодаря аутосомно-рецессивному типу наследования патология у ребенка проявляется только тогда, когда соответствующая генетическая аберрация имеется как у матери, так и у отца. Вероятность рождения ребенка с патологией в такой ситуации составляет 25 %.
СМА Верднига — Гоффмана имеет несколько клинических форм: врожденную, промежуточную (раннюю детскую) и позднюю. Целый ряд специалистов выделяет последнюю форму как самостоятельную нозологию — амиотрофию Кугельберга — Веландера. Отсутствие этиотропного и патогенетического лечения, ранний летальный исход относят оказание медицинской помощи пациентам с болезнью Верднига — Гоффмана в ряд наиболее сложных задач, стоящих перед современной медициной.
Врожденная форма (СМА I) — клинически манифестирует до 6-месячного возраста. Внутриутробно может проявляться вялым шевелением плода. Зачастую мышечная гипотония отмечается с первых дней жизни и сопровождается угасанием глубоких рефлексов. Дети слабо кричат, плохо сосут, не могут держать голову. В отдельных случаях (при более позднем дебюте симптомов) ребенок учится держать голову и даже сидеть, но на фоне развития заболевания эти навыки быстро исчезают. Характерны ранние бульбарные нарушения, понижение глоточного рефлекса, фасцикулярные подергивания языка. Эта форма СМА сочетается с олигофренией и нарушениями формирования костно-суставного аппарата: деформациями грудной клетки (воронкообразной и килевидной грудной клеткой), искривлением позвоночника (сколиозом), контрактурами суставов. У многих пациентов выявляются другие врожденные аномалии (гемангиомы, гидроцефалия, косолапость, дисплазия тазобедренных суставов, крипторхизм и др.). Течение врожденной формы СМА I наиболее злокачественно вследствие быстрого нарастания обездвиженности и пареза дыхательной мускулатуры. Последний обусловливает развитие и прогрессирование дыхательной недостаточности, выступающей основной причиной летального исхода. В связи с нарушением глотания возможен заброс пищи в дыхательные пути с развитием аспирационной пневмонии, которая может стать смертельно опасным осложнением.
Ранняя детская форма (СМА II) — дебютирует после 6-месячного возраста. К этому периоду дети имеют удовлетворительное физическое и нервно-психическое развитие. Приобретают навыки держать голову, переворачиваться, садиться, стоять в соответствии с возрастными нормами. Но в подав-ляющем большинстве клинических случаев дети так и не успевают научиться ходить. Обычно эта форма СМА манифестирует после перенесенной ребенком пищевой токсикоинфекции или другого острого инфекционного заболевания. В начальном периоде периферические парезы возникают в нижних конечностях. Затем они достаточно быстро распространяются на верхние конечности и мускулатуру туловища. Развивается диффузная мышечная гипотония, угасают глубокие рефлексы. Наблюдаются контрактуры сухожилий, тремор пальцев, непроизвольные мышечные сокращения (фасцикуляции) языка. На поздних стадиях присоединяются бульбарные симптомы и прогрессирующая дыхательная недостаточность. Течение СМА II более медленное, чем у врожденной формы СМА. Пациенты могут доживать до 15-летнего возраста.
Поздняя форма (амиотрофия Кугельберга — Веландера, или СМА III) — наиболее доброкачественная спинальная амиотрофия детского возраста. Первые признаки болезни возникают в 1,5–2,5 года, в отдельных случаях в период с 15 до 30 лет. К этому возрасту у детей полностью завершено формирование статических и локомоторных функций. Отсутствует задержка психического развития, длительное время большинство пациентов способны самостоятельно двигаться. Некоторые из них доживают до глубокой старости, не теряя способности к самообслуживанию. Заболевание начинается незаметно. Движения становятся неловкими, неуверенными. Дети часто спотыкаются, падают. Изменяется походка — они ходят, сгибая ноги в коленях («походка заводной куклы»). Вялые парезы первоначально локализуются в проксимальных группах мышц нижних конечностей, в дальнейшем сравнительно медленно переходят на проксимальные группы мышц верхних конечностей, мышцы туловища. Атрофия мышц обычно малозаметна вследствие хорошо развитого подкожного жирового слоя. Типичны фасцикуляции языка, мелкий тремор пальцев, бульбарные симптомы (фасцикуляции и атрофия языка, снижение глоточного и небного рефлексов). Глубокие рефлексы угасают уже на ранних стадиях болезни. Костно-суставные деформации развиваются параллельно основному заболеванию. Наиболее выражена деформация грудной клетки. Течение СМА III злокачественное, но мягче, чем при вышерассмотренных формах. Нарушение способности к самостоятельной ходьбе происходит в 10–12-летнем возрасте. Больные живут до 20–30 лет [3–7].
При анализе базы данных из различных источников по ключевым словам «спинальная амиотрофия Верднига — Гоффмана» и «анестезия» нами найдено лишь три ссылки. По ключевым словам «спинальная амиотрофия типа I» и «анестезия» найдено 18 ссылок. В основном они касались проведения анестезии у пациентов детского возраста. Основная часть ссылок посвящена особенностям обеспечения проходимости дыхательных путей, проведения общей анестезии. Авторы отмечают высокий риск общей анестезии и часто — невозможность проведения регионарной анестезии. Риски общей анестезии связаны с применением деполяризующих миорелаксантов и ингаляционных анестетиков, использование которых может приводить к таким последствиям, как нарушения сердечного ритма, рабдомиолиз, остановка сердца, нарушения функции почек и злокачественная гипертермия. Наркотические анальгетики, недеполяризующие миорелаксанты короткого действия, мидазолам и пропофол считаются достаточно безопасными. Большую опасность представляет сохранение спонтанного дыхания во время общей анестезии в связи с угрозой при неадекватной вентиляции быстрого нарастания уровня углекислого газа в крови с последующими тяжелыми нарушениями ритма сердца. Но и искусственная вентиляция легких (ИВЛ) представляет опасность волюмо- и баротравмы из-за существующих респираторных нарушений [8–10].
Основная часть доступной нам литературы была посвящена анестезиологическому обеспечению пациентов детского и реже — юношеского возраста. R.J. Graham и соавт. (2009), описывая течение периоперационного периода у детей с СМА, указывают на необходимость и относительную безопасность применения наркотических анальгетиков [11]. В то же время авторы считают необходимым проведение дополнительных исследований для решения вопроса о безопасной респираторной поддержки у пациентов такой категории.
G. Ottonello и соавт. (2010) подчеркивают важность участия родителей в послеоперационном уходе за такими пациентами и, конечно, наличия индивидуального сестринского поста наблюдения, что позволяет выполнять наиболее раннюю экстубацию трахеи [12].
N. Shime и соавт. (1990) из клиники Киото указывают на риск применения миорелаксантов и предлагают проведение общей анестезии без миорелаксантов, с препаратами галотана [13]. При операции кесарева сечения также описано проведение общей анестезии без мышечных релаксантов. Так, A.S. Habib и соавт. (2005), описывая проведение анестезии при абдоминальном родоразрешении беременной с СМА, указывают на необходимость использования последовательной быстрой индукции и интубации и безопасность применения опиоидных анальгетиков и пропофола [14]. Они же в своих более поздних работах показывают возможность интубации трахеи у беременных со СМА I типа без применения миорелаксантов [15]. В свою очередь, S.J. Harris, K. Moaz (2002) из Великобритании описывают успешную субарахноидальную анестезию при плановой операции кесарева сечения сразу у двух сестер со СМА [16]. При малых операциях и манипуляциях предпочтение отдают любым вариантам местной анестезии или периферическим блокадам. Так, J.C. Sleth и S. Oks (2005) из Франции предлагают при гистероскопии проводить парацервикальный блок, чтобы предупредить все риски общей анестезии [17]. А.В. Пырегов, О.В. Мельникова (2012) также описывают удачный случай общей анестезии пропофолом и фентанилом с использованием 15 мг рокурония бромида и поддержанием проходимости дыхательных путей двухканальной ларингомаской при гистероскопии [18].
Мы представляем клинический случай проведения кесарева сечения у беременной в КУ «ДОПЦ со стационаром» ДОС». Беременная К., 22 лет, поступила 24.04.2018 с диагнозом «I беременность 35 недель. Головное предлежание». Сопутствующий диагноз — «спинальная мышечная атрофия Верднига — Гоффмана. Тетрапарез. Сколиоз S-образный 4-й степени. Деформация грудной клетки. Лицо с инвалидностью 1-й группы. Табакокурение».
При осмотре предъявляет жалобы на постоянную изжогу, эпизоды рвоты недавно съеденной пищей, затруднение при откашливании мокроты. Объективно: сознание ясное. Доступна продуктивному контакту. Интеллект не снижен. Психическое развитие не нарушено. Масса тела — 55 кг, рост — 158 см, индекс массы тела — 22,03. Кожные покровы обычной окраски, влажности, чистые. Пастозность голеней и стоп (рис. 1).
/206-1.jpg)
Неврологический статус. Ширина глазных щелей не изменена. Движения глазных яблок в полном объеме. Экзофтальм 1-й ст. Прямая и содружественная реакция зрачков на свет сохранена. Зрение не нарушено. Лицо симметрично. Мимические пробы выполняет удовлетворительно. Нистагм отсутствует. Слезотечения нет. Слух без изменений. Глотание свободное. Мягкое небо при фонации сокращается симметрично, язычок — по средней линии. Парезов кивательной и трапециевидной мышц нет. Язык при высовывании по средней линии. Гипотрофии, фасцикуляций языка не выявлено. Оценка дыхательных путей по Маллампати — 2-я степень. Движения в шейном отделе позвоночника ограниченны. Тонус мышц шеи значительно снижен.
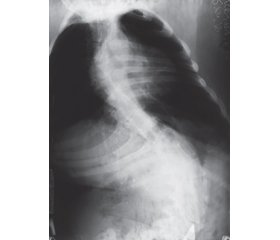
Выраженная деформация грудной клетки (воронкообразная), левосторонний кифосколиоз
4-й ст. Болевая, температурная, тактильная чувствительность сохранена. Объем движений (активных и пассивных): в полном объеме в лучезапястных и локтевых суставах, ограничен до 45° в плечевых суставах. Длительность удержания верхней конечности в наивысшей точке — до 15 с. Тонус мышц резко снижен за счет атрофии. Мелкий тремор пальцев. Мышечная сила в верхних конечностях до 2 баллов. Парез нижних конечностей, косолапость. Деформация костей таза. Функция тазовых органов сохранена. Самостоятельно передвигаться не может с восьмилетнего возраста.
При аускультации дыхание над легкими везикулярное с жестким оттенком. Справа выслушивается до 4-го ребра, значительно ослаблено спереди и по боковой поверхности. Спереди слева практически не выслушивается из-за гиперзвучных сердечных тонов. Хрипов или крепитации нет. Cердце — атипичные точки аускультации. Тоны ясные, легкий систолический шум над всеми точками. Сокращения сердца ритмичные, нормотемп. Гемодинамика стабильная на цифрах нормотензии.
Живот мягкий, увеличен за счет беременной матки, не вздут, доступен пальпации, безболезненный. Атрофия мышц передней брюшной стенки. Матка в нормотонусе.
На предоставленных нам рентгеновских снимках от 2016 года определяется выраженный кифосколиоз 4-й степени (рис. 2). Уменьшение объема легких из-за сколиоза.
/207-1.jpg)
Больная была обследована лабораторно. В общем анализе крови отмечается анемия легкой степени (гемоглобин — 100 г/л; количество эритроцитов — 3,34 × 1012/л), гематокрит — 29,6 %, количество тромбоцитов — 177 × 109/л. Биохимические показатели крови, электролиты крови, коагулограмма в пределах нормы. Общий анализ мочи в пределах нормы. Электрокардиография: ритм синусовый, без особенностей. При ультразвуковом исследовании (УЗИ) внутренних органов выявлены эхо-признаки холестаза. УЗИ почек: структурных изменений не выявлено. Визуализация правой почки затруднена из-за деформации грудной клетки и искривления позвоночника. УЗИ щитовидной железы: структурной патологии не выявлено. Эхокардиография: фиброз и асимметрия створок аортального клапана (АК). Минимальная регургитация в створках АК. Фиброз АК, митрального клапана (МК). Незначительная (mild) недостаточность МК. Незначительная (mild) недостаточность трикуспидального клапана. Полости сердца не увеличены. Фракция выброса левого желудочка (ЛЖ) — норма. Тип геометрии ЛЖ — нормальная геометрия. Систолическое давление в легочной артерии — 28 мм рт.ст.
На спирограмме выявлены: смешанные нарушения вентиляционной способности легких с преобладанием рестрикции. Снижение функциональной жизненной емкости до 60 % от нормы. УЗИ артерий и вен нижних конечностей не выявили патологии. Легкий лимфостаз обеих голеней и стоп. УЗИ брахиоцефальных артерий: эхо-признаки негрубой извитости правой общей сонной артерии без гемодинамических нарушений; ускоренный кровоток по левой позвоночной артерии (ПА) в сегменте V4; асимметрия кровотока по ПА в сегменте V4 более 50 %.
Осмотрена смежными специалистами: терапевтом, окулистом, невропатологом, эндокринологом, отоларингологом.
После неоднократных консилиумов и консультаций с экспертами МЗ Украины по профилю было принято решение провести плановое оперативное родоразрешение путем операции кесарева сечения. Метод обезболивания: тотальная внутривенная анестезия со вспомогательной ИВЛ с потоком кислорода в комбинации с инфильтрационной анестезией тканей.
Для венозного доступа катетеризировали две периферические вены. Для уменьшения объема кровопотери до разреза использовали транексамовую кислоту 1000 мг внутривенно (в/в) медленно.
Профилактика раневой инфекции введением цефазолина (2 г в/в за 60 минут до разреза).
Премедикация осуществлялась за 15 мин до начала операции введением метоклопрамида (10 мг), дексаметазона (8 мг), проксиума (40 мг).
Преоксигенация через лицевую маску аппаратом Monnal в режиме VCV: ДО — 350 мл, МОД — 8,2 л/м, FiO2 — 100 %. В ходе наркоза гемодинамика стабильная: артериальное давление 117/76–105/65–128/78 мм рт.ст.; частота сердечных сокращений 100–88–76 в 1 минуту; SpO2 98–99–98 %.
Индукция в наркоз: тиопентал натрия 100 мг в/в болюсно; натрия оксибутират 500 мг; кетамин 12,5 мг, фентанил 0,1 мг в/в.
Поддержание анестезии: тиопентал (по 25 мг) и натрия оксибутират (по 500 мг) методом титрования, фентанил (по 0,05 мг) и кетамин (по 12,5–25 мг) болюсно.
Инфильтрационная анестезия новокаином 0,25% проводилась по общим правилам.
Общий объем 0,25% раствора новокаина составил 400 мл.
Периоперационная инфузионно-трансфузионная терапия состояла из 200 мл сбалансированного кристаллоидного раствора (стерофундин) и 3 доз (120 мл) криопреципитата В (III), парацетамола — 1000 мг были введены за 15 мин до конца операции.
Родился ребенок мужского пола, масса тела — 2800 г, длина – 49 см, 9/9 баллов по шкале Апгар.
Длительность операции — 53 мин, анестезии — 55 мин.
Суммарно в ходе операции введено: 200 мг тиопентала, 0,2 мг фентанила, 100 мг кетамина, 2 г натрия оксибутирата, 400 мл 0,25% новокаина.
Диурез — 300 мл (5,6 мл/кг/мин), моча светлая. Общая кровопотеря — 250 мл.
По окончании операции при полном восстановлении сознания пациентка была переведена в палату отделения анестезиологии и интенсивной терапии акушерского стационара для дальнейшего лечения и наблюдения. Послеоперационный период протекал без особенностей. Больная получала антибактериальную (цефтазидим 1000 мг в/в 2 раза в сутки на протяжении 5 суток), утеротоническую терапию (окситоцин 5 ЕД внутримышечно (в/м) 3 раза в сутки), обезболивание осуществляли кетопрофеном (100 мг в/м 3 раза в сутки). Инфузионная терапия в 1-е сутки послеоперационного периода включала 500 мл стерофундина.
Профилактика тромбоэмболических осложнений проводилась эноксапарином 20 мг 1 раз в сутки подкожно на протяжении 7 суток. Стимуляция кишечника стандартная (метоклопрамид + ормолакт). На 2-е сутки после операции больная оправилась после очистительной клизмы, в дальнейшем регулярный самостоятельный стул был ежедневно. Ребенок находился на совместном пребывании и грудном вскармливании.
На 5-е сутки послеоперационного периода больная переведена в акушерское отделение, а через 10 суток после операции выписана домой в удовлетворительном состоянии.
Таким образом, представленный клинический случай иллюстрирует один из вариантов анестезиологического пособия при оперативном родоразрешении у пациентки со спинальной амиотрофией Верднига — Гоффмана. Учитывая наличие выраженной экстрагенитальной патологии и анатомических изменений, выбран метод обезболивания: тотальная внутривенная анестезия со вспомогательной ИВЛ с потоком кислорода в комбинации с инфильтрационной анестезией тканей.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Селиверстов Ю.А. Спинальные мышечные атрофии: понятие, дифференциальная диагностика, перспективы лечения / Ю.А. Селиверстов, С.А. Клюшников, С.Н. Иллариошкин // Нервные болезни. — 2015. — № 3. — С. 9-17.
2. Спинальные мышечные атрофии и боковой амиотрофический склероз как проявление болезни двигательного нейрона у детей / С.К. Евтушенко, Т.М. Морозова, Е.П. Шестова [и др.] // Международный неврологический журнал. — 2013. — № 6(60). — С. 170-179.
3. Hardart M.K. Spinal muscular atrophy-type I / M.K. Har-dart, R.D. Truog // Arch. Dis. Child. — 2003. — Vol. 88, № 10. — Р. 848-850.
4. Iannaccone S.T. Modern Management of Spinal Muscular Atrophy / S.T. Iannaccone // J. Child Neurol. — Vol. 22, № 8. — Р. 974-978.
5. Clinical Outcome Measures in Spinal Muscular Atrophy / J. Montes, A.M. Gordon, S. Pandya [et al.] // J. Child Neurol. — 2009. — Vol. 24, № 8. — Р. 968-978.
6. The changing natural history of spinal muscular atrophy type 1 / M. Oskoui, G. Levy, C. J. Garland [et al.] // Neuro–logy. — 2007. — Vol. 69, № 20. — Р. 1931-1936.
7. Consensus Statement for Standard of Care in Spinal Muscular Atrophy / C.H. Wang, R.S. Finkel, E.S. Bertini [et al.] //
J. Child Neurol. — 2007. — Vol. 22, № 8. — Р. 1027-1049.
8. Wilton N.C. Spinal muscular atrophy: the challenges of «doing the right thing» / N.C. Wilton // Paediatr. Anaesth. — 2009. — Vol. 19, № 11. — Р. 1041-1047.
9. Bach J.R. Spinal Muscular Atrophy Type 1. A Noninvasive Respiratory Management Approach / J.R. Bach, V. Niranjan, B. Weaver // Chest. — 2000. — Vol. 117, № 4. — Р. 1100-1105.
10. Forget P. Postoperative use of nasal intermittent positive pressure in a patient with spinal muscular atrophy type II / P. Forget, F. Lois, P. Pendeville // Acta Anaesthesiol. Belg. — 2008. — Vol. 59, № 2. — Р. 99-101.
11. Anesthesia and perioperative medical management of children with spinal muscular atrophy / R.J. Graham, U. Athiraman, A.E. Laubach [et al.] // Paediatr. Anaesth. — 2009. — Vol. 19, № 11. — Р. 1054-1063.
12. Parental role in the Intensive Care Unit for children affected by Werdnig Hoffmann disease / G. Ottonello, C. Mastella, A. Franceschi [et al.] // Minerva Pediatr. — 2010. — Vol. 62, № 2. — Р. 147-151.
13. Management of a patient with progressive spinal muscular atrophy / N. Shime, T. Hosokawa, Y. Hori [et al.] // Masui. — 1990. — Vol. 39, № 7. — Р. 918-920.
14. Anesthesia for cesarean section in a patient with spinal muscular atrophy / A.S. Habib, S.E. Helsley, S. Millar [et al.] // J. Clin. Anesth. — 2004. — Vol. 3. — Р. 217-219.
15. Habib A.S. Tracheal intubation without muscle relaxants for caesarean section in patients with spinal muscular atrophy / A.S. Habib, H.A. Muir // Int. J. Obstet. Anesth. — 2005. — Vol. 14, № 4. — Р. 366-367.
16. Harris S.J. Caesarean section conducted under subarachnoid block in two sisters with spinal muscular atrophy / S.J. Harris, K. Moaz // Int. J. Obstet. Anesth. — 2002. — Vol. 11, № 2. — Р. 125-127.
17. Sleth J.C. Paracervical block for hysteroscopy in patient with spinal muscular atrophy / J.C. Sleth, S. Oks // Ann. Fr. Anesth.
Reanim. — 2005. — Vol. 24, № 3. — Р. 309-310.
18. Описание клинического случая анестезии у пациентки со спинальной амиотрофией Верднига — Гоффмана / А.В. Пырегов, О.В. Мельникова, А.Ю. Данилов, Е.М. Шифман // Вестник анестезиологии и реаниматологии. — 2012. — № 1. — С. 48-52.

/206-1.jpg)
/207-1.jpg)