Резюме
Актуальність. На сьогодні в лікуванні внутрішньосуглобових переломів домінують технології відкритої репозиції і заглибного остеосинтезу. За наявності безлічі позитивних якостей, характерних для цих технологій, об’єктивним негативним чинником є їх висока травматичність, що обумовлює значну кількість ранніх гнійно-некротичних ускладнень і пізніх порушень регенерації. Ці обставини змушують знову загострити увагу на об’єктивізації свідчень щодо відкритих хірургічних втручань при тяжких внутрішньосуглобових травматичних ушкодженнях. Закриті технології лікування внутрішньосуглобових переломів не викликають питань стосовно травматичности і ризику гнійно-некротичних ускладнень, але репозиційні можливості позавогнищевого остеосинтезу і фіксаційного методу вважаються обмеженими. Один із шляхів поліпшення функціональних результатів закритих технологій — використання ефекту функціонального ремоделювання. Це явище помічено в клінічній практиці, коли первинні сумнівні результати закритої репозиції відламків істотно поліпшувалися в процесі функціонального лікування і наступні функціональні результати лікування виявлялися цілком прийнятними. Такі позитивні перспективи зажадали поглибленого вивчення і визначення умов, необхідних для реалізації ефекту функціонального ремоделювання, і в першу чергу — оптимальних термінів для початку функціонального лікування. Питання про терміни виникло не випадково, тому що існуюча теза «чим раніше, тим краще» на практиці має сумнівний вигляд і, крім того, не має ніякої доказової бази. Мета. На підставі вивчення структурних змін у повношаровому дефекті суглобової поверхні встановити оптимальні тимчасові параметри проведення реабілітаційного лікування для реалізації ефекту функціонального ремоделювання. Матеріали та методи. Виконано експериментальне дослідження на 28 статевозрілих щурах, яким після артротомії колінного суглоба наносили стандартні травматичні ушкодження зовнішнього виростка стегнової кістки. Для стандартизації механізму травми розроблено спеціальний пристрій. Піддослідних тварин об’єднали в 4 групи по 7 особин, яких виводили з експерименту в терміни 3, 7, 14, 28 днів після травми, і виконували гістоморфологічне дослідження препаратів із зони ушкодження. Результати. Встановлено, що протягом перших двох тижнів після травми в зоні ушкодження проходять регенеративні процеси з утворенням органоспецифічних структур, однак механічні властивості регенерату ще не достатні для первинного знерухомлення країв хрящового дефекту, що, як доведено, є основною умовою для утворення хрящеподібної тканини. З цієї причини функціональне лікування в цей період може тільки сповільнити процес регенерації. На 14-ту добу констатовано інтенсивне формування кісткової тканини субхондральних зон, що є прогностично позитивною ознакою, від якої (що також доведено) прямо залежить регенерація хряща. Цим маніфестуються ознаки готовності регенерату до ремоделювання хрящових дефектів. Протягом останніх двох тижнів спостерігалося моделювання суглобових поверхонь шляхом замісного заповнення дефектів кістковою тканиною пластинчастої структури і формування волокнистого хряща; відновлення гіалінового хряща не відбувалося. Висновки. Обґрунтованими термінами початку функціонального лікування є період із третього і не пізніше кінця четвертого тижня після травми, що є оптимальним для реалізації ефекту функціонального ремоделювання ушкоджених суглобових поверхонь.
Актуальность. На сегодняшний день в лечении внутрисуставных переломов доминируют технологии открытой репозиции и погружного остеосинтеза. При наличии множества положительных качеств, характерных для этих технологий, объективным негативным фактором является их высокая травматичность, обусловливающая значительное количество ранних гнойно-некротических осложнений и поздних нарушений регенерации. Эти обстоятельства вынуждают вновь заострить внимание на объективизации показаний для открытых хирургических вмешательств при тяжелых внутрисуставных травматических повреждениях. Закрытые технологии лечения внутрисуставных переломов не вызывают вопросов в отношении травматичности и риска гнойно-некротических осложнений, но репозиционные возможности внеочагового остеосинтеза и фиксационного метода считаются ограниченными. Один из путей улучшения функциональных результатов закрытых технологий — использование эффекта функционального ремоделирования. Это явление замечено в клинической практике, когда первичные сомнительные результаты закрытой репозиции отломков существенно улучшались в процессе функционального лечения, и последующие функциональные результаты лечения оказывались вполне приемлемыми. Такие положительные перспективы потребовали углубленного изу-чения и определения условий, необходимых для реализации эффекта функционального ремоделирования, и в первую очередь — оптимальных сроков для начала функционального лечения. Вопрос о сроках возник не случайно, так как существующий тезис «чем раньше, тем лучше» на практике выглядит сомнительно и, кроме того, не имеет никакой доказательной базы. Цель. На основании изучения структурных изменений в полнослойном дефекте суставной поверхности установить оптимальные временные параметры проведения реабилитационного лечения для реализации эффекта функционального ремоделирования. Материалы и методы. Выполнено экспериментальное исследование на 28 половозрелых крысах, которым после артротомии коленного сустава наносили стандартные травматические повреждения наружного мыщелка бедренной кости. Для стандартизации механизма травмы разработано специальное устройство. Подопытных животных объединили в 4 группы по 7 особей, которых выводили из эксперимента в сроки 3, 7, 14, 28 дней после травмы, и выполняли гистоморфологическое исследование препаратов из зоны повреждения. Результаты. Установлено, что на протяжении первых двух недель после травмы в зоне повреждения проходят регенеративные процессы с образованием органоспецифичных структур, однако механические свойства регенерата еще не достаточны для первичного обездвиживания краев хрящевого дефекта, что, как доказано, является основным условием для образования хрящеподобной ткани. По этой причине функциональное лечение в этот период может только замедлить процесс регенерации. На 14-е сутки констатировано интенсивное формирование костной ткани субхондральных зон, что является прогностически позитивным признаком, от которого (что также доказано) прямо зависит регенерация хряща. Этим манифестируются признаки готовности регенерата к ремоделированию хрящевых дефектов. На протяжении последних двух недель наблюдалось моделирование суставных поверхностей путем заместительного заполнения дефектов костной тканью пластинчатой структуры и формирование волокнистого хряща; восстановления гиалинового хряща не происходило. Выводы. Обоснованными сроками начала функционального лечения является период с начала третьей и не позднее конца четвертой недели после травмы, что является оптимальным для реализации эффекта функционального ремоделирования поврежденных суставных поверхностей.
Background. Today, the technology of open reposition and external osteosynthesis (AO) is leading one in the treatment of intraarticular fractures. In the presence of many positive characteristic of these technologies, their high invasiveness, causing a significant amount of early infection necrotic complications and late regeneration disorders, is an objective factor. These circumstances are forcing again to focus on the objectification of indications for open surgical interventions in severe intraarticular traumatic injuries. Extrafocal technologies for the treatment of intraarticular fractures do not raise questions regarding the morbidity and the risk of infection necrotic complications, but the reposition possibilities of the extrafocal osteosynthesis and fixation method are considered limited. One of the ways to improve the functional results of closed technologies is to use the effect of functional remodeling. This phenomenon was observed in clinical practice, when the primary controversial results of closed fragment reposition improved significantly during functional treatment, and the subsequent functional results of treatment were quite acceptable. Such positive perspectives required an in-depth study and determination of the conditions necessary for the implementation of the effect of functional remodeling and, first of all, the optimal time for the start of functional treatment. The issue of timing did not arise by chance, since the existing thesis “the sooner the better” looks doubtful in practice, and, moreover, it has no evidence base. The purpose was to establish the optimal time parameters for the rehabilitation treatment in order to realize the effect of functional remodeling of traumatic injuries of the articular surfaces. Materials and methods. An experimental study was performed on 28 adult rats that, after arthrotomy of the knee joint, were subjected to standard traumatic injuries of the lateral condyle of the femur. To standardize the mechanism of injury, a special device was developed. Experimental animals were combined into 4 groups of 7 individuals. On days 3, 7, 14, 28, they were sacrificed, and histomorphological study of preparations from the damage zone was performed. Results. It was found that during the first two weeks after injury, regenerative processes in the damage zone occur, with the formation of organ-specific structures, however, the mechanical properties of the regenerate are not yet sufficient for the primary immobilization of the margins of the cartilage defect, which, as proved, is the main condition for the formation of cartilage. For this reason, functional treatment during this period can only slow down the regeneration process. On day 14, an intensive formation of bone tissue of the subchondral zones was established that is a positive prognostic sign, on which (as also proven) the regeneration of cartilage directly depends. This indicates the signs of regenerate readiness for remodeling cartilage defects. Over the past two weeks, modeling of the articular surfaces has been observed by defect replacing of a bone lamellar structure and forming fibrous cartilage; hyaline cartilage recovery did not occur. Conclusions. The reasonable time to start functional treatment is the period from the beginning of the third and no later than the end of the fourth week after the injury, which is optimal for realizing the effect of functional remodeling of damaged articular surfaces.
Вступ
Тенденцією останніх років є домінування технологій відкритої репозиції та внутрішньої фіксації (АО) при внутрішньосуглобових ушкодженнях. Поряд із безліччю позитивних рис, що притаманні цим технологіям, обʼєктивним негативним фактором залишається їх висока травматичність, що обумовлює значну кількість ранніх інфекційно-некротичних ускладнень та пізніх порушень регенерації [1]. Ці обставини примушують загострити увагу на питаннях об’єктивізації показань до відкритих хірургічних втручань при внутрішньосуглобових ушкодженнях та переглянути лікувальний потенціал менш травматичних технологій лікування (позавогнищевий остеосинтез, фіксаційний метод тощо). Закриті технології не викликають питань стосовно їх відповідності біологічним принципам, але при цьому репозиційні можливості згаданих методик вважаються обмеженими. Одним із шляхів поліпшення результатів лікування внутрішньосуглобових ушкоджень з використанням закритих технологій видається функціональне ремоделювання. Цей ефект помічено в клінічній практиці, коли в частині випадків лікування внутрішньосуглобових ушкоджень сумнівні первинні результати репозиції значно поліпшувались у процесі функціонального лікування, а функціональні результати були цілком прийнятними [2]. Такі привабливі перспективи спонукали до поглибленого вивчення цього явища, а саме умов, за яких реалізується ефект функціонального ремоделювання, і в першу чергу — оптимальних строків початку функціонального лікування. Питання про строки теж виникло не випадково, бо існуюча теза щодо цього «чим раніше, тим краще» на практиці має сумнівний вигляд, а крім того, не має ніякої доказової бази.
Мета дослідження: на підставі вивчення структурних перетворень у повношаровому дефекті суглобової поверхні визначити оптимальні часові параметри проведення реабілітаційного лікування для реалізації ефекту функціонального ремоделювання.
Матеріали та методи
Роботу виконано на 28 білих статевозрілих (віком 6–7 місяців на початок експерименту) лабораторних щурах-самцях популяції експериментально-біологічної клініки Державної установи «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка Національної академії медичних наук України» (ДУ «ІПХС ім. проф. М.І. Ситенка НАМН») із дотриманням правил Європейської конвенції щодо захисту хребетних тварин, яких використовують в експериментальних та інших наукових цілях, і Закону України «Про захист тварин від жорстокого поводження» [3, 4]. Проведення експериментів на тваринах схвалено комітетом із біоетики при ДУ «ІПХС ім. проф. М.І. Ситенка НАМН» (протокол № 162 від 06.03.2017 р.).
Техніка виконання операції. Тварин фіксували в положенні лежачи на спині, вистригали шерсть і обробляли операційне поле антисептиком бетадин. Під загальним знеболюванням (кетамін 50 мг/кг, внутрішньом’язово) виконували артротомію колінного суглоба з передньолатерального поздовжнього доступу, зміщували наколінок медіально та відтворювали імпресійне повношарове ушкодження суглобової поверхні латерального виростка стегнової кістки глибиною 2,0 мм за допомогою динамометричного ударного імпактора з наконечником циліндричної форми та площею поперечного перерізу 1 мм2 (рис. 1). Після оброблення рани антибіотиком її пошарово зашивали. Додаткову іммобілізацію травмованої кінцівки не використовували.
Евтаназію щурів здійснювали через 3, 7, 14 і 28 діб (по 7 тварин на кожен термін) після хірургічного втручання шляхом введення летальної дози анестетика (тіопентал натрію 90 мг/кг внутрішньом’язово) [2].
Гістологічне дослідження. Виділяли травмовані колінні суглоби та фіксували в 10% розчині нейтрального формаліну, декальцинували в 10% розчині мурашиної кислоти, зневоднювали в етиловому спирті збільшеної концентрації (від 60° до 96°) та в суміші етилового спирту з діетиловим ефіром (1 : 1), заливали в целоїдин [3].
Аксіальні гістологічні зрізи колінних суглобів виготовляли на санному мікротомі Reichert, забарвлювали гематоксиліном та еозином, пікрофуксином за Ван Гізоном та аналізували під мікроскопом Olympus BX63 (Японія), фотографували з використанням фотокамери Olympus DP73 і програмного забезпечення Cell Sens Dimention 1.8.1 (Olympus, 2013). У процесі аналізу суглобового хряща оцінювали стан поверхневої, проміжної та зони кальцифікованого хряща. Проміжною, або середньою (mid), зоною вважали шар суглобового хряща від поверхневої зони до базофільної лінії (tidemark) згідно з рекомендаціями N. Gerwin і співавт. [6] щодо аналізу стану суглобового хряща у щурів, оскільки на відміну від суглобового хряща людини глибока зона в цих тварин не диференціюється.
Морфометричні дослідження. У ділянці дефекту за допомогою програмного забезпечення Cell Sens Dimention 1.8.1 (Olympus, 2013) вимірювали площі (мкм2) утворених тканин (фібринового згустка, грануляційної, фіброретикулярної, кісткової) і виражали їх у вигляді відносної площі (%) від загальної площі регенерату.
Статистичний аналіз проведено із застосуванням програм IBM SPSS Statistics 20. Отримані числові показники подано у вигляді M ± m, де M — середнє значення показника, m — помилка середнього арифметичного. Для перевірки нормальності розподілу використано тест Колмогорова — Смирнова та перевірено рівність дисперсій у досліджуваних групах. Для порівняння середніх значень показників використано t-критерій Стьюдента для незалежних вибірок. Відмінності вважали значущими за р < 0,05.
Результати та обговорення
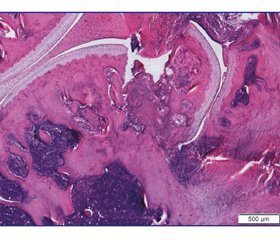
3 доби після операції
В усіх тварин чітко виявляли зону дефекту, що була заповнена приблизно на 2/3.
Латеральний виросток, утворюючи своєрідну сходинку суглобової поверхні, відхилявся в бік від стегнової кістки, проте був з’єднаний із материнським кортексом тонким прошарком фіброретикулярної тканини (рис. 2). У міжтрабекулярних просторах субхондральної кістки поблизу ділянки дефекту відзначено формування ретикулофіброзної тканини, а на відстані в них розташовувався червоний кістковий мозок. Суглобовий хрящ зберігався і на виростку, і на іншій частині стегнової кістки, проте зазнав структурних змін, особливо поблизу зони травми. Зокрема, у поверхневій зоні хондроцити були відсутніми, а матрикс забарвлений еозинофільно.
/82-2.jpg)
У середній зоні відзначено порушення упорядкування клітин і утворення ізогенних груп (3–4), деякі капсули не містили хондроцитів. Базофільна лінія на всій території суглобового хряща, який вкриває стегнову кістку, була нерівномірною — переривчастою на ділянках, місцями подвійною чи потрійною. У зоні кальцифікованого хряща спостерігали території без хондроцитів, що нерівномірне матриксу. На відстані від ділянки дефекту структурні перетворення в суглобовому хрящі були менш вираженими і проявлялися зниженням щільності хондроцитів у поверхневій зоні, неоднорідністю забарвлення матриксу та нерівномірністю базофільної лінії.
У синовіальній оболонці зафіксовано ознаки гострого запалення.
У ділянці дефекту виявлено фібриновий згусток і грануляційну тканину, співвідношення яких у середньому становило 2,8 : 1 (табл. 1).
7 діб після операції
У регенераті з боку дна дефекту відзначено утворення кісткової тканини у вигляді грубоволокнистих кісткових трабекул зі значною кількістю остеоцитів із великими ядрами та розвинутою базофільною цитоплазмою, що свідчить про синтез ними компонентів матриксу. По зовнішній поверхні кісткових трабекул густо розміщувалися функціонально активні остеобласти у вигляді частоколу. Ядра в них були розташовані ексцентрично, містили 1–2 ядерця. Зазначені особливості новоутвореної кісткової тканини відображують високу активність репаративного остеогенезу. Центральну частину дефекту займала фіброретикулярна тканина остеогенного типу [5]. У ній визначено високу щільність клітин остеобластичного та фібробластичного диферонів (рис. 3).
/83-1.jpg)
Грануляційну тканину зі значною кількістю кровоносних капілярів різного діаметра спостерігали в ділянці дефекту на рівні суглобового хряща, а також поблизу латерального виростка (рис. 3). Її відносна площа вірогідно знизилася в 1,87 раза (р = 0,001) порівняно з 3-ю добою (табл. 1).
14 діб після операції
Тканини регенерату повністю заповнювали зону дефекту (рис. 4). На його поверхні, що межувала з порожниною суглоба, відзначено утворення щільної сполучної тканини зі значною щільністю видовжених клітин. Їхня довга вісь була спрямована паралельно поверхні.
Зокрема, виявляли майже в рівному співвідношенні фіброретикулярну та кісткову тканини (табл. 1). Остання утворювалась по периметру дефекту, з боків материнської кістки до центру, і містила грубоволокнисті кісткові трабекули зі значною щільністю остеоцитів і функціонально активних остеобластів на зовнішній поверхні, що відображує перебіг репаративного остеогенезу. Відносна площа кісткової тканини збільшилася порівняно з попереднім терміном дослідження в 1,43 раза (р = 0,002). Щільність клітин у фіброретикулярній тканині також була високою, її відносна площа порівняно з 7-ю добою спостереження не змінилася, що можна пояснити реорганізацією грануляційної тканини, якої вже не виявляли.
28 діб після операції
На гістопрепаратах визначали ділянку травматичного ушкодження, заповнену пластинчастою кістковою тканиною, яка за структурою зазвичай не відрізнялась від прилеглої материнської субхондральної кістки, складно було визначити межі дефекту (рис. 5а). Через це морфометричне дослідження виконувати було недоцільним.
На поверхні дефекту, яка межувала з порожниною суглоба, виявлено утворення нерівномірного за товщиною шару волокнистого хряща зі значною щільністю фіброхондроцитів. Вони містили розвинену витягнуту базофільну цитоплазму та великі округлі ядра (рис. 5а, б).
Новоутворені кісткові трабекули, що розташовувалися безпосередньо під шаром волокнистого хряща, знаходилися в стані перебудови, про що свідчить нерівномірність їх країв і наявність резорбційних лакун з остеокластами та нашарування остеоїду на інших ділянках (рис. 5в).
Волокнистий хрящ також сформувався й на прилеглій до ділянки дефекту суглобовій поверхні, замістивши суглобовий хрящ, і без чіткої межі переходив у сполучну тканину, яка розміщувалася на частині поверхні збереженого суглобового хряща. На більшій частині суглобової поверхні дистального епіфіза стегнової кістки визначено деструктивні зміни в суглобовому хрящі, а саме: відсутність поверхневої та частково середньої зон. На решті території, незважаючи на збереження всіх трьох зон, у ньому виявлено порушення гістоархітектоніки (нерівномірність поверхні, території без клітин, нерівномірність забарвлення матриксу). Визначені структурні особливості свідчать про прогресування артрозних змін у колінному суглобі.
Отже, в результаті морфологічного дослідження встановлено, що через 3 доби після моделювання повношарового ушкодження суглобової поверхні латерального виростка стегнової кістки в ділянці кісткового дефекту утворювався переважно фібриновий згусток. Території, займані грануляційною тканиною, були майже втричі меншими і розташовувалися з боку субхондральної кістки. Відомо, що формування фібрин-кров’яного згустка є важливою стадією регенерації кістки на локальному рівні [6, 7], проте його механічні властивості не дають змогу стабільно фіксувати утворені під час нанесення травми краї кістково-хрящової рани. За умов впливу навантаження без додаткової фіксації (особливо в разі відриву виростка) вони можуть розходитися в сторони, збільшуючи в такий спосіб площу дефекту та призводячи до затримки процесу регенерації. Зона дефекту на рівні суглобового хряща залишалася незаповненою.
Через 7 діб після травми площа грануляційної тканини зменшувалася в 1,87 раза порівняно з попереднім терміном. Вона займала територію в центрі дефекту та на його поверхні, що межувала з порожниною суглоба. Зафіксовано формування в дефекті фіброретикулярної тканини остеогенного типу, на частку якої припадало 54,51 %, та кісткової тканини в ділянці дна дефекту — 31,65 %. Зазначене свідчить про перебіг стадії регенерації кістки з утворенням тканиноспецифічних структур [10]. Проте механічні властивості тканин регенерату і на цей термін дослідження залишаються недостатніми для знерухомлення країв хрящового дефекту, що, як відомо, є однією з передумов для утворення в ньому хрящоподібної тканини [11].
Через 14 діб на кісткову тканину в ділянці травматичного ушкодження припадало 45,5 %, її відносна площа збільшувалася в 1,43 раза (р = 0,002). Це є прогностично позитивною ознакою, оскільки доведено пряму залежність між відновленням субхондральної кістки та регенерацією суглобового хряща за умов моделювання кістково-хрящових дефектів критичного розміру [12].
Через 28 діб після моделювання травматичного ушкодження відзначено заповнення дефекту кістковою тканиною пластинчастої структури. Проте відновлення суглобової поверхні з утворенням гіалінового хряща не відбулося, натомість визначено формування волокнистого хряща та прогресування артрозних змін у колінному суглобі.
Висновки
У результаті морфологічного дослідження встановлено, що після моделювання повношарового ушкодження суглобової поверхні латерального виростка стегнової кістки щурів за допомогою динамометричного ударного імпактора в ділянці дефекту на рівні субхондральної кістки відбуваються процеси репаративного остеогенезу відповідно до характерних його стадій. Через 3 доби виявлено утворення фібринового згустка, який поступово реорганізується з утворенням грануляційної, а потім фіброретикулярної тканини остеогенного типу. Починаючи з 7-ї доби визначено формування кісткової тканини, відносна площа якої збільшилася в 1,43 раза на 14-ту добу, а на 28-му вона повністю заповнювала дефект.
Тобто протягом перших двох тижнів після травми у зоні ушкодження проходять регенеративні процеси з утворенням органоспецифічних структур, проте механічні властивості регенерату залишаються недостатніми для первинного знерухомлення країв хрящового дефекту, що, як відомо, є основною передумовою для утворення в ньому хрящоподібної тканини. З цієї причини в перші два тижні після травми функціональне лікування може тільки затримати процес регенерації. З 14-ї доби констатовано інтенсивне формування кісткової тканини субхондральних зон, що є прогностично позитивною ознакою, від якої (що доведено) прямо залежить регенерація суглобового хряща. Цим маніфестуються ознаки готовності регенерату до моделювання кістково-хрящових дефектів. Протягом наступних двох тижнів продовжувалося моделювання суглобової поверхні, заповнення дефектів кістковою тканиною пластинчастої структури та формування волокнистого хряща; відновлення гіалінового хряща не відбувалося. За результатами експерименту видається коректним зробити висновок, що обґрунтованими строками початку функціонального лікування є період з початку третього та не пізніше кінця четвертого тижня після травми, що є оптимальним для реалізації ефекту функціонального ремоделювання ушкоджених суглобових поверхонь. Часові коливання в межах означеного періоду в 2–4 тижні можуть бути обумовлені індивідуальними особливостями ушкоджень та характером залишкових зміщень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Chan D.B., Jeffcoat D.M., Lorich D.G., Helfet D.L. Nonunions around the knee joint // International Orthopaedics. — 2010. — Vol. 34(2). — P. 271-281. — doi: 10.1007/s00264-009-0924-9.
2. Бэц И.Г., Стойко И.В. Хирургическое и функциональное ремоделирование суставной поверхности большеберцовой кости при переломах pilon // Ортопедия, травматология и протезирование. — 2015. — № 2. — С. 26-29.
3. Європейська конвенція про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей. Страсбург, 18 березня 1986 року: офіційний переклад [Електронний ресурс]. — Режим доступу: http: zakon.rada.gov.ua/cgi–bin/laws/main.cgi?nreg=994_137.
4. Про захист тварин від жорстокого поводження: Закон України № 3447-IV вiд 21.02.2006 р. [Електронний ресурс] / Верховна Рада України. — Режим доступу: http://zakon3.rada.gov.ua/laws/show/3447-15.
5. Саркисов Д.С., Перов Ю.Л. Микроскопическая техника. — М.: Медицина, 1996.
6. Gerwin N., Bendele A.M., Glasson S., Carlson C.S. The OARSI histopathology initiative — recommendations for histological assessments of osteoarthritis in the rat // Osteoarthritis and Cartilage. — 2010. — Vol. 3. — P. 24-34. — doi: 10.1016/j.joca.2010.05.030.
7. Лаврищева Г.И., Оноприенко Г.А. Морфологические и клинические аспекты репаративной регенерации опорных органов. — М.: Медицина, 1996.
8. Попсуйшапка О.К., Літвішко В.О., Ашукіна Н.О. Клініко-морфологічні стадії процесу зрощення відламків кістки // Ортопедия, травматология и протезирование. — 2015. — № 1. — С. 12-20. — doi: 10.15674/0030-59872015112-20.
9. Wang X., Friis T.E., Masci P.P., Crawford R.W., Liao W., Xiao Y. Alteration of blood clot structures by interleukin-1 beta in association with bone defects healing // Scientific Reports. — 2016. — Vol. 6. — P. 35645. — doi: 10.1038/srep35645.
10. Корж Н.A., Дедух Н.В. Репаративная регенерация кости: современный взгляд на проблему. Стадии регенерации (сообщение 1) // Ортопедия, травматология и протезирование. — 2006. — № 1. — С. 77-84.
11. Ашукіна Н.О. Регенерація кістково-хрящової рани при використанні кальцій-фосфатних керамік: автореф. дис… канд. біол. наук. — К., 2002.
12. Maehara H., Sotome S., Yoshii T. Repair of large osteochondral defects in rabbits using porous hydroxyapatite/collagen (HAp/Col) and fibroblast growth factor-2 (FGF-2) // Journal of Orthopaedic Research. — 2010. — Vol. 28(5). — P. 677-686. — doi: 10.1002/jor.21032.

/82-1.jpg)
/82-2.jpg)
/82-3.jpg)
/83-1.jpg)
/83-2.jpg)