Вступ
Останніми роками все більшу увагу клініцистів привертають розлади метаболізму сполучної тканини, які відіграють роль у патогенезі багатьох захворювань, особливо при наявності дисплазії сполучної тканини. Недиференційовані форми дисплазії сполучної тканини (НДСТ) досить поширені в загальній популяції та є частою складовою коморбідної патології [2–4]. Особливості метаболізму сполучної тканини та можливі механізми його порушення у хворих на цукровий діабет (ЦД) 2-го типу у поєднанні з НДСТ з урахуванням поширеності цих патологічних станів є цікавим як з теоретичної точки зору, так й з точки зору ранньої діагностики судинних ускладнень на підставі визначення інформативних маркерів спільних ушкоджень при НДСТ та ЦД 2-го типу [1, 4].
Потенційним маркером судинних уражень при ЦД 2-го типу у хворих з НДСТ може бути активність основного фактора росту (bFGF або FGF2), який бере участь у процесах проліферації, міграції та диференціювання основних клітинних елементів сполучної тканини, у формуванні позаклітинного матриксу та в процесах ангіогенезу [5, 6, 9]. Ці порушення є важливими в патогенезі багатьох, у тому числі судинних, захворювань, про що свідчать результати експериментальних і клінічних досліджень [7, 8, 10, 11].
Тому вивчення вмісту FGF2 у хворих на ЦД 2-го типу у поєднанні з НДСТ може бути корисним для з’ясування його патогенетичної ролі у розвитку артеріальної гіпертензії (АГ).
Мета дослідження — вивчення вмісту FGF2 в плазмі крові хворих на ЦД 2-го типу та АГ залежно від наявності НДСТ.
Матеріали та методи
Дослідження виконано в ендокринологічному відділенні Харківської обласної клінічної лікарні. У дослідження ввійшли 90 пацієнтів віком від 35 до 45 років, які знаходилися на лікуванні в період 2016–2018 рр. з діагнозом ЦД 2-го типу, тривалістю не більше 10 років.
Усім хворим виконано комплексне загальноклінічне, лабораторне та інструментальне обстеження під час надходження до стаціонару згідно з Наказом МОЗ України № 1118 від 21.12.2012 р. «Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги. Цукровий діабет 2 типу». Діагностику АГ здійснювали згідно з Наказом МОЗ України № 384 від 24.05.2012 р. «Артеріальна гіпертензія. Оновлена та адаптована клінічна настанова, заснована на доказах». Діаг–ностику НДСТ здійснювали шляхом комплекс–ного обстеження та оцінки наявності внутрішніх (вісцеральних) та зовнішніх (скелетних, шкірних, суглобових) ознак згідно з Т.І. Кадуріною (2009) [2]. Дослідження концентрації FGF2 в плазмі крові виконували імуноферментним методом.
Отримані результати оброблялися за допомогою пакета статистичних програм PSSР (відкрита програма, що не потребує ліцензії) з урахуванням рекомендацій до медико-біологічних досліджень.
Результати та обговорення
Перш за все проаналізовано вміст FGF2 в плазмі крові практично здорових людей — донори віком 35–45 років (у середньому 36,3 ± 3,1 року).
Встановлено, що вміст FGF2 в крові здорових донорів у середньому становив 5,75 ± 5,70 пг/мл, але був досить варіабельним — від 0,8 до 19,6 пг/мл. Перевірка даних за критерієм Колмогорова — Смирнова з поправкою Лільєфорса показала, що вони мали ненормальний розподіл, тому у подальшому аналізі були використані непараметричні методи оцінки, а при опису результатів використана медіана [25-й та 75-й квартиль] — 3,6 [1,9; 9,0] пг/мл. Більш наочно розкид індивідуальних значень наведено на рис. 1.
Тобто більшість індивідуальних значень знаходиться в межах 1,9–9,0 пг/мл. Наявність значень більше 10 пг/мл, можливо, є проявом прихованої патології, яка ще не реалізувалася клінічно значимими проявами.
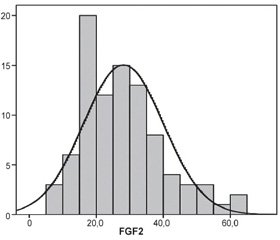
Аналіз вмісту FGF2 в крові хворих на ЦД 2-го типу виявив певні закономірності. Вміст FGF2 у всій виборці хворих, які ввійшли у дослідження (n = 90), у середньому становив 28,0 ± 11,9 пг/мл, або у вигляді медіани — 28,1 [18,7; 34,2] пг/мл з досить великим розкидом індивідуальних значень: від 7,4 до 63,2 пг/мл (табл. 1). При цьому перевірка на нормальність за критерієм Колмогорова — Смирнова не виявила вірогідної різниці з нормальним розподілом (р = 0,343) (рис. 2), але у зв’язку з ненормальним розподілом в групі контролю у подальшому для порівняння застосовано непараметричні критерії.
/47-1.jpg)
/46-2.jpg)
У хворих І групи (ЦД 2-го типу та НДСТ) медіана вмісту FGF2 становила 30,8 [21,6; 39,9] пг/мл — від 12,8 до 63,2 пг/мл. При цьому спостерігається тенденція до зростання в Іб групі (НДСТ з вісцеральними та скелетними ознаками) — 31,4 [20,5; 47,6] пг/мл (від 16,2 до 63,2 пг/мл) порівняно з Іа групою (НДСТ тільки з вісцеральними ознаками) — 30,3 [22,6; 39,7] пг/мл (від 12,8 до 56,2 пг/мл (p > 0,05 за критерієм Манна — Уїтні)).
Вміст FGF2 в І групі (як в Іа, так і в Іб) був вірогідно більшим, ніж в ІІ групі (хворі на ЦД 2-го типу без ознак ДТСТ), — 22,1 [16,2; 29,3] пг/мл (від 7,7 до 41,2 пг/мл).
Тобто при ЦД 2-го типу спостерігається зростання вмісту FGF2, у випадках поєднання ЦД з НДСТ воно вираженіше та більше, ніж у хворих без ознак НДСТ. Однак варто відмітити, що в окремих випадках індивідуальні значення майже не відрізнялись від контролю, а в окремих — в рази перевищували середні значення по групі, що може бути пов’язано з дією додаткових факторів.
Був проведений кореляційний аналіз рівня FGF2 в крові окремо в І та ІІ групі хворих (параметричним методом Пірсона), в результаті якого виявлені значні відмінності сили кореляційних зв’язків між групами. Аналіз проводився зі всіма доступними якісними та кількісними показниками, але далі наводяться тільки ті показники, які виявились вірогідними хоча б в одній групі: тривалість ЦД, вміст HbA1c у відсотках, наявність та вираженість АГ, наявність діабетичної нефропатії, величина швидкості клубочкової фільтрації (ШКФ), наявність діабетичної нефропатії, ступінь гіпертрофії лівого шлуночка, величина індексу маси міокарда лівого шлуночка. Ці показники було обрано у зв’язку з підтвердженою роллю в їх патогенезі порушень метаболізму сполучної тканини (табл. 2).
/47-3.jpg)
В результаті кореляційного аналізу вмісту FGF2 з іншими показниками виявлені цікаві відмінності. У І групі кореляція FGF2 з віком та тривалістю цукрового діабету була відсутня — r = 0,107 та r = 0,059 відповідно (р > 0,05). У ІІ групі, навпаки, виявлено вірогідну сильну позитивну кореляцію FGF2 з віком (r = 0,649, р < 0,001) та тривалістю ЦД (r = 0,357, р = 0,02). Ці закономірності відображено на рис. 3, 4.
На наш погляд, це свідчить про те, що при ізольованому ЦД 2-го типу вміст FGF2 зростає протягом захворювання, у той час як при наявності НДСТ у хворих на ЦД 2-го типу цієї залежності немає. Найбільш ймовірно, це пов’язано з початково збільшеними значеннями FGF2.
Наявність зв’язку FGF2 з віком при ЦД 2-го типу характеризує загальну тенденцію до зростання цього показника зі збільшенням віку. У хворих на ЦД 2-го типу та НДСТ цієї залежності також немає, що, ймовірно, пов’язано з розвитком субклінічних порушень метаболізму сполучної тканини у більш ранньому віці.
Іншою цікавою закономірністю є наявність статистично вірогідного кореляційного зв’язку вмісту FGF2 крові хворих на ЦД з наявністю та вираженістю АГ в обох групах: r = 0,564 (р = 0,001) та r = 0,413 (р = 0,006) відповідно в І та ІІ групі.
Також у хворих з наявністю НДСТ (І група) виявлено вірогідну негативну кореляцію з величиною ШКФ — r = –0,492 (р = 0,001), але невірогідну позитивну кореляцію з наявністю діабетичної нефропатії — r = 0,206 (р = 0,159). У пацієнтів ІІ групи (без наявності ознак НДСТ) кореляція з наявністю діабетичної нефропатії була вірогідною позитивною — r = 0,372 (р = 0,015), із ШКФ невірогідною слабкою негативною — r = –0,183 (р = 0,393).
Слід відмітити, що наявність та вираженість АГ з ознаками ниркової патології мали кореляції між собою: у І групі — вірогідна сильна негативна кореляція з величиною ШКФ — r = –0,725 (р ≤ 0,001) та вірогідна помітна позитивна кореляція з наявністю та виразністю діабетичної нефропатії — r = 0,451 (р = 0,001). У ІІ групі менш негативна кореляція з величиною ШКФ — r = –0,393 (р = 0,010) та вірогідна позитивна кореляція з наявністю та вираженістю діабетичної нефропатії — r = 0,506 (р = 001).
Висновки
1. FGF2 відіграє суттєву роль у виникненні АГ у хворих на ЦД 2-го типу, особливо при наявності клінічних ознак НДСТ.
2. В патогенезі АГ при ЦД 2-го типу суттєве значення також має діабетична нефропатія. У свою чергу, у розвитку діабетичної нефропатії також бере участь FGF2.
3. Виявлені зв’язки FGF2 та клінічних ознак НДСТ свідчать про можливість їх застосування як предикторів розвитку АГ у хворих на ЦД 2-го типу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Алимова И.Л., Пашинская Н.Б., Плескачевская Т.А. Особенности течения сахарного диабета 1 типа у детей и подростков на фоне дисплазии соединительной ткани // Медицинский вестник Северного Кавказа. — 2016. — 11(2). — С. 272-275.
2. Губанова М.В., Калашникова Л.А., Добрынина Л.А., Шамтиева К.В., Бердалин А.Б. Маркеры дисплазии соединительной ткани при диссекции магистральных артерий головы и провоцирующие факторы диссекции // Анналы клинической и экспериментальной неврологии. — 2017. — 11(4). — С. 19-28. DOI: 10.18454/ACEN.2017.4.2.
3. Земцовский Э.В., Малеев Э.Г. Малые аномалии сердца и диспластические фенотипы. — СПб.: Изд-во ИВЭСЭП, 2011. — 60 с.
4. Мартынова А.И., Нечаева Г.И. Национальные рекомендации Российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани. — М.: ООО «Бионика-Медиа», 2016. — 80 с.
5. Brewer J.R., Mazot P., Soriano P. Genetic insights into the mechanisms of Fgf signaling // Genes. Dev. — 2016. — 30. — Р. 751-771. doi: 10.1101/gad.277137.115.
6. Carter E.P., Fearon A.E., Grose R.P. Careless talk costs lives: fibroblast growth factor receptor signaling and the consequences of pathway malfunction // Trends Cell Biol. — 2015. — 25. — Р. 221-233. doi: 10.1016/j.tcb.2014.11.003.
7. House S.L., Wang J., Castro A.M., Weinheimer C., Kovacs A., Ornitz D.M. Fibroblast growth factor 2 is an essential cardioprotective factor in a closed-chest model of cardiac ischemia-reperfusion injury // Physiol. Rep. — 2015. — 3. — Р. e12278. doi: 10.14814/phy2.12278.
8. Kinoshita T., Ishikawa Y., Arita M., Akishima-Fukasawa Y., Fujita K., Inomata N. et al. Antifibrotic response of cardiac fibroblasts in hypertensive hearts through enhanced TIMP-1 expression by basic fibroblast growth factor // Cardiovasc. Pathol. — 2014 Mar-Apr. — 23(2). — Р. 92-100. doi: 10.1016/j.carpath.2013.11.001.
9. Ornitz D.M., Itoh N. The Fibroblast Growth Factor signaling pathway // Wiley Interdiscip. Rev. Dev. Biol. — 2015 May. — 4(3). — Р. 215-266. doi: 10.1002/wdev.176.
10. Svystonyuk D.A., Ngu J.M., Mewhort H.E., Lipon B.D., Teng G., Guzzardi D.G. et al. Fibroblast growth factor-2 regulates human cardiac myofibroblast-mediated extracellular matrix remodeling // J. Transl. Med. — 2015. — 13. — 147. doi: 10.1186/s12967-015-0510-4.
11. Wang Z.G., Wang Y., Huang Y., Lu Q., Zheng L., Hu D. еt al. bFGF regulates autophagy and ubiquitinated protein accumulation induced by myocardial ischemia/reperfusion via the activation of the PI3K/Akt/mTOR pathway // Sci. Rep. — 2015. — 5. — 9287. doi: 10.1038/srep09287.

/46-1.jpg)
/47-1.jpg)
/46-2.jpg)
/47-3.jpg)
/47-2.jpg)