Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Инсулиноподобный фактор роста 1 и хроническая болезнь почек у пациентов с сахарным диабетом 2-го типа
Авторы: Василькова О.Н.(1), Мохорт Т.В.(2), Науменко Е.П.(3), Коротаева Л.Е.(3), Филипцова Н.А.(3)
1 - Гомельский государственный медицинский университет, г. Гомель, Республика Беларусь
2 - Белорусский государственный медицинский университет, г. Минск, Республика Беларусь
3 - Республиканский научно-практический центр радиационной медицины и экологии человека, г. Гомель, Республика Беларусь
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Цукровий діабет (ЦД) і хронічна хвороба нирок (ХХН) — дві серйозні медичні і соціально-економічні проблеми останніх років, із якими зіткнулася світова спільнота в рамках пандемії хронічних хвороб. ХХН призводить не тільки до розвитку термінальної ниркової недостатності, що потребує призначення гемодіалізу та трансплантації нирок, але й до комплексних метаболічних і гормональних порушень в осі «гормон росту — інсуліноподібний фактор росту — інсуліноподібний фактор росту, зв’язуючий білок». Мета дослідження — оцінка зв’язку між рівнем інсуліноподібного фактора росту 1 (ІФР-1) в сироватці крові та швидкістю клубочкової фільтрації (ШКФ) у пацієнтів із ЦД 2-го типу. Матеріали та методи. У дослідженні взяли участь 150 пацієнтів із ЦД 2-го типу віком від 23 до 86 років. Контрольну групу становили 57 пацієнтів без ЦД, порівнянних за віком і статтю з основною групою. У процесі дослідження пацієнти з ЦД 2-го типу були класифіковані на три підгрупи залежно від стадії альбумінурії: перша підгрупа (стадія нормоальбумінурії) включала 38 осіб, до другої підгрупи (стадія мікроальбумінурії) увійшли 79 пацієнтів, третя підгрупа (стадія протеїнурії) — 33 пацієнти. Результати. Пацієнти на стадії нормоальбумінурії не відрізнялися за рівнем загального холестерину від пацієнтів групи контролю, однак пацієнти з ЦД 2-го типу на стадії мікроальбумінурії та протеїнурії мали більш високі значення загального холестерину. За рівнем тригліцеридів відмінності вже були помітні на стадії нормоальбумінурії: пацієнти з ЦД 2-го типу відрізнялися більш високим вмістом тригліцеридів порівняно з групою контролю. Рівень ІФР-1 зростав із збільшенням екскреції білка з сечею. Кореляційний аналіз показав вірогідний негативний зв’язок ІФР-1 і ШКФ і позитивний — із співвідношенням «альбумін/креатинін». Імовірність мати ШКФ < 50 мл/хв/1,73 м2 збільшувалася з підвищенням рівня ІФР-1. Висновки. Виявлена асоціація між підвищеним рівнем ІФР-1 і зниженим рівнем ШКФ у пацієнтів з ЦД 2-го типу. Подальші дослідження необхідні для того, щоб прояснити патогенетичні механізми цієї взаємодії.
Актуальность. Сахарный диабет (СД) и хроническая болезнь почек (ХБП) — две серьезные медицинские и социально-экономические проблемы последних лет, с которыми столкнулось мировое сообщество в раёёмках пандемий хронических болезней. ХБП приводит не только к развитию терминальной почечной недостаточности, требующей назначения гемодиализа и трансплантации почек, но и к комплексным метаболическим и гормональным нарушениям в оси «гормон роста — инсулиноподобный фактор роста — инсулиноподобный фактор роста, связывающий белок». Цель настоящего исследования — оценка связи между уровнем инсулиноподобного фактора роста 1 (ИФР-1) в сыворотке крови и скоростью клубочковой фильтрации (СКФ) у пациентов с СД 2-го типа. Материалы и методы. В исследовании приняли участие 150 пациентов с СД 2-го типа в возрасте от 23 до 86 лет. Контрольную группу составили 57 пациентов без СД, сопоставимых по возрасту и полу с основной группой. В ходе исследования пациенты с СД 2-го типа были классифицированы на три подгруппы в зависимости от стадии альбуминурии: первая подгруппа (стадия нормоальбуминурии) включала 38 человек, во вторую подгруппу (стадия микроальбуминурии) вошли 79 пациентов, третья подгруппа (стадия протеинурии) — 33 пациента. Результаты. Пациенты на стадии нормоальбуминурии не отличались по уровню общего холестерина от пациентов группы контроля, однако пациенты с СД 2-го типа на стадии микроальбуминурии и протеинурии имели более высокие значения общего холестерина. По уровню триглицеридов различия уже были заметны на стадии нормоальбуминурии: пациенты с СД 2-го типа отличались более высоким содержанием триглицеридов по сравнению с группой контроля. Уровень ИФР-1 возрастал с увеличением экскреции белка с мочой. Корреляционный анализ показал достоверную отрицательную связь ИФР-1 и СКФ и положительную — с отношением «альбумин/креатинин». Вероятность иметь СКФ < 50 мл/мин/1,73 м2 увеличивалась с повышением уровня ИФР-1. Выводы. Выявлена ассоциация между повышенным уровнем ИФР-1 и сниженным уровнем СКФ у пациентов с СД 2-го типа. Будущие исследования необходимы для того, чтобы прояснить патогенетические механизмы этого взаимодействия.
Background. Diabetes mellitus (DM) and chronic kidney disease (CKD) are two major medical and socio-economic problems of recent years that the world community has faced in the context of a chronic disease pandemic. CKH leads not only to the development of terminal renal failure, which requires the application of hemodialysis and kidney transplantation, but also to complex metabolic and hormonal disorders in the axis of growth hormone (GH) — insulin-like growth factor (IGF), binding protein (IGFBP) (GH — IGF — IFRBP). The purpose of the study was to evaluate the relationship between serum IGF-1 levels and glomerular filtration rate (GFR) in patients with type 2 DM. Materials and methods. The study involved 150 patients with type 2 DM, the age range of 23 to 86 years. The control group consisted of 57 patients without DM, matched by age and sex with the basic group. In the study, patients with type 2 DM were classified into three subgroups, depending on the stage of albuminuria: the first subgroup consisted of 38 persons with normalbuminuria, the second subgroup included 79 patients with microalbuminuria, the third subgroup consisted of 33 patients with proteinuria. Results. The patients with normal albuminuria did not differ in the level of total cholesterol from the patients in the control group, but the patients with type 2 DM with microalbuminuria and proteinuria had higher values of total cholesterol. By the level of triglycerides, the differences were already noticeable at the stage of normalbuminuria: the patients with type 2 DM had higher levels of triglycerides compared with the control group. The IGF-1 level elevated with increased urinary protein excretion. Correlation analysis showed a significant negative correlation between IGF-1 and GFR and positive one with albumin/creatinine levels. The probability of having GFR < 50 ml/min/1.73 m2 grew with an increase in IGF-1 levels. Conclusions. The elevated levels of IGF-1 and reduced levels of GFR in patients with type 2 DM were found to be associated. Further research is needed to clarify the pathogenetic mechanisms of this interaction.
цукровий діабет 2-го типу; хронічна хвороба нирок; інсуліноподібний фактор росту 1
сахарный диабет 2-го типа; хроническая болезнь почек; инсулиноподобный фактор роста 1
type 2 diabetes mellitus; chronic kidney disease; insulin-like growth factor-1
Введение
В последние десятилетия во всех странах мира отмечается стремительный рост численности пациентов, нуждающихся в проведении заместительной почечной терапии. Причина этого явления вполне очевидна: увеличение распространенности заболеваний, которые в первую очередь приводят к необратимой патологии почек. Это прежде всего сахарный диабет (СД) и артериальная гипертензия (АГ). В 2002 г. Национальный почечный фонд США (National Kidney Foundation) c целью унификации подходов к диагностике и лечению заболеваний почек предложил называть хронической болезнью почек (ХБП) структурные и функциональные изменения почек и/или снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 длительностью 3 месяца и более независимо от того, какие заболевания к ним привели [1].
На сегодняшний день СД и ХБП — две серьезные медицинские и социально-экономические проблемы последних лет, с которыми столкнулось мировое сообщество в рамках пандемий хронических болезней. ХБП приводит не только к развитию терминальной почечной недостаточности, требующей назначения гемодиализа и трансплантации почек, но и к комплексным метаболическим и гормональным нарушениям в оси «гормон роста (ГР) — инсулиноподобный фактор роста (ИФР) — инсулиноподобный фактор роста, связывающий белок (ИФРСБ)». Изменения в этой соматотропной гормональной оси ответственны за развитие многих важных осложнений при ХБП, одним из которых являются замедление катаболизма и прогрессирование заболевания.
Многие экспериментальные исследования показывают, что инсулиноподобный фактор роста 1 (ИФР-1) стимулирует почку, увеличивая кровоток и СКФ [1]. Данные клинических исследований не столь однозначны и даже противоречивы. Так, было показано, что у детей с ХБП уровень ИФР-1 в сыворотке крови ниже, чем у детей с нормальной СКФ [2, 3]. В то же время у взрослых пациентов со сниженной СКФ были выявлены достоверно более высокие уровни ИФР-1 и ИФРСБ-3, чем у пациентов контрольной группы. В другом исследовании у взрослых пациентов с ХБП и кахексией наблюдались низкие уровни ИФР-1 [4]. Учитывая вышеперечисленное, целью настоящего исследования стала оценка связи между уровнем ИФР-1 в сыворотке крови и СКФ у пациентов с СД 2-го типа.
Материалы и методы
В исследовании приняли участие 150 пациентов с СД 2-го типа в возрасте от 23 до 86 лет (средний возраст 54,69 ± 11,07 года), которые находились на лечении в эндокринологическом отделении ГУ «Республиканский научно-практический центр радиационной медицины и экологии человека» (РНПЦ РМ и ЭЧ) г. Гомеля. Контрольную группу составили 57 пациентов без СД, сопоставимых по возрасту и полу с основной группой.
Всем пациентам проводилось клиническое и лабораторное обследование, включающее исследование уровня гликированного гемоглобина (HbA1с), липидного спектра крови (общий холестерин, триглицериды, холестерин липопротеинов высокой (ХС ЛПВП), низкой (ХС ЛПВП) и очень низкой плотности). Оценивалась функция почек на основании содержания в сыворотке крови креатинина, подсчета СКФ по формуле CKD-EPI, –определения альбуминурии. ХБП диагностировалась при снижении СКФ менее 60 мл/мин/1,73 м2 согласно KDOQI [1].
В ходе исследования пациенты с СД 2-го типа были классифицированы на три подгруппы в зависимости от стадии альбуминурии: первая подгруппа (стадия нормоальбуминурии) (альбумин/креатинин (А/К) < 30 мг/г) включала 38 человек, во вторую подгруппу (стадия микроальбуминурии) (А/К 30–300 мг/г) вошли 79 пациентов, третья подгруппа (стадия протеинурии) (А/К > 300 мг/г) — 33 пациента.
Содержание ИФР-1 в сыворотке крови определяли иммуноферментным методом, используя тест-системы (IRMA, Immunotech, Чехия).
Статистическая обработка данных проводилась с использованием компьютерного статистического пакета smSTATA 14.2. В работе данные представляли в виде среднего ± стандартное отклонение. Качественные показатели представлялись в виде абсолютного числа наблюдений и доли (%) от общего числа пациентов по выборке в целом или в соответствующей группе. При отсутствии подчинения закону нормального распределения оцениваемых переменных, а также для оценки переменных в случае малых выборок использовали непараметрический критерий U-теста Манна — Уитни. За уровень статистической значимости принимали р < 0,05. Логистический регрессионный анализ проводился для определения взаимосвязи между ИФР-1 и стадией ХБП.
Результаты
Клиническая характеристика пациентов с СД 2-го типа и группы контроля приведена в табл. 1.
Из табл. 1 видно, что средний возраст обследованных пациентов с СД 2-го типа составил 54,69 ± 11,07 года. Основная и контрольная группы были сопоставимы по возрасту, индексу массы тела (ИМТ), уровню артериального давления (АД), показателям липидного спектра крови. Были получены достоверные различия лишь по уровню HbA1c (9,39 ± 1,85 против 5,38 ± 1,15 %, p < 0,001 соответственно).
Далее нами был проведен сравнительный анализ изучаемых параметров в зависимости от стадии альбуминурии (табл. 2). Пациенты на стадии нормоальбуминурии не отличались по уровню общего холестерина от пациентов группы контроля, однако пациенты с СД 2-го типа на стадии микроальбуминурии и протеинурии имели более высокие значения общего холестерина: 4,98 ± 1,38 и 5,38 ± 1,38 против 4,63 ± 1,12 и 4,72 ± 1,04 ммоль/л соответственно. По уровню триглицеридов различия уже были заметны на стадии нормоальбуминурии. Таким образом, пациенты с СД 2-го типа отличались более высоким содержанием триглицеридов по сравнению с группой контроля. Среди изучаемых групп достоверных различий по уровню ХС ЛПНП и ХС ЛПВП получено не было. Уровень ИФР-1 возрастал с увеличением экскреции белка с мочой. Так, у пациентов на стадии нормоальбуминурии он составил 118,03 ± 25,19 нг/мл, у пациентов на стадии микроальбуминурии — 203,44 ± 25,66 нг/мл и на стадии протеинурии — 221,64 ± 39,61 нг/мл (ANOVA, p = 0,001). Наглядно данная зависимость представлена на рис. 1.
Корреляционный анализ показал достоверную отрицательную связь ИФР-1 и СКФ (r = –0,64, p < 0,05) и положительную — с показателем «альбумин/креатинин» (r = 0,71, p = 0,001) (рис. 2).
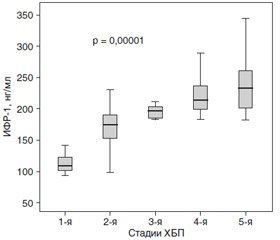
Учитывая корреляционную связь сывороточного ИФР-1 и СКФ, мы разделили пациентов с СД 2-го типа на группы согласно стадиям ХБП и обнаружили, что уровень сывороточного ИФР-1 достоверно возрастал с увеличением стадии ХБП и снижением СКФ (ANOVA, p = 0,00001) (рис. 3).
Чтобы прояснить связь между ИФР-1 и почечной дисфункцией, мы использовали модель логистической регрессии, скорректированную с учетом возраста пациентов. Используя сывороточную концентрацию ИФР-1 в качестве непрерывной переменной, мы наблюдали отсутствие достоверной связи между увеличением концентрации ИФР-1 и ХБП. Однако когда мы выбрали точки отсечения для СКФ (< 50, < 55, < 60, < 65 мл/мин/1,73 м2), связь между концентрацией сывороточного ИФР-1 и СКФ стала достоверной при использовании более низких пороговых значений СКФ, а именно: вероятность иметь СКФ < 50 мл/мин/1,73 м2 увеличивалась с повышением уровня ИФР-1 (1,76 [95% ДИ 1,27–2,45], р = 0,033) (рис. 4).
Обсуждение
В настоящем исследовании мы наблюдали связь между повышением ИФР-1 в сыворотке крови и снижением СКФ у пациентов с СД 2-го типа. Наши результаты подтверждают данные исследования NHANES III [5], в котором также была обнаружена положительная связь между концентрациями сывороточного ИФР-1 и риском ХБП. Тем не менее существуют и противоположные данные. Так, одно датское исследование выявило низкие концентрации свободного ИФР-1 и высокие уровни ИФРСБ-3 в сыворотке крови у пациентов с ХБП по сравнению со здоровыми лицами [6]. В этом же исследовании у пациентов с ХБП были обнаружены более высокие показатели общего ИФР-1, однако достоверности между группами получено не было.
У пациентов, находящихся на перитонеальном диализе и гемодиализе, были показаны значительно более высокие цифры ИФР-1 в сыворотке крови, чем у пациентов с нормальной функцией почек [7]. В другом исследовании [8] у пациентов с ХБП и различными типами почечной остеодистрофии уровень ИФР-1 в сыворотке крови не отличался от содержания его у здоровых субъектов. Принимая во внимание снижение почечного клиренса и, следовательно, увеличение периода полувыведения ИФР-1 при ХБП [9], можно ожидать повышения концентрации сывороточного ИФР-1. Также было показано, что при прогрессирующей почечной недостаточности ряд состояний, таких как метаболический ацидоз, может приводить к снижению концентрации ИФР-1 [10]. Объясняется это тем фактом, что измененная метаболическая среда при тяжелой ХБП влияет на секрецию гормонов и вызванную гормонами реакцию тканей-мишеней, вызывая эндокринные дисфункции [11].
Известно, что система «ГР — ИФР-1» может быть частью патогенеза ХБП как поддерживая состояние гипергликемии, так и действуя на местном, внутрипочечном уровне. Почка является местом активного синтеза ИФР-1 [12], кроме того, он поступает в ткань почек из циркуляции [13]. ИФР-1 может способствовать нарастанию массы почек на ранней стадии ХБП [14]. ИФР-1 может оказывать митогенный эффект на мезангиальные и гладкомышечные клетки сосудов, способствовать дезорганизации синтеза гликозаминогликанов, повышать скорость гломерулярной фильтрации и экскреции альбумина, снижать тонус приносящей артериолы клубочков и повышать их проницаемость для крупных молекул, способствовать накоплению 4-го типа коллагена и, соответственно, гломерулосклерозу [15–17].
В нашем исследовании уровень ИФР-1 отрицательно коррелировал с СКФ и положительно — с экскрецией альбумина/креатинина в моче. На самом деле работ по изучению связи концентрации ИФР-1 у пациентов с СД и ХБП немного. При этом однозначного ответа в этих работах не получено. Так, в ряде работ выявлено повышение экскреции ИФР-1 у пациентов с СД 1-го типа с ХБП по сравнению с пациентами с СД без ХБП и здоровой группой контроля [18]. В других работах не найдено корреляции между содержанием ИФР-1 в сыворотке крови и поражением почек [19, 20]. Считается, что связь между уровнем ИФР-1 в циркуляции и поражением почек не может быть явной из-за большого количества факторов, регулирующих его биодоступность, и из-за того, что почки сами вырабатывают ИФР-1, действующий пара- и аутокринно. Большую патогенетическую роль играет, вероятно, и интраренальный уровень ИФР-1.
Возможно, нам следует провести дальнейшее исследование с большей выборкой, чтобы подтвердить полученные результаты, так как вовлеченность системы «гипоталамус — гипофиз — ростовые факторы» в патогенез ХБП наряду с другими факторами несомненна, но полностью прояснить характер изменений в системе «ГР — ИФР» при ХБП, взаимо–связь их между собой и другими звеньями патогенеза еще предстоит в будущем. К тому же не стоит забывать и о СД, который сам по себе является мощным фактором неблагоприятных почечных событий.
Полученная достоверная связь между сниженной СКФ (менее 50 мл/мин/1,73 м2) и повышенным уровнем сывороточного ИФР-1 позволяет предположить, что ИРФ-1 может рассматриваться как индивидуальный индикатор риска и прогноза почечной дисфункции.
Следует отметить несколько лимитирующих факторов в нашем исследовании. Во-первых, объем выборки был относительно небольшим. Во-вторых, возможно, риск развития неблагоприятных почечных исходов на фоне СД нивелирует остальные факторы риска. В-третьих, мы не исследовали уровень протеинов, связывающих ИФР, не определяли уровни свободного ИФР-1 или ИФР-2, которые в полной мере могли бы подтвердить или опроверг–нуть полученные нами результаты.
Таким образом, при ранней или умеренной почечной недостаточности уровень ИФР-1 в сыворотке крови может быть повышен вследствие увеличения периода полувыведения ИФР-1 и может стать клинически значимым на более поздних стадиях почечной недостаточности. Однако все же мы предполагаем, что ИФР-1 в большей степени является биомаркером, а не фактором риска почечной патологии и отражает состояние здоровья, на которое также может влиять почечная дисфункция.
Выводы
Нами выявлена ассоциация между повышенным уровнем ИФР-1 и сниженным уровнем СКФ у пациентов с СД 2-го типа.
Будущие исследования необходимы для того, чтобы прояснить патогенетические механизмы этого взаимодействия.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Дополнительная информация. Работа выполнена при финансовой поддержке БРФФИ согласно договору № М17РМ-113 от 01.06.2017.
1. National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification and Stratification // Am. J. Kidney Dis. — 2002. — Vol. 39(1). — P. 1-266.
2. Wheatcroft S.B., Kearney M.T. IGF-dependent and IGF-independent actions of IGF-binding protein-1 and -2: implications for metabolic homeostasis // Trends Endocrinol Metab. — 2009. — Vol. 20(4). — P. 153-62. doi: 10.1016/j.tem.2009.01.002.
3. Ruan W., Lai M. Insulin-like growth factor binding protein: a possible marker for the metabolic syndrome? // Acta Diabetol. — 2010. — Vol. 47(1). — P. 5-14. doi: 10.1007/s00592-009-0142-3.
4. Atamer A., Ecder S.A., Akkus Z. et al. Relationship between leptin, insulin resistance, insulin-like growth factor-1 and insulin-like growth factor binding protein-3 in patients with chronic kidney disease // J. Int. Med. Res. — 2008. — Vol. 36. — P. 522-528.
5. Teppala S., Shankar A., Sabanayagam C. Association between IGF-1 and chronic kidney disease among US adults // Clinical and Experimental Nephrology. — 2010. — Vol. 14(5). — P. 440-444.
6. Tönshoff B., Blum W.F., Mehls O. Derangements of the somatotropic hormone axis in chronic renal failure // Kidney Int. Suppl. — 1997. — Vol. 58. — P. 106-113.
7. Carrero J.J., Chmielewski M., Axelsson J. et al. Muscle atrophy, inflammation and clinical outcome in incident and prevalent dialysis patients // Clin. Nutr. — 2008. — Vol. 27. — P. 557-564.
8. Correa P.N., Axelrad A.A. Production of erythropoietic bursts by progenitor cells from adult human peripheral blood in an improved serum-free medium: role of insulin-like growth factor 1 // Blood. — 1991. — Vol. 78. — P. 2823-2833.
9. Zapf J., Froesch E.R. Insulin-like growth factors/somatomedins: Structure, secretion, biological actions and physiological role // Horm. Res. — 1986. — Vol. 24. — P. 121-130.
10. Frystyk J., Ivarsen P., Skjaerbaek C. et al. Serum-free insulin-like growth factor I correlates with clearance in patients with chronic renal failure // Kidney Int. — 1999. — Vol. 56. — P. 2076-2084.
11. Iglesias P., Diez J.J., Fernandez-Reyes M.J. et al. Growth hormone, IGF-I and its binding proteins (IGFBP-1 and -3) in adult uraemic patients undergoing peritoneal dialysis and haemodialysis // Clin. Endocrinol. (Oxf.). — 2004. — Vol. 60. — P. 741-749.
12. Jehle P.M., Ostertag A., Schulten K. et al. Insulin-like growth factor system components in hyperparathyroidism and renal osteodystrophy // Kidney Int. — 2000. — Vol. 57. — P. 423-436.
13. Mahesh S., Kaskel F. Growth hormone axis in chronic kidney disease // Pediatr. Nephrol. — 2008. — Vol. 23. — P. 41-48.
14. Ballmer P.E., McNurlan M.A., Hulter H.N. et al. Chro–nic metabolic acidosis decreases albumin synthesis and induces negative nitrogen balance in humans // J. Clin. Invest. — 1995. — Vol. 95. — P. 39-45.
15. Schaefer F., Veldhuis J.D., Stanhope R. et al. Alterations in growth hormone secretion and clearance in peripubertal boys with chronic renal failure and after renal transplantation. Coope–rative Study Group of Pubertal development in Chronic Renal Failure // J. Clin. Endocrinol. Metab. — 1994. — Vol. 78. — P. 1298-1306.
16. Coleman M.E., DeMayo F., Yin K.C. et al. Myogenic vector expression of insulin-like growth factor I stimulates muscle cell differentiation and myofiber hypertrophy in transgenic mice // J. Biol. Chem. — 1995. — Vol. 270. — P. 12109-12116.
17. Roestenberg P., van Nieuwenhoven F.A., Joles J.A. et al. Temporal expressionprofile and distribution pattern indicate a role of connective tissue growth factor (CTGF/CCN-2) in diabetic nephropathy in mice // Am. J. Physiol. Renal. Physiol. — 2006. — Vol. 290. — P. 1344-1354.
18. Wang S., Denichilo M., Brubaker C., Hirschberg R. Connective tissue growth factor in tubulointerstitial injury of diabetic nephropathy // Kidney Int. — 2001. — Vol. 60. — P. 96-105.
19. Didushko O.M., Herych R.P., Cherniavska I.V., Yatsyshyn R.I., Pankiv V.I. Influence of the complex treatment of hypothyroidism on the leptin level in patients with primary hypothyroidism // World of Medicine and Biology. — 2018. — Vol. 3(65). — P. 59-63.
20. Guha M., Xu Z.G., Tung D. et al. Specific down-regulation of connective tissue growth factor attenuates progression of nephropathy in mouse models of type 1 and type 2 diabetes // FASEB J. — 2007. — Vol. 21. — P. 3355-3368.

/5-1.jpg)
/5-2.jpg)
/6-1.jpg)
/6-2.jpg)
/6-3.jpg)