Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Асоціація активності 5’АМФ-активованої протеїнкінази з тривалістю захворювання та вмістом HbA1c у лейкоцитах пацієнтів із цукровим діабетом
Авторы: Sokolova L.K., Pushkarev V.M., Belchina Yu.B., Pushkarev V.V., Vatseba T.S., Tronko N.D.
SI “V.P. Komisarenko Institute of Endocrinology and Metabolism of NAMS of Ukraine”, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. 5’АМФ-активована протеїнкіназа (АМФК) — фермент, який керує енергетичним балансом клітини. При енергетичному напруженні в клітині й збільшенні концентрації АМФ ATФ замінюється в обмінних центрах АМФ, що призводить до алостеричної активації АМФК фосфорилюванням треоніну-172 α-субодиницею LKB1-комплексу у відповідь на зміни в клітинній енергії або CAMKKβ, який активізує внутрішньоклітинний Ca2+. Мета дослідження — вивчити діяльність головного сенсора енергії клітини — АМФК у лейкоцитах пацієнтів, які отримують препарати інсуліну, метформін чи інші цукрознижувальні лікарські засоби залежно від тривалості хвороби й концентрації глікованого гемоглобіну (HbA1c). Матеріали та методи. Пацієнти з цукровим діабетом, які отримували моно- або комбіновану терапію інсуліном і його аналогами, метформіном, дапагліфлозином і похідними сульфонілсечовини, були розділені на 5 груп: перша — із рівнем HbA1c, близьким до норми, 6,9–7,6 %; друга — 7,6–9,0 %; третя — > 9 %; четверта — > 10 %; п’ята — > 11 %. Для визначення кількості фосфо-АМФК використали ІФА-набори. Результати. Встановлено, що зі збільшенням умісту HbA1c в крові рівень активностi АМФК у лейкоцитах поступово знижується. Активність АМФК у лейкоцитах пацієнтів із тривалістю захворювання ~ 20 років була втричі нижчою, ніж у хворих із 10-річним стажем. Збільшення цитозолей у відновленій формі відіграє центральну роль в управлінні аденозинмонофосфат-активованою протеїнкіназою. Високі умови харчування, такі як діабетичне середовище, збільшують співвідношення відновлених форм до окислених через каскади, включаючи поліольний шлях. Ця зміна окислювально-відновного потенціалу пов’язана з резистентністю до інсуліну й розвитком діабетичних ускладнень. Висновки. Таким чином, активність АМФК у лейкоцитах може бути індикатором діабетичної компенсації в пацієнтів із цукровим діабетом.
Актуальность. 5’АМФ-активированная протеинкиназа (АМФК) — фермент, который управляет энергетическим балансом клетки. При энергетическом напряжении в клетке и увеличении концентрации АМФ ATФ заменяется в обменных центрах АМФ, приводя к аллостерической активации АМФК фосфорилированием треонина-172 α-субъединицей LKB1-комплекса в ответ на изменения в клеточной энергии или CAMKKβ, который активизирует внутриклеточный Ca2+. Цель исследования — изучить деятельность главного сенсора энергии клеток — АМФК в лейкоцитах пациентов, получающих препараты инсулина, метформин и другие сахароснижающие лекарственные средства в зависимости от продолжительности болезни и концентрации гликированного гемоглобина (HbA1c). Материалы и методы. Пациенты с сахарным диабетом, получавшие моно- или комбинированную терапию инсулином и его аналогами, метформином, дапаглифлозином и производными сульфонилмочевины, были разделены на 5 групп: первая — с уровнем HbA1c, близким к норме, 6,9–7,6 %; вторая — 7,6–9,0 %; третья — > 9 %; четвертая — > 10 %; пятая — > 11 %. Для определения количества фосфо-АМФК использовали ИФА-наборы. Результаты. Установлено, что с увеличением количества HbA1c в крови уровень активности АМФК в лейкоцитах постепенно снижается. Активность АМФК в лейкоцитах пациентов с длительностью заболевания ~ 20 лет была в три раза ниже, чем у больных с 10-летним стажем. Увеличение цитозолей в восстановленной форме играет центральную роль в управлении аденозинмонофосфат-активированной протеинкиназой. Высокие условия питания, такие как диабетическая среда, увеличивают отношение восстановленных форм к окисленным через каскады, включая полиольный путь. Это изменение окислительно-восстановительного потенциала связано с резистентностью к инсулину и развитием диабетических осложнений. Выводы. Таким образом, активность АМФК в лейкоцитах может быть индикатором диабетической компенсации у пациентов с сахарным диабетом.
Background. 5’AMP-activated protein kinase (AMPK) is an enzyme that controls the cell energy balance. With energetic stress in the cell and an increase in the AMP concentration, ATP is replaced by AMP in the exchange centers, resulting in the allosteric activation of AMPK by phosphorylation of 172 threonine within alpha subunit of LKB1 complex in response to changes in cell energy or CAMKKβ, which activates intracellular Ca2+. The purpose was to study the activity of the main energy sensor of cells — AMPK in leukocytes in patients taking insulin preparations, metformin, and other hypoglycemic drugs in association with disease duration and glycated hemoglobin content. Materials and methods. The diabetic patients receiving single-drug or combined therapy with insulin and its analogues, metformin, dapagliflozin and sulfonylureas were randomized into 5 groups: the first group — with an HbA1c level close to the norm — 6.9–7.6 %; the second group — 7.6–9.0 %; the third group — > 9 %; the fourth group > 10 %; the fifth group — > 11 %. To determine the amount of phospho-AMPK (p-Thr172), ELISA kits were used. To get the calibration curve for the AMPK determination, a kidney cell culture HEK293T of the human embryonic kidney was used, which is recommended by manufacturer as a positive control. Results. It was shown that with increase of blood HbA1c, the level of AMPK activity in leukocytes gradually decreased. With increase of blood HbA1c, the level of AMPK activity in leukocytes gradually decreased. The activity of AMPK in leukocytes of patients with HbA1c > 11 % was more than 3.5-fold lower compared to the group with 6.9–7.6 % of HbA1c; AMPK activity in leukocytes in patients with disease duration of 20 years was 3-fold lower. Thus, the AMPK activity in leukocytes may be an indicator of diabetic compensation in diabetic patients. Conclusions. With increase of blood HbA1c, the level of p-AMPK in leukocytes gradually decreased. AMPK activity in leukocytes in diabetes patients with disease duration of 20 years was 3-fold lower than in patients with 10-year experience.
цукровий діабет; 5’АМФ-активована протеїнкіназа; глікований гемоглобін
сахарный диабет; 5’АМФ-активированная протеинкиназа; гликированный гемоглобин
diabetes mellitus; 5’AMP-activated protein kinase; glycated hemoglobin
Introduction
5’AMP-activated protein kinase (AMPK) is an enzyme that controls the cell energy balance. With energetic stress in the cell and an increase in the AMP concentration, ATP is replaced by AMP in the exchange centers, resulting in the allosteric activation of AMPK by phosphorylation of 172 threonine within alpha subunit of LKB1 complex in response to changes in cell energy or CAMKKβ, which activates intracellular Ca2+ [1–3].
By direct phosphorylation of metabolic enzymes and transcription factors, AMPK stimulates catabo–lic processes — absorption of glucose, fatty acids and their conversion by mitochondrial oxidation and glycolysis. In addition, AMPK suppresses anabolic processes — the synthesis of glucose, glycogen and lipids in the liver [4].
With type 2 diabetes mellitus (DM) and obesity, its activity decreases, and the activity of protein kinases mTORC1/p70S6K increases, leading to phosphorylation of IRS and insulin resistance [5].
HbA1c, the major fraction of glycated hemoglobin, is formed by irreversible non-enzymatic glycation. It is the key parameter for monitoring the regulation of DM and for assessing the risk of microvascular complications [6].
The purpose: taking into account the data obtained in clinical and experimental studies, we attempted to study the activity of the main energy sensor of cells — AMPK in leukocytes in patients taking insulin preparations, metformin, and other hypoglycemic drugs in association with disease duration and glycated hemoglobin content.
Materials and methods
The study was conducted in the Diabetology Department of the V.P. Komisarenko Institute of Endocrino–logy and Metabolism of NAMS of Ukraine. All patients signed informed consent to conduct further diagnostic and research study. Immediately after collection, the blood was layered over a layer of Histopaque 1077 (Sigma, USA) and centrifuged at RT in 15 ml conical Falcon™ tubes.
The leukocytes collected were washed and frozen at –80 °C until use. The cells were lysed in the extraction buffer with inhibitors of proteases and phosphatases. To determine the amount of phospho-AMPK (phospho-threonine 172), enzyme-linked immunosorbent assay (ELISA) kit ab154468 (Abcam, UK) was used. The stu–dies were carried out in triplets. The protein concentration in the lysate was determined using Novagen (USA) BCA protein assay kit. The measurements were carried out on a microplate reader (Bio-tek Instruments, USA) at a wavelength of 600 nm.
To get the calibration curve for the AMPK determination, a kidney cell culture HEK293T of the human embryonic kidney was used, which is recommended by manufacturer as a positive control. The OD values of samples obtained (0.005–0.04) are located on the calibration curve region almost perfectly coinciding with exponential theoretical curves that indicates no scattering of the data [7].
The results of the study are presented as M ± SD and M ± m, n = 31 (3–6 per group). To compare the data groups, Student’s t-test was used. Values of P ≤ 0.05 were considered as significant.
Results
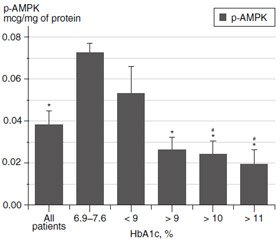
The patients received single-drug or combined the–rapy with insulin and its analogues, metformin, dapagliflozin and sulfonylureas. They were randomized into groups: the first group — with an HbA1c level close to the norm — 6.9–7.6 %; the second group — 7.6–9.0 %; the third group — > 9 %; the fourth group — > 10 %; the fifth group — > 11 %. In addition, the mean value for all patients (n = 31) was calculated.
AMPK activity was determined by the amount of phosphorylated Thr172 of α-subunit of the protein. Fig. 1 shows that the highest level of phospho-AMPK is observed in leukocytes in patients with low level of HbA1c — 6.9–7.6 %, which is not much higher than the indices recommended for diabetic patients, and can be considered as a condition close to compensatory. With increase of blood HbA1c, the level of p-AMPK gradually decreased. The activity of AMPK in leukocytes in patients with HbA1c > 11 % was more than 3.5-fold lower compared to group with HbA1c of 6.9–7.6 % (Fig. 1).
In the following, we calculated the AMPK activity in association with average duration of diabetes mellitus. Two groups of patients with DM duration of ~ 10 and ~ 20 years were selected.
The Table 1 demonstrates that AMPK activity in patients with disease duration ~ 20 years 3-fold lower than in patients with 10-year experience.
Discussion
Thus, regardless of the method of treatment AMPK activity may be related to the degree of diabetes mellitus compensation that reflects the level of glycated hemoglobin, with which kinase activity is linked by an inverse relationship.
It should be noted that leukocytes contain up to 11 % of monocytes/macrophages and up to 40 % of lymphocytes. Both types of cells and first of all macrophages are the main source of inflammatory effectors that promote diabetic atherosclerosis and myocardial infarction [8–10].
Oxidative metabolism determines the inflammatory status of macrophages and the processes that can occur before endoplasmic-reticulum stress and the formation of NLRP3-inflammasomes. AMPK is at the crossroads of the metabolic-mediated inflammation of macrophages, controls the metabolism of mitochondria and, consequently, can determine the inflammatory status of macrophages [11–14].
Conclusions
1. With increase of blood HbA1c amount, the level of p-AMPK in leukocytes gradually decreased.
2. AMPK activity in leukocytes in diabetic patients with disease duration ~ 20 years 3-fold lower than in patients with 10-year experience.
3. The AMPK activity in leukocytes may be an indicator of diabetic compensation and disease duration in patients.
Conflicts of interests. Authors declare no conflicts of interests that might be construed to influence the results or interpretation of their manuscript.
1. Ruderman N.B., Carling D., Prentki M., Cacicedo J.M. AMPK, insulin resistance, and the metabolic syndrome // J. Clin. Invest. — 2013. — Vol. 123 (7). — P. 2764-2772.
2. Xiao B., Sanders M.J., Underwood E. et al. Structure of mammalian AMPK and its regulation by ADP // Nature. — 2011. — Vol. 472 (7342). — P. 230-233.
3. Racioppi L., Means A.R. Calcium/calmodulin-dependent protein kinase kinase 2: roles in signaling and pathophysiology // J. Biol. Chem. — 2012. — Vol. 287 (38). — P. 31658-31665.
4. Jeong K.J., Kim G.W., Chung S.H. AMP-activated protein kinase: An emerging target for ginseng // J. Ginseng Res. — 2014. — Vol. 38. — P. 83-88.
5. Saha A.K., Xu X.J., Balon T.W. et al. Insulin resistance due to nutrient excess. Is it a consequence of AMPK downregulation? // Cell Cycle. — 2011. — Vol. 10 (20). — P. 3447-3451.
6. Kojić D.S., Đerić M., Kojić E.N. Glycated hemoglobin A1c as a modern biochemical marker of glucose regulation // Med. Pregl. — 2014. — Vol. 67 (9-10). — P. 339-344.
7. Sokolova L.K., Pushkarev V.M., Belchina Y.B. et al. Effect of combined treatment with insulin and metformin on 5’AMP-activated protein kinase activity in lymphocytes of diabetic patients // Rep. Nat. Acad. Sci. Ukraine. — 2018. — Vol. 5. — P. 100-104.
8. Steinberg G.R., Schertzer J.D. AMPK promotes macrophage fatty acid oxidative metabolism to mitigate inflammation: implications for diabetes and cardiovascular disease // Immunol. Cell Biol. — 2014. — Vol. 92 — P. 340-345.
9. Pushkarev V.M., Sokolova L.K., Pushkarev V.V., Tronko M.D. The role of AMPK and MTOR in the development of insulin resistance and type 2 diabetes. The mechanism of metformin action // Probl. Endocr. Pathol. — 2016. — Vol. 3. — P. 77-90.
10. Galic S., Fullerton M.D., Schertzer J.D. et al. Hematopoietic AMPK β1 reduces mouse adipose tissue macrophage inflammation and insulin resistance in obesity // J. Clin. Investig. — 2011. — Vol. 121. — P. 4903-4915.
11. Hardie D.G., Ross F.A., Hawley S.A. AMP-activated protein kinase: a target for drugs both ancient and modern // Chem. Biol. — 2012. — Vol. 19. — P. 1222-1236.
12. Klok M.D., Jakobsdottir S., Drent M.L. The role of leptin and ghrelin in the regulation of food intake and body weight in humans: a review // Obes. Rev. — 2007. — Vol. 8 (1). — P. 21-34.
13. Galic S., Oakhill J.S., Steinberg G.R. Adipose tissue as an endocrine organ // Mol. Cell Endocrinol. — 2010. — Vol. 316 (2). — P. 129-39. doi: 10.1016/j.mce.2009.08.018.
14. Kirchner H., Heppner K.M., Tschöp M.H. The role of ghrelin in the control of energy balance // Handb. Exp. Pharmacol. — 2012. — Vol. 209. — P. 161-84. doi: 10.1007/978-3-642-24716-3_7.

/24-1.jpg)