Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Основні синдроми гіперандрогенії в жінок: патогенез, диференціальна діагностика (огляд літератури та власні спостереження)
Авторы: Ляшук П.М., Ляшук Р.П.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Синдром гіперандрогенії — патологічний стан, зумовлений надмірною продукцією андрогенів яєчниками і/або наднирковими залозами чи підвищеною локальною тканинною чутливістю до циркулюючих андрогенів. Це найбільш часта ендокринопатія в жінок. Важливість своєчасної діагностики гіперандрогенних станів зумовлена їх наслідками: андрогензалежною дермопатією, порушеннями менструального циклу, ендокринною безплідністю, підвищеним ризиком невиношування вагітності, передчасними пологами, гестаційним діабетом. Поширеність та можливі наслідки гіперандрогенії в жінок репродуктивного віку зумовлюють важливість своєчасної диференціальної діагностики основних синдромів гіперандрогенних станів — адреногенітального синдрому та синдрому полікістозних яєчників. Оскільки в симптоматиці цих синдромів є багато спільного, то на підставі даних огляду літератури і власних спостережень доповнена диференціальна діагностика і подана у вигляді оригінальної таблиці, що певною мірою допоможе ендокринологам і гінекологам розмежовувати ці патологічні стани.
Синдром гиперандрогении — патологическое состояние, обусловленное избыточной продукцией андрогенов яичниками и/или надпочечниками или повышенной локальной тканевой чувствительностью к циркулирующим андрогенам. Это наиболее частая эндокринопатия у женщин. Важность своевременной диагностики гиперандрогенных состояний обусловлена их последствиями: андрогенной дермопатией, нарушениями менструального цикла, эндокринным бесплодием, повышенным риском невынашивания беременности, преждевременными родами, гестационным диабетом. Распространенность и возможные последствия гиперандрогении у женщин репродуктивного возраста обусловливают важность своевременной дифференциальной диагностики основных синдромов гиперандрогенных состояний — адреногенитального синдрома и синдрома поликистозных яичников. Поскольку в симптоматике этих синдромов много общего, то на основании данных обзора литературы и собственных наблюдений дополнена дифференциальная диагностика и представлена в виде оригинальной таблицы, которая в определенной степени поможет эндокринологам и гинекологам разграничивать эти патологические состояния.
Hyperandrogenic syndrome is a pathological condition caused by an excessive production of androgens by ovaries and/or adrenal glands or increased local tissue sensitivity to circulating androgens. This is the most common endocrinopathy in women. The importance of timely diagnosis of hyperandrogenic states is due to their consequences: androgen-dependent dermopathy, menstrual disorders, endocrine infertility, increased risk of non-pregnancy, preterm labor, gestational diabetes. The prevalence and possible consequences of hyperandrogenism in women of reproductive age predetermine the importance of timely differential diagnosis of the major syndromes of hyperandrogenic states — adrenogenital syndrome and polycystic ovary syndrome. Since the symptoms of these syndromes have much in common, based on the data of literature review and own observations, a differential diagnosis is supplemented and presented in the form of an original table that to some extent will help endocrinologists and gynecologists to distinguish between these pathological conditions.
адреногенітальний синдром; полікістоз яєчників; репродуктивна функція; патогенез; диференціальна діагностика; огляд
адреногенитальный синдром; поликистоз яичников; репродуктивная функция; патогенез; дифференциальная диагностика; обзор
adrenogenital syndrome; polycystic ovaries; reproductive function; pathogenesis; differential diagnosis; review
Вступ
Частою причиною порушень репродуктивної системи в жінок фертильного віку є синдром гіпер–андрогенії (ГА). ГА — це симптомокомплекс порушень у сфері специфічних і метаболічних ефектів андрогенів у жіночому організмі, зумовлений порушенням їх біосинтезу, транспорту та метаболізму [1, 2]. Поширеність ГА серед жінок становить 10–20 %. До основних ГА належать адреногенітальний синдром (АГС, уроджена гіперплазія кори надниркових залоз) та синдром полікістозу яєчників (СПЯ). Джерелом андрогенів у жінок є яєчники (клітини оваріальної строми, хілюсні клітини і клітини внутрішньої теки) та сітчаста зона кори надниркових залоз (НЗ), а при вагітності — і плацента [3]. Головними андрогенами НЗ є дегідроепіандростерон (ДГЕА) і його сульфат (ДГЕА-С) та незначна кількість тестостерону [4]. НЗ продукують 70 % ДГЕА і 95 % ДГЕА-С, а яєчники — 30 і 5 % відповідно. Рівень у крові ДГЕА-С вважається маркером надниркової продукції андрогенів. Основними яєчниковими андрогенами є андростендіон і тестостерон. Андро–стендіол у 30 % жінок надниркового походження, у 30 % — яєчникового, у 40 % — із конверсії з ДГЕА [3–5]. Периферичне взаємоперетворення яєчникових і надниркових гормонів призводить до трансформації низькоактивних андрогенів у більш активні: з ДГЕА та ДГЕА-С в андростендіон і в кінцевому результаті в тестостерон і дигідротестостерон [3, 6].
Андрогени є безпосередніми учасниками функціонування жіночого організму, вони різноманітно впливають на всі ланки репродуктивної функції [5], проте до сьогодні немає єдиної думки щодо механізмів, які призводять до порушень функціонування та регуляції репродуктивної системи [6, 7]. Оскільки основними продуцентами андрогенів є НЗ і яєчники [6, 8], то виділяють надниркову, яєчникову та змішану форми, а також ГА, зумовлену підвищеною периферичною андрогенною активністю або підвищеною чутливістю тканин-мішеней до андрогенів (рецепторна форма) [5, 9]. Крім того, може відзначатися порушення зв’язку тестостерону з білками крові, а отже, зростання рівня вільного гормона в крові [7].
У літературі також описано випадки ятрогенної ГА, пов’язаної з прийманням медикаментозних засобів, що мають андрогенні властивості: анаболічних стероїдів, допінгових препаратів, гестагенів — похідних 19-стероїдів, антигонадотропних препаратів, глюкокортикоїдів, транквілізаторів і протиепілептичних засобів, циклоспоринів, інтерферону тощо [5, 10].
Надниркова ГА може бути зумовлена гіперплазією або пухлиною кори НЗ [5, 11–13]. Найчастіше патологія НЗ проявляється у вигляді АГС [14]. Зміни в яєчниках, що призводять до ГА, також можуть бути пухлинними і непухлинними (функціональними). Із непухлинних форм найчастішою причиною ГА є СПЯ [8, 9].
Адреногенітальний синдром
Адреногенітальний синдром — група ендокринних захворювань з аутосомно-рецесивним типом успадкування, в основі яких лежить дефект одного з ферментів або транспортних білків, що беруть участь у біосинтезі кортизолу в пучковій зоні кори НЗ. За дефектами цих ферментів у сучасній ендокринології розрізняють 7 типів АГС, що впливають на статевий розвиток і фертильність обох статей (внутрішньоутробно, в пубертатному або, рідше, в зрілому віці) [7, 15, 16]. В 90–95 % випадків розвиток недуги зумовлений дефектом гена CYP21, що кодує фермент 21-гідроксилазу [15, 16]. Різні форми її недостатності пов’язані з певними HLA-гаплотипами. 21-гідроксилаза бере участь у стероїдогенезі, тому її дефіцит знижує продукцію в основному кортизолу, що за принципом оберненого зв’язку призводить до надмірної секреції адренокортикотропного гормона (АКТГ) і, відповідно, андрогенів сітчастою зоною кори НЗ, шлях біосинтезу яких не заблокований. Настає гіперплазія НЗ за рахунок сітчастої зони. Зниження продукції кортизолу призводить до накопичення його попередників (17-гідроксипрогестерон (17-ОН-П), прегненолон, прогестерон), які в надлишкових концентраціях конвертуються в надниркові андрогени — ДГЕА, андростендіол, тестостерон. ГА, зі свого боку, гальмує продукцію гіпофізом гонадотропінів, зокрема фолітропіну, внаслідок чого настають порушення росту і дозрівання фолікулів у яєчниках (мультифолікулярні яєчники за даними ультразвукової діагностики), порушення менструального циклу, невиношування вагітності, ендокринна безплідність [2, 6, 10].
Залежно від вираженості недостатності 21-гідроксилази й зумовленого нею порушення діяльності НЗ розрізняють класичну (вірильна і сіль-утратна) та некласичну форми АГС. Класичний фенотип АГС виявляється в немовлят та підлітків у період фізіологічного посилення гормональної функції кори НЗ, що на 2–3 роки випереджає появу менархе. Некласична форма АГС спостерігається зазвичай у віці понад 20 років, часто після мимовільного викидня чи медичного аборту. 17-ОН-П — маркер дефіциту 21-гідроксилази: вміст його в крові > 100 нг/мл свідчить про класичну форму АГС, а 10–100 нг/мл підтверджує діагноз некласичної форми, пограничне значення — 2–10 нг/мл потребує проведення додаткового стимуляційного тесту із синактеном (синтетичним аналогом АКТГ). При цьому рівень 17-ОН-П > 10 нг/мл свідчить про наявність некласичної форми АГС. У сумнівних випадках проводять молекулярно-генетичний аналіз (мутації в гені CYP21 вказують на наявність захворювання) [6].
Синдром полікістозних яєчників
Синдром полікістозних яєчників — ендокринопатія, що трапляється в 5–10 % жінок репродуктивного віку і становить до 80 % від усіх форм ГА. Провідною теорією синдрому раніше була центральна теорія, згідно з якою захворювання зумовлене порушенням ритму секреції люліберину, що призводить до гіперпродукції лютропіну при відносно низькому рівні фолітропіну. Під дією лютропіну відбуваються стимуляція і гіперплазія клітин теки і строми яєчників, в яких надмірно синтезуються яєчникові андрогени. Це призводить до шкірних проявів андрогенізації, ановуляції і порушення ритму менструації, а також активації синтезу естрогенів у жировій тканині, які сприяють проліферації адипоцитів й ожирінню [8, 17–19].
Новий підхід у поясненні патогенезу СПЯ зводиться до провідної ролі інсулінорезистентності, що зумовлена пострецепторними вимірами інсулінових рецепторів. Відомо, що інсулін є не лише основним глюкорегулюючим гормоном, він може справляти цілу низку інших біологічних ефектів, які призводять до порушення гонадотропної функції гіпофіза, до ГА [2, 20]. Можливо, причиною виникнення інсулінорезистентності та ГА є один і той самий генетичний дефект. Андрогени зменшують ароматазну активність клітин гранульози, сприяючи атрезії фолікулів, ановуляції і порушенню ритму менструації, первинній безплідності. Дослідження останніх років продемонстрували, що СПЯ є складовою частиною метаболічного синдрому [20, 21].
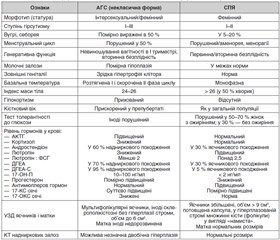
У клінічній картині вищезгаданих синдромів є багато спільного, тому зрозуміла необхідність у проведенні диференціальної діагностики. Нами опубліковані диференційно-діагностичні ознаки класичного варіанту АГС і СПЯ [22]. Оскільки симптоматика некласичної форми АГС неодно–значна і трапляється вона значно частіше класичної [6], то в запропонованій оригінальній таблиці наведена диференціація між некласичною формою АГС і первинним СПЯ. Некласична форма та СПЯ приблизно в 10 % випадків поєднуються, тому що зміни функціонального стану кори НЗ відбиваються на функції статевих залоз, і навпаки [5, 23].
Висновки
1. Гіперандрогенія (надниркова, у 80 % — яєчникова) — основна причина порушення функціонування репродуктивної системи в жінок фертильного віку.
2. Наведені диференціально-діагностичні ознаки адрогенітального синдрому та синдрому полікістозних яєчників певною мірою допоможуть клініцистам розмежовувати ці синдроми.
Конфлікт інтересів. Автори констатують відсутність конфлікту інтересів при підготовці даної статті.

/65-1.jpg)