Журнал «Медицина неотложных состояний» №3(98), 2019
Вернуться к номеру
Динаміка маркерів клітинної ланки імунітету у хворих з підвищеним індексом маси тіла при політравмі
Авторы: Кучерявченко В.В.(1, 2), Волкова Ю.В.(1, 2)
(1) — Харківський національний медичний університет, м. Харків, Україна
(2) — Харківська міська клінічна лікарня швидкої невідкладної медичної допомоги імені проф. О.І. Мещанінова, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Імунна система є сукупністю лімфоїдної тканини, яка у взаємозв’язку з іншими адаптаційними системами організму здійснює специфічний антигенно-структурний гомеостаз внутрішнього середовища. Тому мета цього дослідження — вивчення динаміки маркерів клітинної ланки імунітету у хворих з підвищеним індексом маси тіла (ІМТ) при політравмі. Матеріали та методи. У 224 хворих з політравмою з різною стартовою цифрою ІМТ в період 1-ша доба — 1 рік з моменту отримання ушкоджень був проаналізований імунологічний стан — субпопуляційний склад лімфоцитів. Пацієнти мали однакову тяжкість стану на момент надходження за шкалою АРАСНЕ ІІ — 14,0 ± 5,8 бала і були розподілені на 3 стратифіковані клінічні групи залежно від стартових цифр антропометричних показників та ІМТ. Так, у І групу ввійшли 88 пацієнтів з ІМТ на момент надходження до 29,9 (26,1 ± 3,1) кг/м2; у ІІ групу — 84 хворі з ІМТ на момент надходження 30,0–39,9 (35,2 ± 3,8) кг/м2; у ІІІ групу — 52 хворі з ІМТ на момент надходження > 40,0 (46,2 ± 5,8) кг/м2. Контрольну групу становили 60 добровольців. Дослідження проводилося на 1-шу, 3-тю, 7-му, 14, 30 та 360-ту добу від моменту отримання політравми. Результати. Для хворих з ІМТ ≥ 29,9 кг/м2 характерний короткочасний слабковиражений дисбаланс регуляторних Т-клітин і Т-дефіцит, що максимально проявляється в перший тиждень захворювання, має пристосувальний характер, раннє відновлення (до 14-ї доби) функцій клітинного імунітету, відсутність слідової реакції у віддалені терміни. Для хворих з ІМТ 30,0–39,9 кг/м2 характерний Т-дефіцит, що максимально проявляється протягом першого місяця, поєднується з незначним дисбалансом субпопуляцій Т-лімфоцитів, зниженням мембранних функцій цих клітин в строки до 1 місяця, наявністю віддаленої неінтенсивної слідової реакції у вигляді зниження кількості Т-лімфоцитів, Т-супресорів, Т-активних лімфоцитів до нижньої межі нормальних значень, високоамплітудного коливання Т-хелперів/індукторів, порушенням мембранних функцій в строки до 1 року. Для хворих з ІМТ ≥ 40,0 кг/м2 характерним є Т-дефіцит у всі строки обстеження з максимально вираженою інтенсивністю. Найбільші його прояви були визначені в перший місяць хвороби і зберігалися навіть до 1 року. Відзначено зниження Т-лімфоцитів на 40 % і більше від нормальних значень, яке зберігалося більш одного тижня і не мало тенденції до подальшого зростання, прогресуюче зниження Т-активних лімфоцитів більше ніж на 40 %, що супроводжувалося вираженим порушенням взаємодії регуляторних Т-клітин (Т-хелперів і Т-супресорів). Висновки. Таким чином, у хворих з підвищеним індексом маси тіла кожної із груп порівняння була виявлена індивідуальна відповідь на механічну травму, що, найімовірніше, обумовлене стартовим ІМТ досліджуваних пацієнтів.
Актуальность. Иммунная система представляет собой совокупность лимфоидной ткани, которая во взаимосвязи с другими адаптационными системами организма осуществляет специфический антигенно-структурный гомеостаз внутренней среды. Поэтому цель данного исследования — изучение динамики маркеров клеточного звена иммунитета у больных с повышенным индексом массы тела (ИМТ) при политравме. Материалы и методы. У 224 больных с политравмой с разной стартовой цифрой ИМТ в период 1-й день — 1 год с момента получения повреждений было проанализировано иммунологическое состояние — субпопуляционный состав лимфоцитов. Пациенты имели одинаковую тяжесть состояния на момент поступления по шкале АРАСНЕ ІІ — 14,0 ± 5,8 балла и были распределены на 3 стратифицированные клинические группы в зависимости от стартовых цифр антропометрических показателей и ИМТ. Так, в I группу вошли 88 пациентов с ИМТ на момент поступления до 29,9 (26,1 ± 3,1) кг/м2; во II группу — 84 больных с ИМТ на момент поступления 30,0–39,9 (35,2 ± 3,8) кг/м2; в III группу — 52 больных с ИМТ на момент поступления > 40,0 (46,2 ± 5,8) кг/м2. Контрольную группу составили 60 добровольцев. Исследование проводилось на 1-е, 3-и, 7, 14, 30 и 360-е сутки с момента получения политравмы. Результаты. Для больных с ИМТ ≥ 29,9 кг/м2 характерен кратковременный слабовыраженный дисбаланс регуляторных Т-клеток и Т-дефицит, что максимально проявляется в первую неделю заболевания, носит приспособительный характер, раннее восстановление (до 14-х суток) функций клеточного иммунитета, отсутствие следовой реакции в отдаленные сроки. Для больных с ИМТ 30,0–39,9 кг/м2 характерен Т-дефицит, что максимально проявляется в течение первого ее месяца, сочетается с незначительным дисбалансом субпопуляций Т-лимфоцитов, снижением мембранных функций этих клеток в сроки до 1 месяца, наличием удаленной неинтенсивной следовой реакции в виде снижения количества Т-лимфоцитов, Т-супрессоров, Т-активных лимфоцитов до нижней границы нормальных значений, высокоамплитудные колебания Т-хелперов/индукторов, с нарушением мембранных функций в сроки до 1 года. Для больных с ИМТ ≥ 40,0 кг/м2 характерен Т-дефицит во все сроки обследования с максимально выраженной интенсивностью. Наибольшие его проявления были определены в первый месяц болезни и сохранялись даже до 1 года. Отмечено снижение Т-лимфоцитов на 40 % и более от нормальных значений, которое сохранялось более одной недели и не имело тенденции к дальнейшему росту, прогрессирующее снижение Т-активных лимфоцитов более чем на 40 %, что сопровождалось выраженным нарушением взаимодействия регуляторных Т-клеток (Т-хелперов и Т-супрессоров). Выводы. Таким образом, у больных с повышенным индексом массы тела в каждой из групп сравнения был обнаружен индивидуальный ответ на механическую травму, что, скорее всего, обусловлено стартовым ИМТ исследуемых пациентов.
Background. The immune system is a collection of lymphoid tissue, which, in conjunction with other adaptation systems of the body, provides specific antigenic-structural homeostasis of the internal environment. Therefore, the purpose was to study the dynamics of markers of cellular immunity in patients with an increased body mass index (BMI) in polytrauma. Materials and methods. In 224 polytrauma patients with different baseline BMI, the immunological state (the subpopulation composition of lymphocytes) was analyzed in the period of 1 day — 1 year from the date of injury. Severity of patients’ condition was the same at the time of admission — 14.0 ± 5.8 on the APACHE II score. Patients were divided into 3 clinical groups, depending on the baseline anthropometric indicators and BMI. Thus, group I included 88 individuals with BMI at admission of 29.9 (26.1 ± 3.1) kg/m2, group II — 84 patients with BMI at admission of 30.0–39.9 (35.2 ± 3.8) kg/m2, group III — 52 persons with BMI at admission > 40.0 (46.2 ± 5.8) kg/m2. The control group consisted of 60 volunteers. The study was conducted on 1, 3, 7, 14, 30 and 360 days from the moment of polytrauma. Results. Patients with BMI ≥ 29.9 kg/m2 were characterized by short-term mild imbalance of regulatory T-cells and T-deficiency that was most significant in the first week of the disease and had adaptive nature; early recovery (up to 14 days) of cellular immunity functions; the absence of long-term aftersensation. Patients with BMI of 30.0–39.9 kg/m2 had T-deficiency, which was most pronounced during its first month, combined with a slight imbalance of T-lymphocyte subpopulations, a decline in the membrane functions of these cells for up to 1 month, and the presence of a remote non-intensive aftersensation in the form of reduced number of T-lymphocytes, T-suppressors, T-active lymphocytes to the lower limit of normal values, high-amplitude fluctuations of T-helper/inductors, with a violation of membrane functions for up to 1 year. For patients with BMI ≥ 40.0 kg/m2, T-deficiency is typical in all periods of the examination with the most pronounced intensity. Its manifestations were greatest during the first month of the disease and persisted even up to 1 year. There was a decrease in T-lymphocytes by 40 % or more of normal values, which persisted for more than one week and did not have a tendency to further growth, a progressive decrease in T-active lymphocytes by more than 40 % that was accompanied by a pronounced violation of the interaction of regulatory T-cells (T-helpers and T-suppressors). Conclusions. Thus, in patients with increased BMI, in each of the comparison groups, an individual response to mechanical injury was detected, which is most likely due to the baseline BMI of the examined patients.
клітинна ланка імунітету; підвищений індекс маси тіла; політравма
клеточное звено иммунитета; повышенный индекс массы тела; политравма
cellular immunity; increased body mass index; polytrauma
Вступ
Відомо, що можливість успішного лікування хворих з політравмою, насамперед з підвищеним індексом маси тіла (ПІМТ), багато в чому залежить від стану захисних сил організму, враховуючи сприяння травматичної хвороби порушенню принципів зберігання цілісності індивідуальних структурних властивостей організму в цілому [1–3]. Із збільшенням ІМТ знижується загальна імунобіологічна активність, компліментарна активність сироватки, фагоцитарна активність лейкоцитів, частішають автоімунні реакції [4–6].
Враховуючи, що імунна система є сукупністю лімфоїдної тканини, яка у взаємозв’язку з іншими адаптаційними системами організму здійснює специфічний антигенно-структурний гомеостаз внутрішнього середовища [7, 8], важливим є детальне вивчення узгодженості дій різних її елементів і процесів, що виникають в різні періоди травматичної хвороби залежно від ступеня її тяжкості саме у постраждалих з ПІМТ [9–11].
Мета цього дослідження — вивчити динаміку маркерів клітинної ланки імунітету у хворих з підвищеним індексом маси тіла при політравмі.
Матеріали та методи
У 224 хворих з політравмою з різною стартовою цифрою ІМТ в період 1-ша доба — 1 рік з моменту отримання ушкоджень був проаналізований імунологічний стан — субпопуляційний склад лімфоцитів, що здійснювали шляхом послідовного розгляду його окремих ланок. Пацієнти, які були обрані для вивчення клініко-патогенетичних аспектів перебігу травматичної хвороби, мали однакову тяжкість стану на момент надходження за шкалою АРАСНЕ ІІ — 14,0 ± 5,8 бала і були розподілені на 3 стратифіковані клінічні групи залежно від стартових цифр антропометричних показників та ІМТ. Так, у І групу ввійшли 88 пацієнтів (54 чоловіки, 34 жінки) з ІМТ на момент надходження до 29,9 (26,1 ± 3,1) кг/м2; у ІІ групу — 84 хворі (48 чоловіків, 36 жінок) з ІМТ на момент надходження 30,0–39,9 (35,2 ± 3,8) кг/м2; у ІІІ групу — 52 хворі (32 чоловіки, 20 жінок) з ІМТ на момент надходження > 40,0 (46,2 ± 5,8) кг/м2.
Контрольну групу становили 60 добровольців, які спочатку розподілялися на 3 групи: з ІМТ до 29,9 кг/м2, з ІМТ 30,0–39,9 кг/м2 і з ІМТ > 40,0 кг/м2. Але після аналізу отриманих показників на фоні відсутності вірогідної різниці між цифрами отриманих маркерів в кожній із груп ми з’єднали всі дані і за контроль приймали середнє значення з інтервалом min — max.
Усі ці 224 постраждалі не відрізнялися за статтю, віком, даними анамнезу. Вони отримували ідентичний комплекс інтенсивної терапії за протоколом відповідно до ступеня тяжкості, який включав інфузійну терапію (парентеральне/ентеральне харчування), антибіотикотерапію, антиоксиданти, антигіпоксанти, дезагреганти, антикоагулянти, противиразкові препарати, анальгетики, вітаміни. Після виписки зі стаціонару всі ці пацієнти із медикаментозних засобів приймали лише препарати, які були необхідними, враховуючи їх супутню патологію (цукорзнижуючі, антигіпертензивні).
Дослідження проводилося на 1-шу, 3-тю, 7-му, 14, 30 та 360-ту добу від моменту отримання політравми.
Визначення субпопуляцій лімфоцитів здійснювали за допомогою моноклональних антитіл. Проводили розрахунок відсотка загальної популяції Т-лімфоцитів (СD3+-клітини), Т-хелперів/індукторів (СD4+-клітини), Т-супресорів/цитотоксичних (СD8+-клітини), активованих HLA-DR+-лімфоцитів. Імунофлюоресценцію оцінювали на проточному цитометрі. Для визначення загальної кількості лейкоцитів і лімфоцитів проводили загальний аналіз крові. Для обробки отриманих даних використовували методи параметричної статистики. Для можливості використання критерія Стьюдента обчислювали критерій Фішера — Снедекора — відношення більшої дисперсії до меншої. Для з’ясування зв’язку між окремими параметрами застосовували кореляційний аналіз.
Результати та обговорення
У першу добу від моменту отримання травми в усіх групах постраждалих спостерігалося зменшення кількості Т-лімфоцитів. У групі І (ІМТ ≤ 29,9 кг/м2) цей показник був знижений на 23 % порівняно з контролем, у групі ІІ (ІМТ 30,0–39,9 кг/м2) — на 38,4 %, у групі ІІІ (ІМТ ≥ 40,0 кг/м2) — на 53 % (табл. 1). В подальшому у пацієнтів групи ІІІ відзначалося прогресивне вірогідне зниження їх кількості з мінімумом на 14-ту добу — 24,4 ± 2,3 % (р < 0,05).
Незважаючи на послідовне плавне збільшення при ІМТ більше від 40,0 кг/м2, цей показник не наближався до нормальних значень, а до моменту закінчення обстеження (1 рік) залишався значно нижче від контрольних значень — на 44 % і становив 37,2 ± 5,4 % (р < 0,05). У хворих групи ІІ у перший тиждень кількість Т-лімфоцитів зберігалася на вихідному рівні, потім поступово збільшувалася і не виходила за їх межі до кінця обстеження. У групі І до 3-ї доби спостерігалося подальше зниження показника до 48,9 ± 3,1 % (р < 0,05). До 14-ї доби кількість Т-лімфоцитів поступово збільшувалася і досягала нижньої межі контролю — 59,1 ± 3,8 % і продовжувала зростати до 1 місяця перебування у стаціонарі. Однак через 1 рік від моменту отримання політравми визначено зменшення показника нижньої межі контрольних цифр — 60,7 ± 3,6 % (рис. 1, табл. 1).
Оскільки імунна система здійснює достатню кількість ефекторних реакцій, які дозволяють поступово і координаційно за допомогою регуляторних механізмів запускати оптимальний комплекс процесів, що направлені на адаптацію організму до екстремальних умов (у тому числі політравма), слід відзначити, що до найбільш важливих реакцій клітинного типу відносять збалансованість функціонування регуляторних Т-клітин — Т-хелперів-індукторів і Т-супресорів, які забезпечують зберігання загальної структури взаємодії елементів при змінах зовнішніх умов і внутрішнього стану.
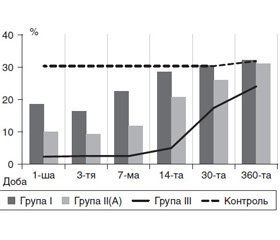
Саме тому при розгляді з цих позицій змін Т-лімфоцитів хелперів нами визначені такі особливості їх реагування на травму при різному ІМТ у хворих на момент надходження у стаціонар (рис. 2, табл. 1).
У хворих групи І значення цього показника не виходили за межі контрольних значень протягом усього періоду дослідження, незважаючи на періоди спаду (1-ша — 3-тя доба, 14–30-та доба) і підвищення (3-тя і 14-та доба) їх функціональної активності.
Подібна динаміка Т-хелперів відзначалася й у пацієнтів групи ІІ з більш вираженою інтенсивністю їх зниження. Так, з 1-ї по 3-тю добу їх кількість була дещо нижчою і становила 34,3 ± 2,9 % і 33,2 ± 2,6 % відповідно. З 1-го місяця до 1 року у цих хворих відзначалася тенденція до зниження даного показника, що свідчить про несприятливий функціональний період.
У групі ІІІ зміни Т-хелперів були особливо вираженими і тривалими і знаходилися нижче від нормальних значень протягом усього періоду дослідження. Зафіксовано, що мінімальна їх кількість була в першу добу лікування — 26,1 ± 3,6 % (р < 0,05), на 31 % нижче за контроль; у період 14–30-та доба — 26,40 ± 3,69 % і 23,6 ± 5,3 % відповідно (р < 0,05), на 40 % нижче за контроль; через 1 рік після отримання травми — 27,1 ± 4,1 % (р < 0,05), на 35 % нижче за контроль.
При аналізі динаміки Т-супресорів у хворих з ПІМТ з травматичною хворобою (рис. 3, табл. 1) були визначені наступні дані.
У групі І (ІМТ ≥ 29,9 кг/м2) кількість Т-супресорів протягом усього дослідження не виходила за межі контрольних значень. З 1-ї по 14-ту добу було відмічено зниження їх кількості з мінімумом на 14-ту добу — 23,1 ± 3,9 % (р < 0,05) з подальшим стабільним відновлюванням.
У групі ІІ (ІМТ 30,0–39,9 кг/м2) з 1-ї по 3-тю добу кількість Т-супресорів зростала до 36,2 ± 4,3 %, далі знижувалася із збереженням з 7-ї по 14-ту добу на рівні 28,4 ± 4,2 % — 21,6 ± 5,8 %, що на 10 % нижче за контроль, поступово відновлювалися до норми до 1-го місяця після отримання ушкоджень, а до 1 року стабільно коливалися близько нижніх нормальних значень (табл. 1).
Відмічалася досить виражена схожість між динамікою Т-супресорів у хворих груп ІІ і ІІІ. Основною відзнакою була більш виражена інтенсивність і тривалість цих змін в групі ІІІ (ІМТ ≥ 40,0 кг/м2). Так, максимальний підйом у хворих цієї групи рівня Т-супресорів був виявлений в перший тиждень госпіталізації — показник на 36 % перевищував контроль, з 14-ї по 30-ту добу було різке стабільне зменшення їх кількості на 25 % нижче за контроль. Через 1 рік після отримання політравми кількість Т-супресорів у пацієнтів цієї групи була нижче контроля і становила 20,6 ± 5,3 %.
Т-активні (HLA-DR+) лімфоцити в ранні строки травматичної хвороби були вірогідно знижені в усіх групах хворих (рис. 4, табл. 1).
Найменш виражено це зниження у пацієнтів групи І (ІМТ ≥ 29,9 кг/м2). Мінімальний вміст HLA-DR+-лімфоцитів спостерігався у них з 1-ї по 3-тю добу (на 30–40 % нижче, ніж у контрольній групі). До 14-ї доби показник Т-активних лімфоцитів у цих хворих повністю відновлювався (табл. 1).
У постраждалих групи ІІ (ІМТ 30,0–39,9 кг/м2) у перший тиждень кількість HLA-DR+-лімфоцитів була стабільно знижена в 3 рази порівняно з контролем, потім показник повільно відновлювався, досягаючи протягом 1 місяця після отримання політравми 30,2 ± 3,6 %, і до 1 року коливався близько нижньої межі нормальних значень (табл. 1) без будь-якої тенденції до подальшого підйому.
Найбільш виражені зміни в динамиці Т-активних лімфоцитів були визначені у пацієнтів групи ІІІ (ІМТ ≥ 40,0 кг/м2). У перший тиждень у цих хворих кількість HLA-DR+-лімфоцитів була в 10 разів нижчою, ніж в контрольній групі, і досягала 2,3 ± 1,6 % в першу добу, 2,4 ± 1,1 % — на 7-му добу перебування у стаціонарі (табл. 1). До 1-го місяця відзначалося зростання їх кількості до 17,4 ± 2,3 %, через 1 рік вони були нижче за контроль на 20 %.
На підставі отриманих даних можна зробити висновок, що у хворих з ПІМТ з політравмою протягом 1 року з моменту отримання травми має місце дисбаланс клітинної ланки імунорегуляції, що проявляється неузгодженістю в кооперації Т-хелперів/індукторів і Т-супресорів, інтенсивність і тривалість якої залежить від ІМТ. При ІМТ ≥ 29,9 кг/м2 він мав переважно функціональний і короткочасний характер (до 2 тижнів) без будь-якої післядії. При ІМТ 30,0–39,9 кг/м2 цей дисбаланс був більш тривалим, до 1 місяця, і мав слабку слідову реакцію в строки до 1 року, що проявлялася виснаженням супресорної функції і коливальним характером змін кількості Т-хелперів. У хворих з ІМТ ≥ 40,0 кг/м2 були виявлені максимальні порушення гомеостатичної регуляції клітин Т-системи, які проявлялися тривалістю, стабільністю, розвитком стійкої недостатності вказаних субпопуляцій лімфоцитів у віддалені терміни після отримання травми.
Слід також відмітити, що, незважаючи на надання даних у відносних показниках (%) Т-лімфоцитів і їх субпопуляцій, зниження і підвищення їх кількості не є відносним, тому що спостерігалося збільшення або зниження їх кількості в периферичній крові.
Враховуючи отримані нами дані, можна виділити так звані закономірності функціонування клітинного гомеостазу при травматичній хворобі у хворих з ПІМТ. Для хворих з ІМТ ≥ 29,9 кг/м2 характерний короткочасний слабковиражений дисбаланс регуляторних Т-клітин і Т-дефіцит, що максимально проявляється в перший тиждень захворювання, має пристосувальний характер, раннє відновлення (до 14-ї доби) функцій клітинного імунітету, відсутність слідової реакції у віддалені терміни. Це відповідало клінічному перебігу травматичної хвороби у даних хворих, строкам стаціонарного лікування.
Для хворих з ІМТ 30,0–39,9 кг/м2 характерний Т-дефіцит, що максимально проявляється протягом першого її місяця, поєднується з незначним дисбалансом субпопуляцій Т-лімфоцитів, зниженням мембранних функцій цих клітин в строки до 1 місяця, наявністю віддаленої неінтенсивної слідової реакції у вигляді зменшення кількості Т-лімфоцитів, Т-супресорів, Т-активних лімфоцитів до нижньої межі нормальних значень, високоамплітудного коливання Т-хелперів/індукторів, порушенням мембранних функцій в строки до 1 року. Динаміка клітинного гомеостазу в даній групі відповідала клінічному перебігу. В строки до 1 року було виявлене субнормальне функціонування клітинної ланки, що можна зв’язати з виснаженням резервних можливостей даної системи, що виникають внаслідок політравми. Клінічно це проявилося виникненням гострих респіраторних вірусних інфекцій у 35 % хворих даної групи, що мали досить тяжкий перебіг з ускладненнями у вигляді приєднання бактеріального компонента.
Для хворих з ІМТ ≥ 40,0 кг/м2 характерним є Т-дефіцит у всі строки обстеження з максимально вираженою інтенсивністю. Найбільші його прояви були визначені в перший місяць хвороби і зберігалися навіть до 1 року. Клінічні прояви у хворих цієї групи відрізнялися більш частими захворюваннями як вірусної, так і бактеріальної етіології. Несприятливим щодо розвитку інфекційних захворювань в ці строки було відзначено зниження Т-лімфоцитів на 40 % і більше від нормальних значень, яке зберігалося більш одного тижня і не мало тенденції до подальшого зросту, прогресуюче зниження Т-активних лімфоцитів більш ніж на 40 %, що супроводжувалося вираженим порушенням взаємодії регуляторних Т-клітин (Т-хелперів і Т-супресорів). Відсутність позитивної динаміки показників у пацієнтів цієї групи пов’язана із зривом резервних можливостей клітинної ланки імунітету.
Висновки
Таким чином, можна підкреслити, що клітинна ланка імунної системи має безперечне патогенетичне значення в розвитку травматичної хвороби у хворих з ПІМТ. Її універсальний механізм реагує залежно від ступеня тяжкості стану хворих з урахуванням анатомо-функціональних особливостей організму, супутньої соматичної патології, що обумовлено здатністю моделювати очікуваний результат. При цьому ступінь і можливість резервної пристосованості залежать в першу чергу від вихідного стану організму хворих, а також ІМТ на момент надходження. Отже, незважаючи на визначені під час дослідження загальні закономірності універсального реагування імунної системи на стрес (політравму), у хворих з ПІМТ кожної із груп порівняння була виявлена індивідуальна відповідь на механічну травму, що, найімовірніше, обумовлене стартовим ІМТ досліджуваних пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Gray S., Dieudonne B. Optimizing Care for Trauma Patients with Obesity // Cureus. — 2018. — 10(7). — Р. e3021. Published 2018 Jul 22. doi: 10.7759/cureus.3021.
2. Ditillo M., Pandit V., Rhee P., Aziz H., Hadeed S., Bhattacharya B., Friese R.S., Davis K., Joseph B. // J. Trauma Acute Care Surg. — 2014 Jan. — 76(1). — Р. 176-9. doi: 10.1097/TA.0b013e3182ab0d7c.
3. Winfield R.D., Southard R.E., Turnbull I.R., Bochicchio K., Reese S., Freeman B.D., Bochicchio G.V. Angiotensin Inhibition Is Associated with Preservation of T-Cell and Monocyte Function and Decreases Multiple Organ Failure in Obese Trauma Patients // J. Am. Coll. Surg. — 2015 Aug. — 221(2). — Р. 486-94.e4. doi: 10.1016/j.jamcollsurg.
4. Kornblith L.Z., Howard B., Kunitake R. et al. Obesity and clotting: Body mass index independently contributes to hypercoagulability after injury // J. Trauma Acute Care Surg. — 2015. — 78(1). — Р. 30-6; discussion 37-8. doi: 10.1097/TA.0000000000000490.
5. Andruszkow H., Veh J., Mommsen P., Zeckey C., Hildebrand F., Frink M. Impact of the body mass on complications and outcome in multiple trauma patients: what does the weight weigh? // Mediators Inflamm. — 2013. — 2013. — 345702. doi: 10.1155/2013/345702.
6. Chuang J.F., Rau C.S., Kuo P.J. et al. Traumatic injuries among adult obese patients in southern Taiwan: a cross-sectional study based on a trauma registry system // BMC Public Health. — 2016. — 16. — 275. Published 2016 Mar 18. doi: 10.1186/s12889-016-2950-z.
7. Majdan M., Brazinova A., Wilbacher I., Rusnak M., Mauritz W. The impact of body mass index on severity, patterns and outcomes after traumatic brain injuries caused by low level falls // Eur. J. Trauma Emerg. Surg. — 2015. — 41(6). — Р. 651-656. doi: 10.1007/s00068-014-0490-8.
8. Premaor M.O., Comim F.V., Compston J.E. Obesity and fractures // Arq. Bras. Endocrinol. Metabol. — 2014. — 58(5). — Р. 470-477. doi: 10.1590/0004-2730000003274.
9. Premaor M.O., Compston J.E., Fina Aviles F., Pages-Castella A., Nogues X., Diez-Perez A., Prieto-Alhambra D. The association between fracture site and obesity in men: a population-based cohort study // J. Bone Miner. Res. — 2013. — 28(8). — Р. 1771-1777. doi: 10.1002/jbmr.1878.
10. Dhungel V., Liao J., Raut H., Lilienthal M.A., Garcia L.J., Born J., Choi K.C. Obesity delays functional recovery in trauma patients // J. Surg. Res. — 2015. — 193(1). — Р. 415-420. doi: 10.1016/j.jss.2014.07.027.
11. Osborne Z., Rowitz B., Moore H., Oliphant U., Butler J., Olson M., Aucar J. Obesity in trauma: outcomes and disposition trends // Am. J. Surg. — 2014. — 207(3). — Р. 387-392. doi: 10.1016/j.amjsurg.2013.10.013.

/89-1.jpg)
/90-1.jpg)