Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Особливості застосування концепції відкритих легень при респіраторній терапії тяжкої негоспітальної пневмонії
Авторы: Туркевич О.М., Закотянський О.П.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Важливим етапом респіраторної терапії є оцінка рекрутабельності легень пацієнта та підбір оптимального рівня позитивного тиску кінця видиху (PEEP). Некоректне налаштування параметрів штучної вентиляції легень (ШВЛ) може суттєво погіршити результати лікування. Нерекрутабельні легені пацієнта вимагають спроб залучення більш високотехнологічних, адаптивно-інтелектуальних режимів ШВЛ. У даній статті нами був описаний клінічний випадок респіраторної терапії тяжкої негоспітальної пневмонії. Терапія була ускладнена нерекрутабельністю легень пацієнта та клінікою вкрай тяжкої гіпоксії. Високі значення PEEP та використання альвеолярних рекрутментів негативно впливали на показники оксигенації. Як альтернатива традиційним режимам нами був застосований інтелектуальний режим вентиляції ASV, що покращило показники оксигенації. Позитивний ефект спостерігався при проведенні ШВЛ у prone-положенні.
Важным этапом респираторной терапии является оценка рекрутабельности легких пациента и подбор оптимального уровня положительного давления конца выдоха (PEEP). Некорректные настройки параметров искусственной вентиляции легких (ИВЛ) могут существенно ухудшить результаты лечения. Нерекрутабельные легкие пациента требуют попыток привлечения более высокотехнологичных, адаптивно-интеллектуальных режимов ИВЛ. В данной статье нами был описан клинический случай респираторной терапии тяжелой внебольничной пневмонии. Терапия была осложнена нерекрутабельностью легких пациента и клиникой крайне тяжелой гипоксии. Высокие значения PEEP и использование альвеолярных рекрутментов негативно влияли на показатели оксигенации. В качестве альтернативы традиционным режимам нами был применен интеллектуальный режим вентиляции ASV, что улучшило показатели оксигенации. Положительный эффект наблюдался при проведении ИВЛ в prone-положении.
Background. This article describes a clinical case of severe community-acquired pneumonia. Materials and methods. Sixty-seven-year old female patient was hospitalized to the intensive care unit with severe bilateral community-acquired pneumonia (CRB65 — 4 points, SMART-COP — 6 points, SpO2 = 78–80 %, paO2 — 40 mmHg, pCO2 — 95 mmHg, pH — 7.25; PaO2/FiO2 = 190 mmHg). Intensive care was started immediately. Hemodynamic parameters were stable. Patient was intubated after adequate preoxygenation (NIV CPAP = 8 сmH2O, FiO2 = 80 %). Sedation and myorelaxation continued for 48 hours. Antibacterial therapy and enteral feeding — according to protocol. Unrecruitable lungs were detected after mechanical ventilation started (PCV, p. control = 14 cmH2O, PEEP = 10 cmH2O). High PEEP levels (10 cmH2O) caused deterioration of lung compliance and SpO2. Recruitment maneuvers were ineffective. After that, adaptive support ventilation (%MV = 170 %) mode and lower levels of PEEP (5–6 cmH2O) were used. Patient was in supine position for first 24 hours of respiratory therapy. The next day we used prone position. Results. Adaptive support ventilation, lower PEEP levels and prone position improved patient’s oxygenation rates and respiratory properties of lungs. Conclusions. Selection of the optimal level of PEEP is an important stage of respiratory therapy in patients with unrecruitable lungs. Incorrect adjustment of mechanical ventilation parameters can significantly impair treatment results. Adaptive, intellectual modes of ventilation can be effective in the treatment of severe pneumonias.
респіраторна терапія; концепція відкритих легень; негоспітальна пневмонія
респираторная терапия; концепция открытых легких; внебольничная пневмония
respiratory therapy; open lung concept; community-acquired pneumonia
Вступ
Негоспітальна пневмонія (НП) супроводжувала людство тисячоліттями. Прогноз при лікуванні тривалий час залишався песимістичним. На початку минулого століття пневмонія, як писав канадський лікар Вільям Ослер в 1901 році, прийшла на зміну туберкульозу і стала основною причиною смертності у великих містах: «Найпоширеніше і найбільш смертельне з усіх гострих інфекційних захворювань, пневмонія, зараз є лідером вершників смерті». Ситуація суттєво покращилась після появи антибіотиків, проте НП залишається однією з провідних причин госпіталізації, захворюваності та смертності [8, 9]. Останні клінічні дослідження показали, що від 2 до 24 % пацієнтів, які надходять в лікарню з діагнозом НП, потребують негайної госпіталізації у відділення інтенсивної терапії (ВІТ) [7]. Згідно із значними мультицентровими когортними дослідженнями, показники смертності у цій групі пацієнтів коливаються від 17 до 49 % [7]. Крім того, існують суперечливі дані щодо покращення чи погіршення цих показників. Тяжка НП доволі часто вимагає проведення штучної вентиляції легень (ШВЛ) [6], проте базові знання та розуміння респіраторної терапії є недостатніми для лікування пацієнтів із нерекрутабельними легенями, рефрактерними до класичних рекомендацій концепції відкритих легень (Open Lung Concept) та стратегії протективної ШВЛ (Lung Protective Strategy). На даний час в Україні діє уніфікований протокол надання медичної допомоги дорослим хворим на негоспітальну пневмонію 2016 року, проте питання респіраторної терапії при нерекрутабельних легенях розкрито недостатньо. Крім цього, одностайності та чіткості щодо цього питання немає і в іноземних рекомендаціях [5].
Мета: на прикладі проведення інтенсивної терапії складного клінічного випадку тяжкої НП проаналізувати основні ланки респіраторної терапії, які не завжди були ефективними, а інколи спричиняли негативні результати; на основі патогенезу захворювання встановити можливі причини неефективності традиційних методів респіраторної терапії та запропонувати шляхи їх покращення.
Матеріали та методи
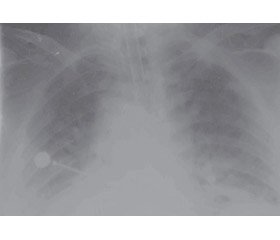
Проведено аналіз респіраторної терапії пацієнтки 67 років з тяжкою НП (4-та клінічна група), яка була ургентно госпіталізована до відділення інтенсивної терапії одразу після надходження в Комунальне некомерційне підприємство «Клінічна лікарня швидкої медичної допомоги» м. Львова. З анамнезу: протягом 5 днів у пацієнтки була гіпертермія (температура тіла 38–40 °C) з вологим кашлем, в останні декілька днів перед госпіталізацією долучилась задишка, що поступово прогресувала. Супутні захворювання: ішемічна хвороба серця. Дифузний атеросклероз. Серцева недостатність 2Б. Гіпертонічна хвороба, ст. 2, ризик 2. Індекс маси тіла 29,2 кг/м2 (маса — 82 кг). Об’єктивний стан на момент надходження: свідомість порушена до рівня поверхневого оглушення (шкала коми Глазго — 13 балів); шкірні покриви блідо-рожеві, акроціаноз. Частота дихання — 30–32/хв; SpO2 — 78–80 % (з інсуфляцією кисню FiO2 40 %). Гемодинаміка: артеріальний тиск — 140/90 мм рт.ст., пульс — 90–100 уд/хв. Згідно зі шкалою CRB65 — 4 бали (летальність — 31 %); зі шкалою SMART-COP — 6 балів (високий ризик потреби в респіраторній підтримці та вазопресорах). Рентген органів грудної клітки (ОГК) — білатеральні інфільтрати. Лабораторні респіраторні показники: paO2 — 40 мм рт.ст., pCO2 — 95 мм рт.ст., pH — 7,25; PaO2/FIO2 — 190 мм рт.ст.
Враховуючи тяжкість стану, пацієнтці одразу було розпочато неінвазивну ШВЛ з метою адекватної преоксигенації (ороназальна маска, режим NIV CPAP — 8 см вод.ст., FiO2 — 80 %) [5], а через 30 хвилин планово переведено на інвазивну ШВЛ. Для проведення респіраторної терапії використовувався апарат HAMILTON-C1. Після цього проводився погодинний аналіз основних показників респіраторних властивостей легень та корекція параметрів ШВЛ. Хвора перебувала у пролонгованій нейроміоплегії протягом 24 годин (міорелаксація — тракріум; седація — пропофол). Було обрано рестриктивну стратегію інфузійної терапії та антибактеріальну терапію згідно з протоколом. Проводилось збалансоване ентеральне харчування.
У перші години проведення ШВЛ використовувались режими з контролем дихального об’єму за тиском, а саме з керованим і переміжним алгоритмом вентиляції (PCV, PSIMV). Потім було прийнято рішення застосувати інтелектуальний режим вентиляції — ASV. Позитивний тиск кінця видиху (ПТКВ/PEEP) в перші години встановлений на рівні 9–10 cм вод.ст., згодом знижений у зв’язку з ознаками нерекрутабельності легень, що підтвердилось після застосування рекрутмент-маневру (RMS). У зв’язку з вкрай низькими показниками оксигенації FiO2 використовувалось на рівні 80 %. Застосування допустимої інверсії вдиху (I : E = 1,5 : 1) відбувалось тільки протягом перших годин вентиляції. Prone-позиція під час ШВЛ була застосована наступної доби (3 години ШВЛ у prone-позиції, згодом 3 години ШВЛ на спині з піднятим головним кінцем та плечовим поясом на 30°).
Результати
Результати респіраторної терапії наведені у табл. 1, 2.
При використанні PEEP на рівні 9–10 см вод.ст. покращення SpO2 не відбулось, статичний тораколегеневий комплаєнс (СRS) знизився. Після проведення альвеолярного рекрутменту (RMS) спостерігалось короткотривале зниження SpO2, показники СRS залишались на попередньому рівні.
Після зниження PEEP до рівня 5–6 см вод.ст. знизився тиск плато (p. plato), зріс СRS, знизився середній внутрішньогрудний тиск (p. mean). Отримані результати свідчать про нерекрутабельність легень та вкрай тяжку рестриктивну легеневу патологію.
При переводі пацієнта на інтелектуальний режим ШВЛ (ASV, %MV = 170 %) покращились показники оксигенації (SpO2) та капнографії (ETCO2), автоматично зріс об’єм вдиху (Vt) та частота дихання (f), відповідно збільшилась хвилинна вентиляція легень (MV).
Vt на рівні 6 мл/кг виявився достатнім та фізіологічним для респіраторної терапії, проте при нижчому рівні даного параметра вагомо знижувалась MV на фоні використання інверсії вдиху до видиху (I : E = 1,5 : 1). Альвеолярна вентиляція була недостатньою.
Prone-положення пацієнта у даному клінічному випадку виявилося ефективним: зріс CRS, Vt, вдалось досягти задовільних показників оксигенації (SpO2 87–95 %, pO2 — 63 мм рт.ст.).
Обговорення
Респіраторна терапія пацієнтів з тяжкою негоспітальною пневмонією та нерекрутабельними легенями — складний процес, при якому використання наявних рекомендації іноді є безуспішним. Ми вирішили обґрунтувати основні методи покращення респіраторної механіки та оксигенації саме при даному складному клінічному випадку.
Здатність легень до розкриття є однією з головних умов ефективності подальшої респіраторної терапії. Відповідно оцінка рекрутабельності легень та встановлення безпечного рівня PEEP, при якому неуражені зони легень не страждатимуть від гіперінфляції, є початковим і важливим етапом лікування. Згідно з аналізом літературних джерел, виділяють основні шляхи підбору PEEP та визначення здатності легень до розкриття.
— Згідно з дослідженнями з використанням комп’ютерної томографії, емпіричне використання довільно високого рівня PEEP 15–20 cм вод.ст. у переважній більшості випадків дає позитивні результати [1]. Проте цей підхід невиправданий та відверто шкодить пацієнтам з нерекрутабельними легенями.
— Використання ескалаційних таблиць PEEP/FiO2 з ARDSNet. Існує чимало запитань до авторів даного підходу, адже незрозуміло, згідно з яким принципом відбувався підбір PEEP до FiO2. На думку авторів, дані табл. 3 відображають «консенсус дослідників та клініцистів щодо переваг та негативних ефектів PEEP, відповідно до даних 1995 року» [2]. Отже, таблиці є неточними та суперечать багатьом принципам респіраторної терапії, окрім того, базуються на застарілих даних.
— Максимальний статичний комплаєнс [2]. Згідно з даним підходом, оптимальним PEEP є такий, при якому досягнуто максимального статичного комплаєнсу. Цей метод є доволі простим та ефективним. Не всі апарати ШВЛ графічно візуалізують респіраторні властивості та механіку легень, але надають дані про CRS. Саме даний метод використовувався нами. Крім того, CRS можливо порахувати, використовуючи формулу: CRS = Vt / p. peak.
— Використання кривої об’єм/тиск та пошук точки нижнього перегину (Lower Inflection Point), яка відповідає тиску відкриття альвеол та оптимальному PEEP. Методика одна з найкращих, проте вимагає апарату ШВЛ відповідного технічного рівня та обов’язкової нейроміоплегії пацієнта.
— Методика ступінчастого або титраційного рекрутменту. Існують різні варіанти даного методу, проте уніфіковано підходу поки немає [11].
З існуючих методів слід також згадати про моніторинг інтрапульмонального шунта, визначення градієнту різниці артеріального та CO2 кінця видиху, а також підбір PEEP відповідно до комп’ютерної томографії грудної клітки, проте дані методи не здобули широко клінічного використання.
В нашому клінічному випадку максимальний CRS був досягнутий при застосуванні PEEP на рівні 5–6 cм вод.ст. Вищі значення супроводжувались зниженням CRS та зниженням сатурації. В основі цього лежить складний патофізіологічний процес. Легені схематично можна розділити на три зони (Z1, Z2 та Z3). Процеси вентиляції (V) та перфузії (Q) відрізняються у цих зонах легень.
Найнижча вентиляція та перфузія — у Z1 (верхівки легень), а найвища вентиляція та перфузія — у Z3 (середні та нижньобазальні відділи легень). Тобто вентиляція та перфузія збільшуються у легенях зверху вниз. Важливо відмітити анатомічні особливості альвеол: у Z1 вони найбільші, проте газообмін в них відбувається найгірше (PA > Pa > Pv, тиск в альвеолах вищий, ніж в судинах). У Z3 альвеоли дрібні, проте газообмін в них відбувається набагато активніше (Pv > Pa > PA). Наступним важливим фактором є зміни вентиляції та перфузії при ураженні легеневої тканини. У випадку нижньодольової пневмонії спрацьовує механізм Euler-Liljestrand [1]: виникає вазоконстрикція у зонах ураження та перерозподіл крові у неуражені зони, які фізіологічно в нормі гірше вентилюються.
При тяжкій пневмонії ми обираємо рівень PEEP та проводимо альвеолярні рекрутменти, проте у випадку, коли вони неефективні (тканина уражена настільки, що немає субстрату для розкриття), підвищенням PEEP ми перерозтягуємо збережені альвеоли та, як наслідок, спричинюємо стискання судин і посилення внутрішньолегеневого шунтування. Настає зниження оксигенації тканин.
Отже, використання зависокого PEEP може тільки нашкодити пацієнту з нерекрутабельними легенями. Саме тому слід з обережністю ставитися до підбору даної опції респіраторної терапії.
Важливим питанням є вибір режиму вентиляції. Однозначної відповіді немає, проте, виходячи з більш фізіологічної форми потокової кривої (низхідна або синусоїдальна) [12] при ШВЛ з контролем дихального об’єму за тиском (PCV, P-SIMV), саме даний варіант був обраний нами на початку респіраторної терапії. Згодом у зв’язку з відсутністю покращення стану пацієнта режим було змінено на інтелектуально-адаптивний — ASV. Особливістю даного режиму є автоматичний підбір частоти дихання пацієнта та використання мінімального тиску вдиху для досягнення автоматично обчисленого об’єму вдиху відповідно до статичного тораколегеневого комплаєнсу. Тобто режим ASV автоматично підібрав параметри вентиляції відповідно до респіраторних властивостей легень та респіраторної механіки. З важливих параметрів даного режиму є встановлення відсотка хвилинної вентиляції (%MV). Враховуючи тяжку рестриктивну патологію легень, даний показник було встановлено на рівні 170 %. Цим вдалось збільшити хвилинну вентиляцію легень, покращити показники оксигенації та знизити гіперкапнію, автоматично зріс об’єм вдиху та статичний тораколегеневий комплаєнс.
Окремо слід згадати про режим дворівневої вентиляції (BiPAP, Bi-level, DuoPAP). При тяжких рестриктивних захворюваннях легень, навіть зі збереженою рекрутабельністю, даний режим є непоказаним [12]. При показниках CRS нижче 30 мл/мм вод.ст. застосування не рекомендоване [12].
Особливістю режиму ASV є практично неможливість застосування інверсії вдиху до видиху, проте для нерекрутабельних легень це виявилось абсолютно доцільно. Згідно з даними літературних джерел, максимально допустимий рівень інверсії, при якому значимо не зростає внутрішньогрудний тиск, є I : E = 1,5 : 1 [4]. Проте даний метод збільшує внутрішньолегеневе шунтування та гіпоксемію. В нашому розпорядженні є інші варіанти зміни властивостей вдиху та видиху. Це PRAMP — час, необхідний для підвищення тиску на вдиху до заданого цільового значення. Максимальне значення даного показника — 200 мс. Чим більший даний показник, тим довший вдих. Зменшуючи даний показник, ми пришвидшуємо та вкорочуємо вдих. У випадку нерекрутабельних легень ми встановили максимальне значення даного параметра. Іншим важливим параметром контролю видиху є чутливість експіраторного тригеру — ETS (expir. trigger sensitivity), рекомендовано в нормі 25 %. Збільшенням цього показника ми можемо скоротити вдих та подовжити видих. Проте в умовах нейроміоплегії даний параметр втрачає свою цінність.
Важливим питанням є межі безпечного використання FiO2. В нашому випадку ми обрали FiO2 на рівні 80 %. Нижче страждала оксигенація тканин, проте, згідно з дослідженнями, це безпечний рівень щодо формування резорбційних ателектазів [3].
Виражений позитивний ефект у показниках оксигенації настав при початку ШВЛ у рrone-позиції. Слід застосовувати дану методику, але важливо пам’ятати, що в такому положенні ШВЛ можлива виключно у гемодинамічно стабільних пацієнтів [10].
Висновки
Респіраторна терапія пацієнтів з нерекрутабельними легенями потребує погодинного моніторингу респіраторних показників і динамічних змін параметрів ШВЛ.
Важливим є етап оцінки рекрутабельності легень та підбору оптимального рівня PEEP.
Некоректне налаштування параметрів ШВЛ (PEEP, I : E, Vt) може суттєво погіршити результати лікування.
Нерекрутабельні легені пацієнта вимагають спроб залучення більш високотехнологічних, адаптивно-інтелектуальних режимів ШВЛ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Başak Çoruh, Luks A.M. Positive End-Expiratory Pressure. When More May Not Be Better. ATS Journal. 2014. 11(8). doi.org/10.1513/AnnalsATS.201404-151CC.
2. Gattinoni L., Carlesso E., Cressoni M. Selecting the “right” positive end-expiratory pressure level. Current opinion in critical care. 2015. 21(1). Р 50-57.
3. Akca O., Ball L., Belda J. WHO Needs High FiO2? Turk. J. Anaesthesiol. Reanim. 2017 Aug. 45(4). Р. 181-192. doi: 10.5152/TJAR.2017.250701.
4. Cilloniz C., Ferrer M., Polverino E. еt al. Invasive mechanical ventilation in community acquired pneumonia. European Respiratory Journal. 2014. 44. P. 4932.
5. Cavalleri M., Barbagelata E., Diaz de Teran T. Noninvasive and invasive ventilation in severe pneumonia: Insights for the noninvasive ventilatory approach. Journal of Critical Care 48. August 2018. DOI: 10.1016/j.jcrc.2018.07.030.
6. Jain Seema еt al. Community-acquired pneumonia requiring hospitalization among US adults. New England Journal of Medicine. 2015. 373(5). Р. 415-427. doi: 10.1056/NEJMoa1500245.
7. Al Otair Hadil A. еt al. Severe pneumonia requiring ICU admission: Revisited. Journal of Taibah University Medical Sciences. 2015. 10(3). Р. 293-299. https://doi.org/10.1016/j.jtumed.2015.03.005.
8. Ryan D. et al. Aetiology of community-acquired pneumonia in the ICU setting and its effect on mortality, length of mechanical ventilation and length of ICU stay: a 1-year retrospective review. Critical Care. 2014. 18(2). P. 64.
9. Wilson P.A., Ferguson J. Severe community-acquired pneumonia: an Australian perspective. Internal medicine journal. 2005. 35(12). Р. 699-705. https://doi.org/10.1111/j.1445-5994.2005.00962.x.
10. Gillespie Delmar J., Kai Rehder. Body position and ventilation-perfusion relationships in unilateral pulmonary disease. Chest. 1987. 91(1). Р. 75-79. https://doi.org/10.1378/chest.91.1.75.
11. Putensen C., Muders T., Kreyer S., Wrigge H. Alveolar ventilation and recruitment under lung protective ventilation, Anуsthesiol Intensivmed Notfallmed Schmerzther. 2008. 43(11/12). Р. 770-777. DOI: 10.1055/s-0028-1104617.
12. Сатишур О.Е. Механическая вентиляция легких. Медицинская литература. 2007. 352 с.

/104-1.jpg)
/105-1.jpg)
/106-1.jpg)
/106-2.jpg)
/106-3.jpg)