Введение
Остеоартрит (ОА) является наиболее распространенной формой патологии суставов, характеризующейся разрушением суставного хряща, воспалением синовиальной оболочки и ремоделированием субхондральной кости [1]. Это заболевание характеризуется болью и тугоподвижностью в суставах, приводящими к нарушению функции и ухудшению качества жизни. Заболеваемость ОА растет из-за старения населения и увеличения распространенности ожирения [2]. Коленный сустав является наиболее распространенной локализацией ОА: ОА коленного сустава поражает более 250 миллионов человек во всем мире [2]. ОА является основной причиной боли у пожилых людей; так, согласно исследованию, проведенному E. Nuesch с соавт. (2011), хроническая боль в бедре и суставах нижних конечностей приводит к инвалидности и повышенному риску смертности от всех причин [3].
Коленный сустав является самым крупным синовиальным суставом, который состоит из костных структур (дистальная часть бедра, проксимальная часть большеберцовой кости и коленная чашечка), хряща (мениск и гиалиновый хрящ), связок и синовиальной оболочки. Последняя отвечает за выработку синовиальной жидкости, обеспечивающей лубрикацию и питательные вещества для аваскулярного хряща [4].
Ранее считалось, что ОА является исключительно дегенеративным заболеванием хряща, однако последние исследования доказали, что ОА — это многофакторное заболевание, в патогенезе которого участвует множество причинных факторов, таких как травма, механическое воздействие, воспаление, биохимические реакции и метаболические нарушения [1]. Установлено также, что в патологический процесс вовлекается не только хрящевая ткань. Эти выводы были сделаны исходя из того, что, учитывая отсутствие кровоснабжения и иннервации, хрящ сам по себе не способен инициировать воспалительные реакции или боль, по крайней мере на ранних стадиях заболевания. Следовательно, источником боли главным образом являются изменения в нехрящевых составляющих сустава, таких как суставная капсула, синовиальная оболочка, субхондральная кость, связки и периартикулярные мышцы [4]. По мере развития болезни эти структуры с различной скоростью вовлекаются в патологический процесс, обусловливая патологическое ремоделирование кости, образование остеофитов, ослабление периартикулярных мышц, слабость связок и синовиальный выпот [5, 6].
Роль воспаления не совсем понятна: сейчас ведутся споры по поводу того, что первично — воспалительная реакция, вызывающая ОА, или ОА, инициирующий развитие воспаления [6]. В отличие от воспалительного артрита воспаление при ОА является хроническим и не столь выраженным и инициируется в основном врожденными иммунными механизмами. Синовит (инфильтрация воспалительными клетками синовиальной оболочки) является характерным признаком ОА, который часто присутствует на ранних стадиях заболевания, но более распространен на поздних стадиях и связан с тяжестью патологического процесса [4]. При ОА в синовиальной жидкости было обнаружено несколько медиаторов воспаления, включая белки плазмы (С-реактивный белок, предложенный в качестве маркера для развития и прогрессирования ОА), простагландины, лейкотриены, цитокины, факторы роста, оксид азота и компоненты комплемента [7]. Локально все эти компоненты могут индуцировать матриксные металлопротеиназы и другие гидролитические ферменты (включая циклооксигеназу-2 и простагландин E), приводя к дегенерации хряща [8]. Разрушение внеклеточного матрикса способствует высвобождению молекул, ассоциированных с повреждением молекулярных структур, которые распознаются врожденными иммунными клетками (макрофагами и тучными клетками) и активируют их. Эта длительная и нерегулируемая степень воспаления может привести к разрушению околосуставных тканей. В исследованиях на животных было обнаружено, что макрофаги участвуют в развитии остеофитов, которые являются патологическим признаком ОА [8].
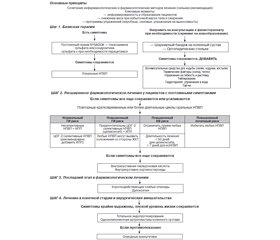
ОА — это прогрессирующее заболевание с различной степенью тяжести, с различными вариантами/фенотипами в течение всего патологического процесса, требующее длительного лечения [5]. Целью лечения ОА является уменьшение симптомов и замедление прогрессирования заболевания, что, в свою очередь, может снизить влияние ОА на качество жизни пациента с последующим сокращением потребностей в ресурсах здравоохранения. В настоящее время различные академические и профессиональные общества разработали руководящие принципы и рекомендации для стандартизации доступных вариантов лечения. Среди них — рекомендации Международного общества по изучению остеоартрита (OARSI) (2014) [9], Американского колледжа ревматологии (ACR) (2012) [10], Американской академии хирургов-ортопедов (AAOS) (2013) [11] и недавние рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) (2019) [12]. В табл. 1 представлена сравнительная характеристика основных рекомендаций по лечению ОА.
/32.jpg)
Основная информация в данном обзоре посвящена новым рекомендациям Европейского общества по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) 2019 года в отношении менеджмента ОА коленного сустава. Со времени обнародования предыдущих рекомендаций 2014 и 2016 г. было опубликовано немало новых данных, в частности, касающихся безопасности и эффективности многих лекарственных препаратов, обычно используемых для лечения ОА; были выявлены несоответствия в представленных данных, а также необходимость более точного руководства согласно новым клиническим испытаниям. Таким образом, недавнее согласованное заявление ESCEO представляет конкретные, четкие, практически направленные и стандартизированные рекомендации по лечению ОА [12]. В этом обновлении рабочая группа ESCEO пересмотрела алгоритм лечения в свете недавних доказательств эффективности и безопасности препаратов, разработала новые рекомендации, основанные на системе оценки, экспертизе, разработке и изучении степени обоснованности клинических рекомендаций (GRADE), и представила обновленный пошаговый алгоритм рекомендаций для практического руководства для клиницистов по оказанию ориентированной на пациента помощи в практике лечения ОА коленного сустава. Комбинация методов лечения, включая нефармакологические и фармакологические вмешательства, остается ключевой для лечения ОА коленного сустава.
1-й этап: нефармакологическое и фармакологическое лечение
Нефармакологическое лечение
OARSI, ACR, AAOS и ESCEO единогласно утверждают, что первым шагом в ведении пациентов с ОА являются информированность и образованность больного в отношении заболевания, нормализация веса и регулярное выполнение программ физических упражнений (аэробные, силовые или упражнения с сопротивлением, упражнения на гибкость и растяжку, упражнения в воде), причем эти рекомендации должны быть имплементированы в лечебные программы в течение всего времени ведения пациента с ОА коленного сустава. Рабочая группа ESCEO отмечает, что остаются некоторые разногласия относительно оптимальных модальностей подходов к программам физических упражнений, их реальному воздействию на боль и функцию суставов и возможность их выполнения (осуществимость) в долгосрочной перспективе [13].
Гиподинамия, иммобилизация и полная обездвиженность вредны для здоровья коленного сустава, отсутствие механической стимуляции вызывает более быструю дегенерацию хряща из-за его размягчения и истончения, снижения содержания гликозаминогликана, нарушения механики и гибкости суставов [13]. Легкая/умеренная физическая активность предоставляет множество преимуществ этой группе пациентов: помимо механических и функциональных улучшений, она способствуют снижению риска диабета, сердечно-сосудистых событий, падений, инвалидности, а также улучшению настроения и социальной самоэффективности [13].
Упражнения должны быть адаптированы к потребностям, толерантности и предпочтениям каждого пациента, следует избегать ударной нагрузки, больших перерывов и обеспечить максимальную приверженность для увеличения успеха. Существуют различные виды упражнений, оказывающих благоприятное воздействие на пациентов с ОА коленного сустава. Комплексы упражнений должны выполняться три раза в неделю, и для оценки ответа пациент должен выполнить не менее 12 тренировок [4]. Подчеркивается, что рекомендации по физической нагрузке при ОА коленного сустава также применимы к пациентам в возрасте 70–80 лет, несмотря на то, что доказательств их пользы недостаточно [14].
Различные типы физических упражнений при ОА коленного сустава [13–16]:
— аэробика, тренировки на выносливость. Включают ходьбу, подъем по лестнице и езду на велосипеде. Уменьшают болезненность суставов, улучшая при этом функциональное состояние опорно-двигательного аппарата, сердечно-сосудистой и дыхательной систем. Езда на велосипеде особенно привлекательна для пациентов, которым необходим низкий профиль воздействия со сниженной ударной нагрузкой;
— акватерапия (упражнения в воде). Альтернатива для пациентов, которые не решаются начать заниматься физическими упражнениями, учитывая меньшее влияние этой нагрузки на суставы. Некоторые пациенты лучше переносят акватренировки без обострения симптомов, что иногда проявляется при начале тренировок с нагрузкой. Можно использовать эту терапию как мост при переходе к более интенсивным тренировкам в зале или на улице;
— упражнения на земле:
а) упражнения на сопротивление/силовые тренировки. Изометрические, изотонические, изокинетические упражнения для четырехглавой и отводящих мышц бедра, подколенных сухожилий и икроножных мышц. Улучшают силу, физическую функцию и уменьшают уровень боли с той же эффективностью и результатами, что и аэробные упражнения;
б) упражнения на баланс. Включают методику тай-чи, применение медленных и плавных движений при использовании различных техник дыхания;
в) стретчинг. Эта группа упражнений особенно эффективна для увеличения диапазона движений суставов и гибкости пациента.
Нормализация массы тела играет важную роль в управлении симптомами при ОА: было отмечено, что польза упражнений увеличивается при снижении веса [14]. Ожирение имеет предрасполагающие механизмы в развитии ОА коленного сустава за счет не только механического, но и молекулярного воздействия. Сама жировая ткань является источником провоспалительных факторов. Содержание цитокинов, адипокинов, интерлейкина (ИЛ)-6, фактора некроза опухоли a (ФНО-a) и С-реактивного белка повышено в плазме пациентов с ожирением и ассоциировано с изменением гомеостаза хряща [7].
Во время ходьбы коленный сустав выдерживает нагрузку в 3–5 раз больше массы тела, следовательно, даже небольшие колебания веса представляют собой высокую вариацию нагрузки на сустав [15]. S.P. Messier с соавт. (2005) отметили, что при уменьшении веса на 1 килограмм происходит улучшение в клиническом течении ОА коленного сустава на 10 % (та же пропорция применяется в противоположном направлении при увеличении веса) [16]. Исследователи обратили внимание, что развитие ОА усугубляется за счет не только общей массы пациента, но и высокого процентного содержания жира в организме; снижение на 1 % массы именно жировой ткани приводило к увеличению функции сустава на 28 % и улучшению на 9,4 % по шкале индекса остеоартрита Университета Западного Онтарио и Университета МакМастера (WOMAC) [17].
Что касается других нефармакологических вмешательств, то пациенты могут получить пользу от тепловых модальностей, но нет достаточных данных, чтобы рекомендовать использование чрескожной электрической нервной стимуляции или терапевтического ультразвука [18].
В версии алгоритма ESCEO 2019 года были кратко рассмотрены другие нефармакологические методы лечения ОА коленного сустава [12]. Более того, рабочая группа придерживается рекомендации, что следует проводить оценку, могут ли другие физические вмешательства быть полезными для дополнительного облегчения симптомов в сочетании с фармакологическими вмешательствами. Неполный список возможных нефармакологических вмешательств, подкрепленных различными степенями доказательности, приведен на рис. 1.
На 1-м этапе лечения и после соблюдения основных принципов пациенты должны быть направлены к физиотерапевту или другому специалисту для оценки необходимости коррекции варусной или вальгусной деформации [19]. Коррекция с помощью шарнирного коленного бандажа предпочтительнее клиновидных стелек [20].
Однако на практике нефармакологические методы лечения используются недостаточно. Поставщики медицинских услуг (медицинские работники — ревматологи, хирурги-ортопеды, физиотерапевты и врачи общей практики) сообщают о трех основных барьерах, препятствующих немедикаментозной и нехирургической помощи пациентам с ОА коленного и тазобедренного суставов: отсутствие опыта у медицинского работника (знаний и навыков); отсутствие рекомендаций по лечению, основанных на фактических и доказательных данных (например, в отношении контроля веса, а также интенсивности и дозированности физических упражнений), и отсутствие условий для оптимальной организации ухода за пациентами с ОА [21]. Для преодоления этих барьеров предлагается сфокусировать образование клиницистов и пациентов на инициировании и поддержке изменений в образе жизни, продвижении вмешательств в соответствии с рекомендациями, основанными на фактических данных, и улучшенной организации ухода. Для пациента существуют барьеры, особенно в отношении физической активности и упражнений, поскольку они часто испытывают сильную боль, и ее предварительное облегчение является обязательным условием для выполнения упражнений и физической активности. Барьеры могут быть преодолены с помощью положительного опыта упражнений, изменения убеждений, знаний и отношения пациента к физической нагрузке, а также путем поддержки медицинских работников и социальных служб. Наконец, программа должна быть персонализирована и адаптирована к характеристикам пациента и его окружения.
Фармакологическое лечение
Парацетамол (ацетаминофен) широко рекомендовался и в настоящий момент продолжает рекомендоваться OARSI и ACR в качестве первого шага для анальгезии, несмотря на тот факт, что его влияние на симптомы ОА минимально [22]. ESCEO с сомнением рекомендовало применение парацетамола на регулярной основе в алгоритме 2014 года [23].
Систематический обзор обсервационных исследований в литературе показал, что парацетамол имеет минимальную эффективность при боли и не оказывает значительного влияния на скованность и функцию у пациентов с ОА коленного сустава [23]. Профиль безопасности парацетамола также вызывает значительные опасения в связи с увеличением числа желудочно-кишечных (ЖК), сердечно-сосудистых (СС), печеночных и почечных нежелательных побочных явлений (ПЯ) [24]. Кроме того, обнаружен относительно более высокий уровень смертности у пациентов, принимавших парацетамол, по сравнению с теми, кто его не получал [25]. Основываясь на сомнительной эффективности и подтвержденных проблемах безопасности, рабочая группа ESCEO 2019 г. [12] не рекомендует применять парацетамол на постоянной основе для лечения ОА коленного сустава на 1-м этапе терапии и дает слабую рекомендацию, что парацетамол (ацетаминофен) в дозе, не превышающей 3 г/день, можно использовать только в качестве краткосрочной спасательной анальгезии, применяемой на фоне 1-го этапа хронической терапии, с симптоматическими препаратами медленного действия для ОА (SYSADOAs).
Симптом-модифицирующие препараты замедленного действия (symptomatic slow acting drugs for osteoarthritis — SYSADOAs)
Существует много различных агентов в классе SYSADOA, включая глюкозамин, хондроитин, диацереин и неомыляемые соединения авокадо и сои (НСАС), эффективность которых подтверждается в различной степени клинически.
Глюкозамин, хондроитин и НСАС являются натуральными продуктами. Глюкозамина гидрохлорид (ГГ) представляет собой простую молекулу, полученную в процессе экстракции и используемую в качестве нутрицевтического или безрецептурного продукта. И наоборот, глюкозамина сульфат представляет собой более сложную молекулу, которая может быть получена только с помощью запатентованного полусинтетического пути и процесса стабилизации и которая обнаруживается только в рецептурном оригинальном лекарственном препарате — патентированном рецептурном кристаллическом глюкозамина сульфате (пКГС) [26]. Хондроитин является высокомолекулярным длинноцепочечным полимером из повторяющихся звеньев, который воспроизводится в виде хондроитина-4 и -6 сульфата (ковалентная связь) различными процессами экстракции. Таким образом, доступны многочисленные составы этих агентов — как в виде рецептурных продуктов, так и в качестве пищевых добавок. Однако, хотя все эти препараты могут претендовать на достижение терапевтического уровня глюкозамина или хондроитина в крови, клинические данные подтверждают эффективность только некоторых из них [5].
Показано, что только оригинальный пКГС обеспечивает стабильно высокую биодоступность глюкозамина и концентрацию в плазме у пациентов, что соответствует продемонстрированной клинической эффективности [27]. И наоборот, ГГ, а не продукты глюкозамина сульфата (обычно состоящие из ГГ с добавлением сульфата натрия для получения вводящей в заблуждение «сульфатной» маркировки), неоднократно демонстрировали свою неэффективность при ОА [28].
Проведен ряд клинических исследований по оценке пКГС. Его эффективность в уменьшении боли была выше, чем у парацетамола, и аналогична нестероидным противовоспалительным препаратам (НПВП) [29]. ПКГС также оказывает существенное влияние на функцию и обладает болезнь-модифицирующими эффектами, снижая потребность в сопутствующих препаратах для лечения ОА и отсрочке в необходимости проведения операции по протезированию сустава [30]. В недавнем сетевом метаанализе, включающем только долгосрочные (> 1 года) исследования любого фармакологического вмешательства при ОА коленного сустава, только пКГС имел болезнь-модифицирующий профиль, был эффективен при боли, обусловленной ОА коленного сустава, улучшал функцию и структуру сустава [31]. Другие же препараты глюкозамина не продемонстрировали эффективность в высокодоказательных исследованиях и метаанализах [32]. Кроме того, препараты глюкозамина, отпускаемые без рецепта, включая ГГ с добавлением сульфата натрия или без него, не были эффективны ни для одного из вышеперечисленных результатов.
Аналогично только хондроитина сульфат (ХС) с соответствующей фармацевтической степенью чистоты и физико-химическими параметрами показал свою эффективность, подтвержденную в исследованиях [33]. Как сообщается, эффективность ХС при боли варьирует, и недавний метаанализ показал, что ХС обеспечивает умеренную эффективность в уменьшении боли с большим влиянием на функцию при ОА коленного сустава [34]. Недавнее исследование J.Y. Reginster с соавт. (2017) также продемонстрировало, что ХС фармацевтического уровня не отличается от целекоксиба с точки зрения эффективности при симптоматическом ОА коленного сустава [33]. Сообщалось также, что он оказывает положительное влияние на структуру сустава, оцениваемую по изменениям, визуализированным с помощью магнитно-резонансной томографии [31].
Полученные доказательные данные эффективности SYSADOA нашли отражение в относительно недавних исследованиях, поэтому в рекомендациях OARSI 2014 г., ACR 2012 г., AAOS 2013 г. SYSADOA не рекомендуются к использованию, а в ESCEO 2019 г. среди всех доступных продуктов, содержащих глюкозамин и хондроитин, рекомендуется использовать в качестве альтернативы пКГС конкретно препараты рецептурного кристаллического сульфата глюкозамина и оригинального рецептурного хондроитина сульфата определенного фармацевтического качества, для которых доказательная база однозначна [12], в качестве фоновой хронической (постоянной) терапии, начиная с 1-го этапа (сильная рекомендация) (рис. 1).
ESCEO рекомендует проводить исследования генерических препаратов сложных молекул с определенной биологической активностью, так называемых биосимиляров, демонстрирующих сопоставимость с эталонным лекарственным средством, с использованием соответствующих физико-химических и биологических тестов in vitro в неклинических и клинических исследованиях.
Глюкозамин и хондроитин часто встречаются в комбинации в качестве пищевых добавок, хотя комбинированные продукты могут иметь различное фармацевтическое качество, и клинические исследования дают противоречивые результаты относительно того, есть ли какая-либо дополнительная выгода от этой комбинации. Недавнему РКИ с участием 164 пациентов с рентгенографическим ОА коленного сустава 2-й или 3-й степени по Келлгрену — Лоуренсу и умеренной/тяжелой болью в колене, которые получали в течение 6 месяцев ХС (1200 мг) плюс глюкозамина сульфат (1500 мг) один раз в день или плацебо, не удалось продемонстрировать превосходство имеющейся комбинации глюкозамин/хондроитин над плацебо с точки зрения уменьшения боли в суставах и функциональных нарушений у пациентов с симптоматическим ОА коленного сустава [35]. Эти результаты могут быть объяснены тем фактом, что ХС, как известно, влияет на абсорбцию глюкозамина, снижая его биодоступность на 50–75 % [36]. Таким образом, комбинация глюкозамина и хондроитина не может быть рекомендована для долговременного лечения ОА (слабая рекомендация ESCEO).
Неомыляемые соединения авокадо и сои (НСАС) представляют собой сложную смесь многих натуральных растительных экстрактов, полученных из авокадо и соевых масел. Идентификационные данные активного компонента(-ов) неизвестны, и анализ коммерчески доступных добавок демонстрирует различия в содержании стеролов [37]. В клинических исследованиях продолжительностью от 3 до 6 месяцев было показано некоторое уменьшение боли, скованности и улучшение физической функции при использовании НСАС (300 мг/день), что привело к снижению потребности в обезболивании [38]. Положительные результаты по влиянию НСАС на прогрессирование заболевания были обнаружены в исследованиях продолжительностью 2–3 года у пациентов с ОА тазобедренного или коленного сустава [39].
Диацереин является производным антрахинона и обладает противовоспалительной активностью [40]. В известном метаанализе диацереин продемонстрировал небольшое положительное влияние на боль, задержку прогрессирования разрушения тазобедренного сустава при ОА [41], однако значительные долгосрочные эффекты при ОА коленного сустава еще не показаны. Безопасность диацереина была поставлена под сомнение после сообщений о тяжелой диарее и редких случаях потенциально серьезной гепатотоксичности [42]. В недавнем метаанализе безопасности диацереина было показано, что частота желудочно-кишечных побочных эффектов (диарея, боль в животе, мягкий стул, колит) более чем в два раза выше, чем при использовании плацебо, с сопутствующим лечением ОА или без него [43]. Эта частота возникновения диареи после ежедневного лечения диацереином в дозе 100 мг, согласно сообщениям, варьирует от 2,3 до 45,9 %; такой широкий диапазон результатов может быть частично объяснен изменчивостью продуктов, содержащих диацереин, на рынке. Тем не менее в отчете EMA сделан вывод о том, что баланс диацереина в отношении пользы и риска остается положительным при лечении ОА тазобедренного и коленного сустава у пациентов в возрасте до 65 лет [44]. Рекомендуется начало терапии с половины суточной дозы диацереина (то есть 50 мг вместо 100 мг в день) и прекращение приема в случае возникновения диареи. Кроме того, недавний отчет ESCEO, основанный на мнении экспертов, поддерживает диацереин как фоновую терапию ОА, которая может быть особенно полезна у пациентов с противопоказаниями к НПВП или парацетамолу [45]. Таким образом, диацереин дает хорошее преимущество — соотношение риска при лечении ОА коленного сустава — и рекомендуется в качестве альтернативной терапии на 1-м этапе.
Топические НПВП могут быть добавлены в схему лечения на 1-м этапе, если у пациента сохраняется симптоматика после начала фармакологической терапии SYSADOAs и ургентная анальгезия парацетамолом не обеспечивают достаточное облегчение симптомов согласно рекомендациям обществ по изучению ОА. Краткосрочная эффективность местных НПВП при ОА коленного сустава была установлена в нескольких РКИ, метаанализах и исследованиях в реальной жизни [46, 47]. Недавний сетевой метаанализ показал, что местные НПВП превосходили плацебо в плане облегчения боли и улучшения функции при ОА, в частности, пластыри, содержащие диклофенак, были наиболее эффективными для облегчения боли при ОА [48]. Данные, полученные в ходе исследований, показывают, что местные НПВП столь же эффективны, как и пероральные НПВП, но ассоциированы с более низким риском системных побочных эффектов по сравнению с пероральными НПВП из-за более низкой системной абсорбции [49], но с повышенным риском локальных кожных реакций по сравнению с плацебо [50]. Из соображений безопасности местные НПВП могут быть использованы вместо пероральных у пациентов с ОА в возрасте > 75 лет, у лиц с сопутствующими заболеваниями или с повышенным риском развития ЖК, СС или ренальных побочных эффектов. Рабочей группой ESCEO и AAOS настоятельно рекомендуется использовать топические НПВП в качестве дополнительной анальгезии на 1-м этапе у пациентов, у которых по-прежнему сохраняются симптомы после применения базисной терапии и до применения оральных НПВП.
2-й этап: расширенное фармакологическое лечение
Оральные НПВП
Фармакологические методы лечения 2-го этапа назначаются пациентам при недостаточной эффективности лечебных мероприятий 1-го этапа, а также у лиц с ОА и умеренной/сильной болью. Пероральные НПВП оказывают слабое или умеренное влияние на облегчение боли при ОА коленного сустава (целекоксиб 200 мг/день, диклофенак 150 мг/день, эторикоксиб 60 мг/день) [51]. Показано, что селективные ингибиторы циклооксигеназы-2 (ЦОГ-2), преимущественно селективные или неселективные (нс) НПВП, одинаково эффективны в плане обезболивания при ОА [52]. Однако кокрановский обзор продемонстрировал, что целекоксиб превосходит плацебо и некоторые нсНПВП в снижении боли при ОА и улучшении функции с высоким уровнем доказательности [53]. Кроме того, в сетевом метаанализе долгосрочных испытаний фармакологических вмешательств при ОА коленного сустава НПВП не были связаны с уменьшением боли, изменениями функции или структуры сустава, за исключением целекоксиба [54].
Выбор НПВП врачами, как правило, определяется оценкой пользы и балансом риска с точки зрения вариабельности профиля безопасности ЖК и СС ПЯ между отдельными препаратами и отдельными пациентами. Недавние метаанализы безопасности НПВП позволяют предположить, что все нсНПВП и ингибиторы ЦОГ-2 обладают высоким потенциалом токсичности для пищеварительной и сердечно-сосудистой систем [55]. Метаанализ 280 исследований НПВП в сравнении с плацебо (124 513 человеко-лет, 68 342 человеко-лет) и 474 испытаний одного НПВП против другого (229 296 участников, 165 456 человеко-лет) выявил, что все схемы приема НПВП, включая нсНПВС и ингибиторы ЦОГ-2, увеличивают осложнения со стороны верхней части желудочно-кишечного тракта по сравнению с плацебо [56].
С точки зрения влияния на пищеварительную систему целекоксиб является менее токсичным, что было показано в ретроспективном объединенном анализе 21 РКИ с участием 9461 пациента в возрасте > 65 лет с ОА, ревматоидным артритом или анкилозирующим спондилитом: меньшее количестве пациентов, получающих целекоксиб (16,7 %), имели гастроинтестинальные ПЯ (боли в животе, запоры, диарею, диспепсию, метеоризм, тошноту) в сравнении с напроксеном (29,4 %), ибупрофеном (26,5 %) или диклофенаком (21,0 %) [57].
Хотя ранее считалось, что селективность НПВП в отношении фермента ЦОГ-2 регулирует профиль КВ-токсичности, результаты недавних исследований показывают, что КВ риск может быть специфичным для определенных лекарственных средств: так, рофекоксиб является единственным НПВП, четко ассоциированным с повышенным риском сердечно-сосудистых событий [58]. Значительный повышенный риск геморрагического инсульта был также обнаружен у пациентов, принимавших диклофенак и мелоксикам [59]. Популяционное когортное исследование оценило абсолютный риск инфаркта миокарда, связанного с применением НПВП, — он составил от 0,5 до 1 % в год [60]. Хотя абсолютное увеличение риска инфаркта миокарда невелико, использование НПВП очень распространено у пожилых людей: их постоянно принимают более 29 миллионов взрослых (12,1 %) [61]. Вероятность острого инфаркта миокарда для НПВП, взятая за любой промежуток времени, показала увеличение риска на 15 % для целекоксиба (200 мг), 25 % — для напроксена (500 мг), 35 % — для диклофенака (100 мг), 40 % — для ибупрофена (1200 мг) и 55 % — для рофекоксиба (25 мг) [60]. Примечательно, что риск инфаркта миокарда, ассоциированный с приемом целекоксиба, зависел от постоянного использования препарата в течение более 30 дней, тогда как для ибупрофена, рофекоксиба, диклофенака и напроксена повышенный риск возникновения инфаркта миокарда появлялся в течение 7 дней после использования [60]. Все НПВП также связаны с повышенным риском острого повреждения почек, который особенно высок в первые 30 дней после начала терапии [62]. Хотя у пациентов с нормальной функцией почек вероятность развития их острого повреждения после приема НПВП невелика, вероятность развития этих осложнений у лиц с гипертонией, сердечной недостаточностью или диабетом в анамнезе намного выше [62]. Следовательно, из-за риска возникновения ЖК и КВ побочных эффектов в результате приема любых НПВП ESCEO и ACR рекомендуется использовать НПВП в самой низкой эффективной дозе в течение кратчайшего периода времени, необходимого для контроля боли, то есть периодически или в более длительных циклах, но не для хронического применения [10, 12]. Рабочая группа ESCEO считает, что целекоксиб (200 мг/день) может быть предпочтительным пероральным НПВП из-за баланса между хорошей кратковременной эффективностью при ОА в утвержденных дозах и его более низкой склонности к токсичности. Рабочая группа ESCEO настоятельно рекомендует использовать пероральные НПВП (селективные или неселективные) в качестве терапии 2-го этапа, если они применяются только периодически, для более длительных циклов использование оральных НПВП должно основываться на профиле риска пациента, как показано на рис. 1 (сильная рекомендация).
Внутрисуставные вмешательства: гиалуроновая кислота и глюкокортикоиды
В случае противопоказаний к назначению НПВП или при сохраняющейся симптоматике у пациентов, несмотря на рациональное применение НПВП, может быть рассмотрено внутрисуставное (ВС) лечение ОА. ВС гиалуроновая кислота (ВСГК) может быть альтернативой НПВП при ОА коленного сустава с более благоприятным профилем безопасности, особенно у пожилых пациентов или лиц с высоким риском развития побочных эффектов на фоне лечения НПВП. Вискосупплементация с помощью ВСГК является эффективным методом лечения ОА коленного сустава, оказывающим благоприятное влияние на боль, функцию и общую оценку состояния пациента [63]. Существуют убедительные доказательства эффективности ВСГК по данным РКИ, многочисленных метаанализов и опыта реальной жизни [64]. Более того, ВСГК была наиболее эффективным средством от боли среди всех вмешательств при ОА с превосходящей эффективностью по сравнению с пероральными НПВП [65]. Систематические обзоры метаанализов подтвердили, что ВСГК является целесообразным выбором в лечении ОА коленного сустава, и использование этого метода лечения приводит к уменьшению боли и улучшению функции коленного сустава, причем эти эффекты могут сохраняться до 26 недель [66]. Для ВСГК характерно отсроченное начало действия: эффективность в отношении боли проявляется к 4-й неделе, достигает максимума через 8 недель и сохраняется до 6 месяцев [67].
Исследования показывают, что одна инъекция ВСГК не демонстрирует преимущества по сравнению с плацебо, несколько курсов инъекций превосходят одну инъекцию, 2–4 инъекции демонстрируют наибольшую эффективность в уменьшении выраженности боли через 3 и 6 месяцев [68]. Ретроспективный анализ базы данных показывает снижение количества или задержку потребности в операции по полной замене коленного сустава приблизительно на 2 года после однократной инъекции и до 3,5 года при 5 курсах ВСГК [69]. Лечение ВСГК также снижает потребность в других обезболивающих препаратах, таких как НПВП, глюкокортикоиды и опиоиды, у пациентов с ОА коленного сустава [70].
Выраженность клинического эффекта, как сообщается, различается для разных продуктов ВСГК. ВСГК с низкой молекулярной массой (ММ) обладают более низкой эффективностью, чем ВСГК с промежуточной и высокой ММ [71].
Противоречивые отчеты о безопасности, связанные с ВСГК, включая повышенный риск псевдосептических реакций, обострений синовита, местных побочных реакций (боль, отек и артралгия), привели к некоторым опасениям ESCEO по поводу использования этого метода лечения [72]. Кроме того, из-за необходимости повторных инъекций, выполняемых практикующим врачом, и из-за высокой стоимости лечения ВСГК позиционируются в алгоритме лечения после НПВП или при противопоказаниях к их применению. Одновременно в обзорах OARSI, ACR, AAOS вискосупплементарная терапия не входит в перечень рекомендуемых методов лечения.
ВСГК следует вводить при ОА коленного сустава только после разрешения острого воспалительного процесса. При наличии синовита у таких пациентов следует использовать глюкокортикоиды для лечения выпота коленного сустава. ВС глюкокортикоиды более эффективны, чем плацебо и ВСГК, в краткосрочных наблюдениях (2–4 недели), и абсолютно ожидаемо, что их эффективность выше у пациентов с выраженным болевым синдромом [73]. Внутримышечные инъекции глюкокортикоидов показали клинически значимое уменьшение боли, связанной с ОА тазобедренного сустава, в течение 12 недель после инъекции [74]. Однако польза повторных курсов ВС глюкокортикоидов в уменьшении болевых симптомов достаточно ограниченна, кроме того, в двух двухлетних исследованиях не было обнаружено никакой пользы ВС глюкокортикоидов для модификации структуры сустава в долгосрочной перспективе [75].
В настоящее время доступны следующие одобренные FDA глюкокортикоиды с немедленным высвобождением (НВ) для ВС применения: метилпреднизолона ацетат (MA), триамцинолона ацетат (TA), триамцинолона гексацетонид (TГ), бетаметазона ацетат (BA), бетаметазона натрия фосфат (БНФ) и дексаметазон [76].
Были проведены исследования для определения оптимального глюкокортикоида с наилучшими фармакологическими и клиническими характеристиками для ВС введений. Дозировки, эквивалентные или превышающие 50 мг преднизона (эквивалентно 40 мг ТА и МА), были связаны с более длительным обезболивающим эффектом — 12–24 недели по сравнению с коротким обезболиванием в течение 2–4 недель, о котором сообщалось при более низких дозировках [77, 78]. U. Yavuz с соавт. (2012) отметили, что МА достаточно уменьшает боль в первые 6 недель по сравнению с другими используемыми кортикостероидами (ТА, БНФ), но все они обеспечивают эквивалентную анальгезию с 6-й по 12-ю неделю [79].
Таким образом, рабочая группа ESCEO рекомендует использовать ВС глюкокортикоиды у пациентов, у которых имеются противопоказания к приему НПВП, или если у пациента сохраняются симптомы, несмотря на применение НПВП. ВС глюкокортикоиды продемонстрировали лучшую эффективность, чем ВСГК, в первые несколько недель лечения у одной и той же популяции пациентов; уменьшение сильной боли может быть лучшим предиктором этой краткосрочной эффективности, чем долговременная редукция воспалительных признаков (слабая рекомендация).
3-й этап: последний шаг в фармакологическом лечении остеоартрита
Последние фармакологические возможности для пациента с выраженной симптоматикой ОА коленного сустава представлены кратковременным применением слабых опиоидов, таких как трамадол, для которых имеются убедительные доказательства анальгетического эффекта при ОА коленного сустава [80]. Опиоиды значительно снижают интенсивность боли и несколько улучшают функцию, в то время как индекс потенциального вреда (ИПВ) составил –5 по сравнению с плацебо [81]. Препараты трамадола с замедленным высвобождением (SR) могут быть более предпочтительными для снижения боли, кроме того, для улучшения переносимости и минимизации последствий прекращения лечения рекомендуется медленное восходящее титрование трамадола SR от 50 до 100 мг [82]. Недавний метаанализ безопасности пероральных опиоидов, используемых при ОА, выявил повышенный риск развития побочных эффектов со стороны ЖК тракта (сухость во рту, язвы в полости рта, тошнота, рвота, диспепсия, запор), центральной нервной системы (головная боль, головокружение, усталость, сонливость) и дерматологических симптомов (сыпь или зуд) [83]. Примечательно, что лечение опиоидами не оказалось лучше лечения неопиоидными препаратами для улучшения функции, связанной с болью [83].
Антидепрессант дулоксетин использовался при хронических болевых синдромах, и некоторые доказательства его эффективности были продемонстрированы при ОА, особенно у пациентов с болью в результате центральной сенситизации, несмотря на то, что препарат имеет высокий уровень побочных явлений (головокружение, риск падений) [84].
Таким образом, если OARSI 2014 г., ACR 2012 г. не рекомендуют прием опиодов при ОА коленного сустава, а в AAOS 2013 г. рекомендовался только трамадол, то ESCEO 2019 г., основываясь на последних и убедительных доказательных данных, рекомендует использование слабых опиоидов кратковременными курсами на шаге 3 алгоритма лечения в качестве последней фармакологической попытки перед хирургическим лечением. Кроме того, дулоксетин может быть альтернативой слабым опиоидам на этапе 3 алгоритма, особенно у пациентов с болью в результате центральной сенситизации (слабая рекомендация).
4-й этап: лечение в конечной стадии и хирургические вмешательства
При неэффективности всех предыдущих методов лечения у пациентов с сохраняющейся выраженной симптоматикой и прогрессированием ухудшения качества жизни следует использовать хирургические методы, которые включают полную или частичную замену сустава и остеотомию. В последние годы наблюдалось увеличение числа выполненных операций по замене суставов, что обусловлено старением населения, повышенной потребностью пациентов и увеличением числа операций по замене суставов у более молодых больных [85]. Один из последних сетевых метаанализов делает акцент на том, что функциональные показатели улучшаются именно при тотальном эндопротезировании коленного сустава (ТЭПКС) в долгосрочной перспективе, тогда как однокомпонентная артропластика коленного сустава (ОАК) (замена только поврежденной части коленного сустава) и остеотомия имеют лучшую эффективность в краткосрочной перспективе [86].
Однокомпонентная замена коленного сустава имеет более высокую частоту повторных оперативных вмешательств, однако при ней отмечается меньше осложнений по сравнению с ТЭПКС, включая смертность [87]. Высокая остеотомия большеберцовой кости (ВОБК) показана при однокомпонентном остеоартрите коленного сустава, связанном со смещением, пожилым пациентам старше 60 лет с нормальным индексом массы тела. Обычно ВОБК является операцией выбора при варусных деформациях, артрите и поражении медиального отдела коленного сустава. Это молодой, активный пациент, у которого артропластика в будущем может быть неэффективна вследствие чрезмерного износа протеза. ВОБК фактически сохраняет коленный сустав, включая крестообразные связки, и позволяет пациенту раньше возвращаться к активному образу жизни. По сравнению с артропластикой этот метод лечения требует дополнительного времени заживления, имеет большее количество осложнений, связанных с заживлением кости и возможными переломами, менее эффективен в облегчении боли и, в конечном счете, не заменяет хрящ, который уже утрачен, и не восстанавливает оставшийся хрящ [88]. Однокомпонентная артропластика коленного сустава (ОАК), при которой заменяется только поврежденная часть коленного сустава, — альтернатива ВОБК и ТЭКС. Остеотомия может отсрочить необходимость в эндопротезировании на срок до 10 лет.
ТЭПКС — это вариант хирургического лечения для пациентов, у которых консервативное лечение оказалось неэффективным и с ОА более чем одной области. Оно считается ценным вмешательством для лиц, которые испытывают сильную ежедневную боль, наряду с рентгенографическими признаками ОА коленного сустава 3–4-й стадии. Рабочая группа ESCEO настоятельно рекомендует проводить тотальное эндопротезирование коленного сустава у пациентов с ОА на конечной стадии, что является высокоселективной и экономически эффективной процедурой, хотя и не лишенной неблагоприятных результатов. Роль других хирургических процедур, особенно однокомпонентной замены коленного сустава, требует дальнейшего изучения (сильная рекомендация).
Для пациентов с выраженной симптоматикой, которым хирургическое вмешательство противопоказано или которые не желают ему подвергаться, последним фармакологическим средством могут быть классические пероральные или трансдермальные опиоиды, которые продемонстрировали незначительное или умеренное положительное влияние на боль и функцию при ОА [89]. Их следует назначать в соответствии с рекомендациями по применению опиоидных анальгетиков для лечения нераковых болей [89]. Рабочая группа ESCEO дает слабую рекомендацию по применению классических оральных или трансдермальных опиоидов у пациентов с ОА на конечной стадии коленного сустава, которым операция противопоказана.
Обсуждение рекомендаций ESCEO 2019 г.
Пошаговый алгоритм рекомендаций ESCEO 2019 года по лечению ОА коленного сустава представляет собой своевременное обновление, основанное на оценке текущей литературы (2014–2018), относительно эффективности и безопасности всех методов лечения ОА. ESCEO предполагает, что сочетание методов лечения, включая нефармакологическое и фармакологическое вмешательство, остается ключевым для управления ОА коленного сустава, как указано в обновленном алгоритме лечения. Хотя эффективность нефармакологических методов считается низкой, а данные об экономической эффективности вмешательств ограниченны и неубедительны из-за проблем с качеством испытаний, нефармакологические вмешательства считаются наиболее безопасными. Нефармакологические методы лечения в настоящее время недостаточно используются в клинической практике. Необходимо преодолеть барьеры для более широкого признания эффективности нефармакологических модальностей, популяризировать вмешательства в соответствии с рекомендациями, основанными на фактических данных, и улучшить организацию их проведения.
В качестве 1-го этапа фармакологического лечения рабочая группа ESCEO выступает за использование фоновой терапии хроническими оригинальными рецептурными SYSADOA, в частности, пКГС и ХС. Недавние опасения по поводу профиля безопасности парацетамола подтвердились в последующих исследованиях и обосновали сомнения по поводу его рутинного и хронического применения из-за растущих данных о ЖК, СС и почечной токсичности; таким образом, парацетамол может быть назначен только для кратковременного ургентного обезболивания. Топические НПВП целесообразно добавлять к фоновой терапии на 1-м этапе в качестве периодической анальгезии или использовать вместо пероральных НПВП, особенно у пациентов с ОА в возрасте > 75 лет, а также с сопутствующими заболеваниями или с повышенным риском системных побочных явлений. Если лечение на 1-м этапе демонстрирует недостаточную эффективность SYSADOA или пациентов продолжает беспокоить боль — от умеренной до сильной, необходимо назначение более агрессивных фармакологических методов лечения, таких как пероральные НПВП.
В предыдущем руководстве ESCEO выбор подходящего орального НПВП определялся оценкой пользы и балансом риска, однако недавние метаанализы безопасности НПВП показали, что все нсНПВП и ингибиторы ЦОГ-2 обладают сравнимым потенциалом токсичности для пищеварительной и сердечно-сосудистой систем. Выбор перорального НПВП должен основываться на профиле риска пациента и учитывать уровень риска ЖК или СС побочных эффектов, связанный с каждым НПВП. Целекоксиб (200 мг/день) является предпочтительным НПВП из-за его лучшего общего профиля безопасности.
ВСГК может быть хорошей альтернативой НПВП при ОА коленного сустава, особенно для пожилых пациентов или лиц с повышенным риском развития индуцированных НПВП побочных эффектов или в случае неудачи терапии НПВП, хотя имеющиеся данные не позволяют сделать однозначный вывод. Рабочая группа ESCEO рекомендует использовать инъекции ВСГК для ОА коленного сустава пациентов. ВСГК следует вводить только при ОА коленного сустава после того, как острая воспалительная вспышка утихла, кроме того, для этих пациентов рекомендуют ВС введение глюкокортикоидов для лечения синовита коленного сустава или для купирования сильной боли.
Третий этап фармакологических вмешательств для пациентов с выраженной симптоматикой включает непродолжительный прием слабых опиоидов, таких как трамадол, а также дулоксетина в качестве альтернативы последним, особенно у пациентов с болью в результате центральной сенситизации. Тотальное эндопротезирование коленного сустава целесообразно рекомендовать при полной неэффективности предыдущих методов лечения с сохраняющейся симптоматикой и потерей качества жизни.
Выводы
Несмотря на то, что ОА коленного сустава является одним из наиболее изученных и распространенных заболеваний в популяции, оно до сих пор не имеет четкой патофизиологии и единственного наиболее эффективного вмешательства для лечения симптомов, воспаления и дегенерации хряща, связанных с заболеванием. Рекомендации различных обществ по лечению ОА разнятся, наиболее широкий выбор препаратов представлен в последних рекомендациях ESCEO 2019 года, что позволяет ревматологам и семейным врачам предложить пациентам с ОА коленного состава более широкий выбор фармакологических и нефармакологических вмешательств.
Дальнейшие исследования должны быть направлены на выявление фенотипов пациентов с ОА, особенно на ранних стадиях заболевания. Рабочая группа ESCEO-EUGMS (Общество гериатрической медицины Европейского союза) недавно предложила возможные профили пациентов с ОА, включая наличие 4 клинических фенотипов: биомеханического, остеопоротического, метаболического и воспалительного [90]. Характеристика этих фенотипов поможет должным образом стратифицировать пациентов с ОА в клинических испытаниях или исследованиях, что, в свою очередь, может привести к оптимизации дизайна индивидуализированного лечения ОА.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого участника: Головач И.Ю. — концепция и дизайн работы, обзор литературы по проблеме, написание и коррекция текста; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.
Список литературы
1. Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте. Український ревматологічний журнал. 2014. Т. 2, № 56. C. 4-11.
2. Vos T., Flaxman A.D., Naghavi M. et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012. Vol. 380, № 9859. P. 2163-96.
3. Nuesch E., Dieppe P., Reichenbach S. et al. All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study. BMJ. 2011. Vol. 342. P. 1165.
4. Sharma V., Anuvat K., John L., Davis M. Scientific American Pain Management — Arthritis of the knee. Decker: Pain related disease states. 2017. 276 p.
5. Головач І.Ю. Хворобомодифікуюча терапія остеоартриту в чинних рекомендаціях: уроки минулого та можливості для майбутнього. Травма. 2017. Т. 18, № 3. С. 11-21. doi: http://dx.doi.org/10.22141/1608-1706.3.18.2017.105356.
6. Головач И.Ю. Метаболический фенотип остеоартрита: двойная роль ожирения. Травма. 2017. Т. 18, № 5. C. 87-93.
7. Richards M.M., Maxwell J.S., Weng L. et al. Intra-arti-cular treatment of knee osteoarthritis: from anti-inflammatories to products of regenerative medicine. Phys Sportsmed. 2016. Vol. 44, № 2. P. 101-8.
8. Sellam J., Berenbaum F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nat. Rev. Rheumatol. Vol. 6, № 11. P. 625-35.
9. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage. 2014. Vol. 22, № 3. P. 363-88.
10. Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. American College of Rheumatology. Arthritis Care Res (Hoboken). 2012. Vol. 64, № 4. P. 465-74.
11. Jevsevar D.S. Treatment of osteoarthritis of the knee: evidence-based guideline, 2nd edition. J. Am. Acad. Orthop. Surg. 2013. Vol. 21, № 9. P. 571-6.
12. Honvo G., Bannuru R.R., Bruyere O. et al. The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) recommendations for the reporting of harms in studies assessing drugs to be used in osteoarthritis: a consensus statement from a working group on the safety of anti-osteoarthritis medications. Drugs Aging. 2019. Vol. 36, № 1. P. 145-59.
13. Alrushud A.S., Rushton A.B., Kanavaki A.M. et al. Effect of physical activity and dietary restriction interventions on weight loss and the musculoskeletal function of overweight and obese older adults with knee osteoarthritis: a systematic review and mixed method data synthesis. BMJ Open. 2017. Vol. 7, № 6. P. 014537.
14. Quintrec J.-L.L., Verlhac B., Cadet C. et al. Physical exercise and weight loss for hip and knee osteoarthritis in very old patients: a systematic review of the literature. Open Rheumatol J. 2014. Vol. 8, P. 89-95.
15. Tanaka R., Ozawa J., Kito N. et al. Efficacy of strengthening or aerobic exercise on pain relief in people with knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Clin Rehabil. 2013. Vol. 27, № 12. P. 1059-1071.
16. Messier S.P., Gutekunst D.J., Davis C., Devita P. Weight loss reduces knee-joint loads in overweight and obese older adults with knee osteoarthritis. Arthritis Rheum. 2005. Vol. 52, № 7. P. 2026-2032.
17. Bliddal H., Leeds A.R., Christensen R. Osteoarthritis, obesity and weight loss: evidence, hypotheses and horizons — a scoping review. Obes. Rev. 2014. Vol. 15, № 7. Р. 578-586. doi: 10.1111/obr.12173.
18. Dulay G.S., Cooper C., Dennison E.M. Knee pain, knee injury, knee osteoarthritis & work. Best Pract. Res. Clin. Rheumatol. 2015. Vol. 29, № 3. P. 454-461.
19. Penny P., Geere J., Smith T.O. A systematic review investigating the efficacy of laterally wedged insoles for medial knee osteoarthritis. Rheumatol. Int. 2013. Vol. 33, № 10. P. 2529-38.
20. Woods B., Manca A., Weatherly H. et al. Cost-effectiveness of adjunct non-pharmacological interventions for osteoarthritis of the knee. PLoS One. 2017. Vol. 12, № 3. P. 0172749.
21. Selten E.M., Vriezekolk J.E., Nijhof M.W. et al. Barriers impeding the use of non-pharmacological, nonsurgical care in hip and knee osteoarthritis: the views of general practitioners, physical therapists, and medical specialists. J. Clin. Rheumatol. 2017. Vol. 23, № 8. P. 405-10.
22. Bannuru R.R., Schmid C.H., Kent D.M. et al. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis. Ann. Intern. Med. 2015. Vol. 162, № 1. P. 46-54.
23. Bruyere O., Cooper C., Pelletier J.P. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis. Rheum. 2014. Vol. 44, № 3. P. 253-63.
24. Conaghan P.G., Arden N., Avouac B. et al. Safety of paracetamol in osteoarthritis: what does the literature say? Drugs Aging. 2019. Vol. 36, № 1. P. 7-14.
25. Roberts E., Delgado Nunes V., Buckner S. et al. Paracetamol: not as safe as we thought? A systematic literature review of observational studies. Ann. Rheum. Dis. 2016. Vol. 75, № 3. P. 552-9.
26. De Wan M., Volpi G., inventors; Rottapharm, assignee. A method of preparing mixed glucosamine salts. US patent 5,847,107. https://patents.google.com/ patent/US5847107A/en. Accessed 8 January 2019. USA patent 5,847,107. 1998.
27. Kucharz E.J., Kovalenko V., Szanto S. et al. A review of glucosamine for knee osteoarthritis: why patented crystalline glucosamine sulfate should be differentiated from other gluco-samines to maximize clinical outcomes. Curr. Med. Res. Opin. 2016. Vol. 32, № 6. P. 997-1004.
28. Runhaar J., Rozendaal R.M., Middelkoop M.V. et al. Subgroup analyses of the effectiveness of oral glucosamine for knee and hip osteoarthritis: a systematic review and individual patient data metaanalysis from the OA trial bank. Ann. Rheum. Dis. 2017. Vol. 76, № 11. P. 1862-9.
29. Conaghan P.G., Arden N., Avouac B. et al. Safety of paracetamol in osteoarthritis: what does the literature say? Drugs Aging. 2019. Vol. 36, № 1. P. 7-14.
30. Rovati L.C., Girolami F., D’Amato M., Giacovelli G. Effects of glucosamine sulfate on the use of rescue non-steroidal anti-inflammatory drugs in knee osteoarthritis: results from the Pharmaco-Epidemiology of GonArthroSis (PEGASus) study. Semin Arthritis Rheum. 2016. Vol. 45, № 3. P. 34-41.
31. Gregori D., Giacovelli G., Minto C. et al. Association of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis. JAMA. 2018. Vol. 320, № 24. P. 2564-79.
32. Runhaar J., Rozendaal R.M., Middelkoop M.V. et al. Subgroup analyses of the effectiveness of oral glucosamine for knee and hip osteoarthritis: a systematic review and individual patient data metaanalysis from the OA trial bank. Ann. Rheum. Dis. 2017. Vol. 76, № 11. P. 1862-9.
33. Reginster J.Y., Dudler J., Blicharski T., Pavelka K. Pharmaceutical-grade Chondroitin sulfate is as effective as celecoxib and superior to placebo in symptomatic knee osteoarthritis: the ChONdroitin versus CElecoxib versus Placebo Trial (CONCEPT). Ann. Rheum. Dis. 2017. Vol. 76, № 9. P. 1537-43.
34. Pelletier J.P., Raynauld J.P., Beaulieu A.D. et al. Chondroitin sulfate efficacy versus celecoxib on knee osteoarthritis structural changes using magnetic resonance imaging: a 2-year multicentre exploratory study. Arthritis. Res. Ther. 2016. Vol. 18, № 1. P. 256.
35. Roman-Blas J.A., Castaneda S., Sanchez-Pernaute O. et al., Group CGCTS. Combined treatment with chondroitin sulfate and glucosamine sulfate shows no superiority over placebo for reduction of joint pain and functional impairment in patients with knee osteoarthritis: a six-month multicenter, randomized, double-blind, placebo-controlled clinical trial. Arthritis. Rheumatol. 2017. Vol. 69, № 1. P. 77-85.
36. Jackson C.G., Plaas A.H., Sandy J.D. et al. The human pharmacokinetics of oral ingestion of glucosamine and chondroitin sulfate taken separately or in combination. Osteoarthritis Cartilage. 2010. Vol. 18, № 3. P. 297-302.
37. Christiansen B.A., Bhatti S., Goudarzi R., Emami S. Management of osteoarthritis with avocado/soybean unsaponifiables. Cartilage. 2015. Vol. 6, № 1. P. 30-44.
38. Appelboom T., Schuermans J., Verbruggen G. et al. Symptoms modifying effect of avocado/soybean unsaponifiables (ASU) in knee osteoarthritis. A double blind, prospective, placebo-controlled study. Scand J Rheumatol. 2001. Vol. 30, № 4. P. 242-7.
39. Maheu E., Cadet C., Marty M. et al. Randomised, controlled trial of avocado-soybean unsaponifiable (Piascledine) effect on structure modification in hip osteoarthritis: the ERADIAS study. Ann. Rheum. Dis. 2014. Vol. 73, № 3. P. 376-84.
40. Martel-Pelletier J., Pelletier J.P. Effects of diacerein at the molecular level in the osteoarthritis disease process. Ther. Adv. Musculoskelet Dis. 2010. Vol. 2, № 2. P. 95-104.
41. Dougados M., Nguyen M., Berdah L. et al. Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the chondromodulating effect of diacerein in OA of the hip. Arthritis Rheum. 2001. Vol. 44, № 11. P. 2539-47.
42. EMA. European Medicines Agency. Assessment report for diacerein containing medicinal products. EMA/527347/2014. Available from: http://www.ema. europa.eu/docs/en GB/document library/Referrals document/Diacerein/European Commission final decision/WC500173145.pdf
43. Honvo G., Reginster J.-Y., Rabenda V. et al. Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging. 2019. Vol. 36, № 1. P. 65-99.
44. Pelletier J.P., Martel-Pelletier J. Diacerein-containing products: same risk of diarrhoea? Aging Clin. Exp. Res. 2018. Vol. 30, № 4. P. 411-2.
45. Pavelka K., Bruyere O., Cooper C. et al. Diacerein: benefits, risks and place in the management of osteoarthritis. An opinion-based report from the ESCEO. Drugs Aging. 2016. Vol. 33, № 2. P. 75-85.
46. Sardana V., Burzynski J., Zalzal P. Safety and efficacy of topical ketoprofen in transfersome gel in knee osteoarthritis: a systematic review. Musculoskeletal Care. 2017. Vol. 15, № 2. P. 114-21.
47. Wadsworth L.T., Kent J.D., Holt R.J. Efficacy and safety of diclofenac sodium 2 % topical solution for osteoarthritis of the knee: a randomized, double-blind, vehiclecontrolled, 4 week study. Curr. Med. Res. Opin. 2016. Vol. 32, № 2. P. 241.
48. Zeng C., Wei J., Persson M.S. et al. Relative efficacy and safety of topical non-steroidal anti-inflammatory drugs for osteoarthritis: a systematic review and network meta-analysis of randomised controlled trials and observational studies. Br. J. Sports Med. 2018. Vol. 52, № 10. P. 642-650.
49. Chou R., McDonagh M.S., Nakamoto E., Griffin J. Analgesics for osteoarthritis: an update of the 2006 comparative effectiveness review. 2011. Rockville MD: Available from: http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0016485/pdf/TOC.pdf. [Accessed 27 April, 2018].
50. Sardana V., Burzynski J., Zalzal P. Safety and efficacy of topical ketoprofen in transfersome gel in knee osteoarthritis: a systematic review. Musculoskeletal Care. 2017. Vol. 15, № 2. P. 114-21.
51. da Costa B.R., Reichenbach S., Keller N. et al. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet. 2017. Vol. 390, № 10090. P. 21-33.
52. Jung S.Y., Jang E.J., Nam S.W. et al. Comparative effectiveness of oral pharmacologic interventions for knee osteoarthritis: a network meta-analysis. Mod. Rheumatol. 2018. Vol. 28, № 6. P. 1021-8.
53. Puljak L., Marin A., Vrdoljak D. et al. Celecoxib for osteoarthritis. Cochrane Database Syst. Rev. 2017. Vol. 5. P. 009865.
54. Gregori D., Giacovelli G., Minto C. et al. Association of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis. JAMA. 2018. Vol. 320, № 24. P. 2564-79.
55. Cooper C., Chapurlat R., Al-Daghri N. et al. Safety of oral non-selective non-steroidal anti-inflammatory drugs in osteoarthritis: what does the literature say? Drugs Aging. 2019. Vol. 36, № 1. P. 15-24.
56. Bhala N., Emberson J., Merhi A. et al Coxib and traditional NSAID Trialists' (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013. Vol. 382, № 9894. P. 769-79.
57. Mallen S.R., Essex M.N., Zhang R. Gastrointestinal tolerability of NSAIDs in elderly patients: a pooled analysis of 21 randomized clinical trials with celecoxib and nonselective NSAIDs. Curr. Med. Res. Opin. 2011. Vol. 27, № 7. P. 1359-66.
58. Gunter B.R., Butler K.A., Wallace R.L. et al. Non-steroidal antiinflammatory drug-induced cardiovascular adverse events: a meta-analysis. J. Clin. Pharm. Ther. 2017. Vol. 42, № 1. P. 27-38.
59. Ungprasert P., Matteson E.L., Thongprayoon C. Nonaspirin nonsteroidal antiinflammatory drugs and risk of hemorrhagic stroke: a systematic review and meta-analysis of observational studies. Stroke. 2016. Vol. 47, № 2. P. 356-64.
60. Bally M., Beauchamp M.E., Abrahamowicz M. et al. Risk of acute myocardial infarction with real-world NSAIDs depends on dose and timing of exposure. Pharmacoepidemiol Drug Saf. 2018. Vol. 27, № 1. P. 69-77.
61. Zhou Y., Boudreau D.M., Freedman A.N. Trends in the use of aspirin and nonsteroidal anti-inflammatory drugs in the general U.S. population. Pharmacoepidemiol. Drug Saf. 2014. Vol. 23, № 1. P. 43-50.
62. Ungprasert P., Cheungpasitporn W., Crowson C.S., Matteson E.L. Individual nonsteroidal anti-inflammatory drugs and risk of acute kidney injury: a systematic review and meta-analysis of observational studies. Eur. J. Intern. Med. 2015. Vol. 26, № 4. P. 285-91.
63. Cooper C., Rannou F., Richette P. et al. Use of intraarticular hyaluronic acid in the management of knee osteoarthritis in clinical practice. Arthritis Care Res (Hoboken). 2017. Vol. 69, № 9. P. 1287-96.
64. Pelletier J.P., Raynauld J.P., Abram F. et al. Exploring determinants predicting response to intra-articular hyalu-ronic acid treatment in symptomatic knee osteoarthritis: 9-year follow-up data from the Osteoarthritis Initiative. Arthritis Res. Ther. 2018. Vol. 20, № 1. P. 40.
65. Bannuru R.R., Vaysbrot E.E., Sullivan M.C., McAlindon T.E. Relative efficacy of hyaluronic acid in comparison with NSAIDs for knee osteoarthritis: a systematic review and meta-analysis. Semin. Arthritis Rheum. 2014. Vol. 43, № 5. P. 593-9.
66. Xing D., Wang B., Liu Q. et al. Intra-articular hyaluro-nic acid in treating knee osteoarthritis: a PRISMA-compliant systematic review of overlapping meta-analysis. Sci Rep. 2016. Vol. 6. P. 32790.
67. Strand V., McIntyre L.F., Beach W.R. et al. Safety and efficacy of USapproved viscosupplements for knee osteoarthritis: a systematic review and meta-analysis of randomized, saline-controlled trials. J. Pain Res. 2015. Vol. 8. P. 217-28.
68. Concoff A., Sancheti P., Niazi F., Shaw P., Rosen J. The efficacy of multiple versus single hyaluronic acid injections: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2017. Vol. 18, № 1. P. 542.
69. Delbarre A., Amor B., Bardoulat I. et al. Do intra-articular hyaluronic acid injections delay total knee replacement in patients with osteoarthritis — A Cox model analysis. PLoS One. 2017. Vol. 12, № 11. P. 0187227.
70. McIntyre L.F., Bhattacharyya S., Yadalam S. et al. Impact of hyaluronic acid injections in utilisation of pain management medications. Am. J. Pharm. Benefits. 2017. Vol. 9, № 6. P. 195-9.
71. Altman R.D., Bedi A., Karlsson J. et al. Product differences in intra-articular hyaluronic acids for osteoarthritis of the knee. Am. J. Sports Med. 2016. Vol. 44, № 8. P. 2158-65.
72. Rutjes A.W., Juni P., da Costa B.R. et al. Viscosupplementation for osteoarthritis of the knee: a systematic review and meta-analysis. Ann. Intern. Med. 2012. Vol. 157, № 3. P. 180-91.
73. van Middelkoop M., Arden N.K., Atchia I. et al. The OA trial bank: meta-analysis of individual patient data from knee and hip osteoarthritis trials show that patients with severe pain exhibit greater benefit from intra-articular glucocorticoids. Osteoarthritis Cartilage. 2016. Vol. 24, № 7. P. 1143-52.
74. Dorleijn D.M., Luijsterburg P.A., Reijman M. et al. Intramuscular glucocorticoid injection versus placebo injection in hip osteoarthritis: a 12-week blinded randomised controlled trial. Ann. Rheum. Dis. 2018. Vol. 77, № 6. P. 875-82.
75. McAlindon T.E., LaValley M.P., Harvey W.F. et al. Effect of intra-articular triamcinolone vs saline on knee cartilage volume and pain in patients with knee osteoarthritis: a randomized clinical trial. JAMA. 2017. Vol. 317. № 19. P. 1967-75.
76. Ayhan E., Kesmezacar H., Akgun I. Intraarticular injections (corticosteroid, hyaluronic acid, platelet rich plasma) for the knee osteoarthritis. World J. Orthop. 2014. Vol. 5, № 3. P. 351-361.
77. Gay C., Chabaud A., Guilley E., Coudeyre E. Educating patients about the benefits of physical activity and exercise for their hip and knee osteoarthritis. System literature review. Ann. Phys. Rehabil. Med. 2016. Vol. 59, № 3. P. 174-83.
78. Ferreira R.M., Duarte J.A., Goncalves R.S. Non-pharmacological and non-surgical interventions to manage patients with knee osteoarthritis: an umbrella review. Acta Reumatol. Port. 2018. Vol. 43, № 3. P. 182-200.
79. Yavuz U., Sökücü S., Albayrak A., Oztürk K. Efficacy comparisons of the intraarticular steroidal agents in the patients with knee osteoarthritis. Rheumatol. Int. 2012. Vol. 32, № 11. P. 3391-6.
80. Pelletier J.P., Martel-Pelletier J., Rannou F., Cooper C. Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: evidence from reallife setting trials and surveys. Semin. Arthritis Rheum. 2016. Vol. 45, № 4. P. 22-7.
81. Avouac J., Gossec L., Dougados M. Efficacy and safety of opioids for osteoarthritis: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage. 2007. Vol. 15, № 8. P. 957-65.
82. Tagarro I., Herrera J., Barutell C. et al. Effect of a simple dose-escalation schedule on tramadol tolerability: assessment in the clinical setting. Clin. Drug Investig. 2005. Vol. 25, № 1. P. 23-31.
83. Fuggle N., Curtis E., Shaw S. et al. Safety of opioids in osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging. 2019. Vol. 36, № 1. P. 129-43.
84. Wang Z.Y., Shi S.Y., Li S.J. et al. Efficacy and safety of duloxetine on osteoarthritis knee pain: a meta-analysis of randomized controlled trials. Pain Med. 2015. Vol. 16, № 7. P. 1373-85.
85. Leskinen J., Eskelinen A., Huhtala H. et al. The incidence of knee arthroplasty for primary osteoarthritis grows rapidly among baby boomers: a population-based study in Finland. Arthritis Rheumatism. 2012. Vol. 64, № 2. P. 423-8.
86. Liu C.Y., Li C.D., Wang L. et al. Function scores of different surgeries in the treatment of knee osteoarthritis: a PRISMA-compliant systematic review and network-meta analysis. Med (Baltimore). 2018. Vol. 97, № 21. P. 10828.
87. Liddle A.D., Judge A., Pandit H., Murray D.W. Adverse outcomes after total and unicompartmental knee replacement in 101,330 matched patients: a study of data from the National Joint Registry for England and Wales. Lancet. 2014. Vol. 384, № 9952. P. 1437-45.
88. Aweid O., Haider Z., Saed A., Kalairajah Y. Treatment modalities for hip and knee osteoarthritis: A systematic review of safety. J. Orthop. Surg (Hong Kong). 2018. Vol. 26 (3). P. 2309499018808669.
89. Manchikanti L., Kaye A.M., Knezevic N.N. et al. Responsible, safe, and effective prescription of opioids for chronic non-cancer pain: American Society of Interventional Pain Physicians (ASIPP) guidelines. Pain Phys. 2017. Vol. 20, № 2. P. 3-92.
90. Herrero-Beaumont G., Roman-Blas J.A., Bruyere O. et al. Clinical settings in knee osteoarthritis: pathophysiology guides treatment. Maturitas. 2017. Vol. 96. P. 54-7.

/32.jpg)
/40.jpg)