Резюме
Збагачену тромбоцитами плазму (Platelet-rich plasma, PRP) запропоновано для використання у клітинній терапії артрозу колінного суглоба. У цьому дослідженні ми поставили за мету визначити вплив PRP та стан прооксидантно-антиоксидантного балансу і продуктів пероксидного окислення крові при дистрофічних змінах колінного суглоба при атрозі. PRP отримували зі свіжої крові донорів у концентрації 0,8–1 • 106/мл і вводили у колінний суглоб через 1 місяць після моделювання артрозу у кроликів. Через 2,5 місяця у сироватці крові кроликів вимірювали концентрацію продуктів вільнорадикального окислення білків, ТБК-активних продуктів, дієнових кон’югат, церулоплазміну і відновленого глутатіону. Оцінювали активність каталази, супероксиддисмутази (СОД), параоксонази-1 і лейкоцитарної еластази та мієлопероксидази. Локальне введення PRP об’ємом 0,5 мл у суглобову порожнину зменшувало дистрофічні зміни хрящової суглобової поверхні, що визначено гістологічними дослідженнями. Показано зменшення активності лейкоцитарної еластази і мієлопероксидази, концентрації продуктів пероксидації (дієнових кон’югат, ТБК-активних продуктів, продуктів вільнорадикального окислення білків), відновлення активності ензимів антиоксидантої системи (каталази, СОД) і церулоплазміну. Зменшення активності ензимів лейкоцитів периферійної крові можна вважати одним із показників зменшення запального процесу при артрозі, а відновлення прооксидантно-антиоксидантного балансу — запобігання дистрофічним змінам хрящової тканини під впливом PRP.
Обогащенная тромбоцитами плазма (Platelet-rich plasma, PRP) предложена для использования в клеточной терапии артроза коленного сустава. В этом исследовании мы поставили цель определить влияние PRP и состояния прооксидантно-антиоксидантного баланса и продуктов пероксидного окисления крови при дистрофических изменениях коленного сустава при артрозе. PRP получали из свежей крови доноров в концентрации 0,8–1 • 106/мл и вводили в коленный сустав через 1 месяц после моделирования артроза у кроликов. Через 2,5 месяца в сыворотке крови кроликов измеряли концентрацию продуктов свободнорадикального окисления белков, ТБК-активных продуктов, диеновых конъюгат, церулоплазмина и восстановленного глутатиона. Оценивали активность каталазы, супероксиддисмутазы (СОД), параоксоназы-1 и лейкоцитарной эластазы и миелопероксидазы. Локальное введение PRP в объеме 0,5 мл в суставную полость уменьшало дистрофические изменения хрящевой суставной поверхности, что определено гистологическими исследованиями. Показано уменьшение активности лейкоцитарной эластазы и миелопероксидазы, концентрации продуктов пероксидации (диеновых конъюгат, ТБК-активных продуктов, продуктов свободнорадикального окисления белков), восстановление активности энзимов антиоксидантов системы (каталазы, СОД) и церулоплазмина. Уменьшение активности ферментов лейкоцитов периферической крови можно считать одним из показателей уменьшения воспалительного процесса при артрозе, а восстановление прооксидантно-антиоксидантного баланса — предупреждения дистрофических изменений хрящевой ткани под воздействием PRP.
Platelet-rich plasma (PRP) has been proposed for use in cellular therapy of the knee arthrosis. In this study, we aimed to determine the effect of PRP on the state of the prooxidant-antioxidant balance and the product of peroxidation of the blood in dystrophic changes associated with the knee arthrosis. PRP was obtained from donor fresh blood at a concentration of 0.8–1 • 106 per 1 ml and was injected into the knee joint one month after modeling of arthrosis in rabbits. After 2.5 months, the concentration of free radical oxidation products of proteins, TBK-active products, diene conjugates, ceruloplasmin and reduced glutathione was measured in rabbit serum. The activity of catalase, SOD, paraoxonase-1 and leukocyte elastase and myeloperoxidase was evaluated. Local administration of 0.5 ml of PRP into the joint cavity was found to reduce dystrophic changes in the cartilage of the articular surface, as determined by the histological examination. The results of the study demonstrated the reduced activity of leukocyte elastase myeloperoxidase, the concentration of peroxidation products (diene conjugates, TBA-active products, products of free radical oxidation of proteins), restoration of activity of antioxidant system enzymes (catalase, SOD) and ceruloplasmin. The decrease in the activity of the enzymes of peripheral blood leukocytes can be considered as one of the indicators of reduction of the inflammatory process in arthrosis, and the restoration of the prooxidant-antioxidant balance may prevent dystrophic changes of the cartilage under the influence of PRP.
Вступ
Артроз колінного суглоба — це дистрофічне захворювання суглоба, що викликане запальною реакцією і призводить до пошкодження та втрати суглобового хряща, болю та обмеженої рухливості [1]. Під час запалення у пошкоджений суглоб мігрують лейкоцити і виділяють протеїнази, такі як еластаза і мієлопероксидаза нейтрофілів [2]. Збільшення рівня протеолітичних ензимів у синовіальній рідині і тканинах суглоба руйнує колаген та протеоглікани суглобового хряща [3], що є причиною прогресуючого руйнування суглобів [4]. Хрящові поверхні колінного суглоба позбавлені судин, а трофіка відбувається через судини синовіальної капсули, тому суглоб має обмежений потенціал до відновлення, а пошкодження судин капсули ще більше погіршує стан пошкодженого суглоба [5].
Для лікування дистрофічних захворювань суглоба запропоновано використання автологічної плазми з підвищеним вмістом тромбоцитів (PRP). PRP одержують як продукт плазмаферезу крові, концентрація тромбоцитів у якій кратно перевищує вихідні значення у крові (6 • 103–7 • 108/мл) [6, 7]. Стратегію застосування PRP пояснюють трофічною дією факторів росту (PDGF, VEGF, FGF та інші), що виділяються тромбоцитами і мають регенеративні властивості [8]. У деяких статтях показано, що вивільнення факторів росту тромбоцитами відбувається протягом 1 години [9], а кількість пошкоджених тромбоцитів при одержанні PRP не перевищує 20 % [10]. Локальні високі концентрації факторів росту можуть бути корисними для підтримки нормального функціонування тканин суглоба, але, незважаючи на це, існує полеміка щодо цитотрофічної дії та безпеки PRP [11, 12].
У цьому дослідженні ми висунули гіпотезу, що PRP сприяє підтримці суглобового хряща при артрозі, тим самим зменшуючи інтенсивність запалення і пошкодження суглоба, що можна оцінити за біохімічними показниками крові.
Мета роботи: оцінка впливу тромбоцитарної плазми на біохімічні показники крові в експериментальній моделі остеоартрозу колінного суглоба.
Матеріали та методи
Дослідження проведене на кроликах вагою 3–4 кг, які були розділені на 3 групи: контрольну (n = 4), групу артрозу (n = 5) і групу артрозу + PRP (n = 4). Тварин утримували в стандартних умовах віварію Національного медичного університету імені О.О. Богомольця при вільному доступі до води та їжі, на однаковому харчовому раціоні згідно з нормами утримання лабораторних тварин. Всі маніпуляції проводили згідно з правилами роботи з експериментальними тваринами та Європейської конвенції про захист тварин, які використовуються в експериментальних дослідженнях. Модель остеоартрозу полягала у механічному пошкодженні суглобової поверхні великогомілкової кістки. Тварин наркотизували тіопенталом натрію в дозі 60–80 мг/кг (внутрішньоочеревинно). Тварин у стані наркотичного сну фіксували у положенні на спині. Ділянку шкіри навколо колінного суглоба голили та зрошували бетадином (Egis, Угорщина). Скальпелем здійснювали доступ до колінного суглоба через медіальну поверхню кінцівки. Перетинали велику гомілкову зв’язку, шляхом циркулярних обертів модифікованою шпицею Ілізарова з механічним обмежувачем наносили пошкодження у центральній ділянці суглобової поверхні низькообертовим приводом (1000 ± 5 об/хв). Стандартизована площа ураження — 2,0 × 2,1 мм. Суглобову сумку зашивали шовним матеріалом 3/0 (Prolene, Ethicon Inc., США). Здійснювали термічну коагуляцію судин суглобової сумки після зашивання сумки, що дозволило додатково здійснити ішемічне пошкодження тканин суглоба. Площа термічного ураження — 9,5–10,0 мм2. Епіфізарну поверхню стегнової кістки залишали інтактною. Шкіру на рівні доступу також зашивали матеріалом 3/0 і зрошували бетадином.
Через 1 місяць тваринам у суглобову порожнину одноразово вводили PRP об’ємом 0,5 мл. Забір донорської крові проведено у ДУ «ІТО НАМН України» згідно з ліцензією Міністерства охорони здоров’я України. Для отримання PRP венозну кров здорових тварин збирали в стерильні пластикові пробірки об’ємом 10 мл, що містили антикоагулянт (3,8% цитрат натрію), та центрифугували при 400 g 15 хв (t = 4 °С), як це описано у стандартному протоколі [13]. Для введення здійснювали забір шару PRP над еритроцитарною масою. Концентрація тромбоцитів — 0,8–1 • 106/мл. Використання донорської крові для отримання PRP не суперечить методиці, а дію гетерологічної крові у кроликів показано в публікаціях [14, 15].
Через 2,5 місяця після початку моделювання артрозу (1,5 місяця після введення PRP) тварин виводили з експерименту шляхом швидкої декапітації. Артроз суглобової поверхні великогомілкової кістки підтверджували гістологічним методом. Анатомічні утворення суглоба фіксували протягом 3 днів у 10% розчині нейтрального формаліну. Після фіксації виділяли епіфіз великогомілкової кістки. Зразки промивали і проводили декальцинацію у розчині OsteoFast 2 (BioGnost Ltd., Хорватія) впродовж 4–5 тижнів (3 зміни декальцинуючого розчину). Після завершення декальцифікації проби промивали у проточній воді. Із зразків отримували кріозрізи товщиною 20–25 мкм. Зрізи забарвлювали толуїдиновим синім за Шморлем. Гістологічні зрізи поміщали під покривне скельце у синтетичний бальзам. Препарати суглобової поверхні досліджували на мікроскопі Olympus BX 51. Вимірювали товщину суглобового хряща морфометрично, з використанням програмного забезпечення Carl Zeiss (AxioVision SE64 Rel.4.9.1).
Арилестеразну активність параоксонази-1 (ЕС 3.1.1.2) визначали спектрофотометрично за швидкістю перетворення фенілацетату на фенол при 270 нм [16]. Пероксидазну активність мієлопероксидази (ЕС 1.11.1.7) в плазмі крові оцінювали за окисленням хромогенного субстрату 3,3’-диметоксибензидин (Acrosorganics, Бельгія) (3,8 мМ). Для виключення можливого впливу на результат інших пероксидаз в плазму додавали інгібітор МПО — гідразид 4-амінобензойної кислоти (Acrosorganics, Бельгія) (50 мкМ). Реакцію запускали додаванням Н2О2 в концентрації 100 мкМ і в кінетичному режимі протягом 68 хв. Реєстрували швидкість зниження оптичної щільності при 460 нм (Δ460/хв) на СФ-46 при 23 °С [17]. Активність лейкоцитарної еластази (ЕС 3.4.21.37) визначали за швидкістю гідролізу N-тетрабутоксикарбонілаланін-р-нітрофенілового ефіру (BOC-Ala-ONp) (Sigma) спектрофотометрично при 347 нм [18]. Супероксиддисмутазну активність (EC 1.15.1.1) визначали за зниженням інтенсивності автоокислення адреналіну в адренохром [19]. Швидкість спонтанного окислення адреналіну визначали спектрофлуорометрично (510 нм emission, 410 нм excitation), додаючи до інкубаційного середовища (0,1 мM ЕДТА, 0,05 MNa2CO3) 1-мM розчин адреналіну (Sigma) в 0,1 NHCl. Активність каталази (EC 1.11.1.6) в пробах визначали спектрофотометричним методом за здатністю Н2О2 утворювати стійкий забарвлений комплекс з солями молібдену [20].
Вміст продуктів, що реагують з тіобарбітуровою кислотою, визначали спектрофотометричним методом [21].
Вміст церулоплазміну визначали спектрофотометричним методом за окисленням р-фенілендіаміну за участі церулоплазміну [22]. Вміст відновленого глутатіону визначали спектрофотометричним методом в реакції з 5,5’-дитіобіс-(2-нітробензойною) кислотою [23].
Статистичну оцінку проводили за непараметричним критерієм Краскела — Уолліса (ANOVA followedby Kruskal-Wallis). Вибірки даних аналізували з використанням програмного забезпечення Origin Labversion 8.0. Різницю вважали статистично вірогідною при P < 0,05.
Усі маніпуляції з тваринами проведено згідно з правилами Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей (Страсбург, 1986), рекомендацій «Біоетична експертиза доклінічних та інших наукових досліджень, що виконуються на тваринах» (Київ, 2006), а також погоджено з комітетом біоетики ДУ «ІТО НАМН України».
Результати та обговорення
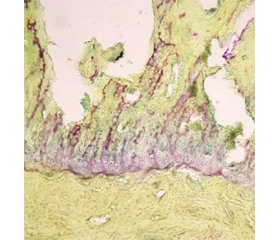
Через 2,5 місяця після початку моделювання артрозу встановлено структурні зміни суглобового хряща великогомілкової кістки. Навколо зони дефекту виявлено набряк хряща, зменшення товщини і редукцію хондроцитів. Місце механічного пошкодження (1,8–2,2 мм) збільшилось за площею, але чіткої межі між порушеним і незміненим хрящем провести не вдалось. Спільною ознакою дистрофічних змін хрящової поверхні були загибель і редукція ізогенних груп хондроцитів, набряк за рахунок збільшення порожніх лакун хондроцитів (рис. 1). Встановлено вірогідне зменшення товщини суглобового хряща за межами ділянки первинного пошкодження. Так, усереднене значення товщини суглобового хряща за даними морфометрії становило: контрольна група — 1487,9 (1305,5–1666,9) мкм; група артрозу — 1034,8 (412,8–1565,4) мкм; група артрозу + PRP — 1265,15 (878,5–1514,2) мкм.
За умов застосування PRP спостерігалось зменшення пошкодження суглобової поверхні (P < 0,05).
У тварин з експериментальним артрозом виявлено зміни досліджуваних біохімічних показників крові (табл. 1). Встановлено статистично значуще збільшення вмісту продуктів окиснення ліпідів і протеїнів — дієнових кон’югат (у 1,7 раза), ТБК-активних продуктів (у 2,1 раза) і продуктів окисної модифікації протеїнів (у 1,4 раза) (P < 0,05). Показники ензиматичних і неензиматичних складових антиоксидантної системи крові були вірогідно знижені порівняно з контролем: активність каталази — в 1,4 раза, супероксиддисмутази — в 1,3 раза і параоксонази-1 — в 1,8 раза, рівень відновленого глутатіону — в 1,7 раза (P < 0,05). Показники активності лізосомальних ензимів нейтрофілів периферійної крові — еластази і мієлопероксидази — були вірогідно збільшені порівняно з контролем — відповідно у 2,1 і 2,7 раза (P < 0,05). Рівень церулоплазміну зростав порівняно з контрольними значеннями на 44,3 % (Р < 0,05).
/48.jpg)
Застосування PRP через 1 місяць після початку моделювання артрозу призводило до вірогідного (щодо групи тварин з експериментальним артрозом) зменшення активності еластази і мієлопероксидази, вмісту продуктів окисної модифікації ліпідів та протеїнів і зростання рівня відновленого глутатіону на термін спостереження 2,5 місяця. При цьому показники прозапальної активності лейкоцитів крові (активність еластази і мієлопероксидази), активності параоксонази-1 і вмісту продуктів окисної модифікації ліпідів та протеїнів не досягали контрольних значень, але були вірогідно кращими, ніж у групі тварин, яким не вводили PRP. У жодному з експериментальних випадків, у яких було застосовано PRP, не виявлено погіршення досліджуваних показників крові, які можуть вказувати на запалення та пошкодження тканин в організмі, що є свідченням біологічної безпечності PRP при введенні у колінний суглоб.
Таким чином, у дослідженні відтворено модель артрозу колінного суглоба. Поставлено завдання досягти максимальної відповідності патогенетичних структурно-функціональних аспектів пошкодження суглоба. Механічне пошкодження суглобового хряща великогомілкової кістки у місці перетину великої гомілкової зв’язки і термокоагуляція судин капсули суглоба викликали прогресуючі дистрофічні зміни суглобового хряща і запальну інфільтрацію лейкоцитів (моноцитів і нейтрофілів) у капсулу. Виявлені гістологічні зміни в капсулі та суглобовій поверхні відповідали описаним у літературі та дозволяють порівнювати власні результати з тими, що описують щодо артрозу колінного суглоба [24].
З лікувальною метою для поліпшення стану сугло-бового хряща через 1 місяць після початку моделювання артрозу PRP одноразово вводили у порожнину колінного суглоба, хоча в літературі описують як одноразові, так і курсові введення PRP або PRP з фібрином [25, 26]. При використанні гетерологічної крові для отримання PRP у дослідженнях з кроликами також не повідомлялося про виявлені побічні ефекти [14, 15] і навіть була розроблена ліофілізована форма PRP для терапевтичного лікування [27]. У дослідженні використано саме таку методику отримання PRP з цільної венозної крові, оскільки PRP за аналогічним методом і складом вже використовується у травматології та ортопедії [28].
Результати біохімічних досліджень засвідчили прозапальний характер змін величини досліджуваних показників крові у тварин з експериментальним артрозом. Відомо, що ензими еластаза і мієлопероксидаза містяться головним чином у нейтрофілах, найбільш численній групі лейкоцитів крові, та вивільняються при їх активації. Активність цих ензимів є показником розвитку запальної реакції при артриті й артрозі [29, 30]. У випадку зв’язування мієлопероксидази з ендотелієм та її активації можливе локальне загострення запалення судин [31]. Наявність ензимів нейтрофілів в синовіальній рідині вказує на те, що лейкоцити (нейтрофіли та макрофаги) екставазуються в уражений суглоб, а висока активність цих ензимів у крові дозволяє вести моніторинг динаміки розвитку запального процесу [32]. Власні дані, подані у статті, вказують на те, що збільшення активності еластази і мієлопероксидази в крові свідчить про розвиток запального процесу в організмі, а вірогідне зниження активності цих ензимів при застосуванні PRP може вказувати на гальмування процесу запалення. Ці дані узгоджуються з гістологічними даними про запобігання деградуючим змінам у суглобовому хрящі при застосуванні PRP.
Активність мієлопероксидази має обернену залежність з церулоплазміном, що протидіє прозапальній активності нейтрофілів [33, 34]. Церулоплазмін є протеїном гострої фази, та його високий рівень при артрозі є відповіддю антиоксидантної системи на запалення у колінному суглобі і може вказувати на його можливу захисну роль при запаленні, що відзначали у пацієнтів з ревматоїдним артритом [35, 36]. Мієлопероксидаза здатна утворювати мультикомпонентний комплекс з церулоплазміном та апоВ-100-вмісними ліпопротеїнами в крові і, таким чином, взаємно впливати один на одного. В деяких дослідженнях [37] показано, що активність антиоксидантних ензимів — супероксиддисмутази і каталази — при артрозі зменшується, що свідчить про пошкодження клітин при дистрофічних і запальних змінах у суглобі. S. Kajanachumpol та співавт. показали, що лікування артрозу частково нормалізує показники цієї системи [38]. Але у наших дослідженнях виявлено зменшення активності супероксиддисмутази і каталази, що вказує на виснаження захисних механізмів при прогресуючих дистрофічних процесах у суглобі. Після введення PRP встановлено зменшення вмісту продуктів окисної модифікації ліпідів і протеїнів, що свідчить про менше пошкодження тканин суглоба та відновлення антиоксидантних ензимів.
Треба відзначити, що зростання активності мієлопероксидази разом зі зниженням активності ензимів антиоксидантного захисту (каталази і супероксиддисмутази) може сприяти підтриманню високого рівня окиснення ліпопротеїнів. Останні, у свою чергу, здатні підсилювати адгезію клітин крові до ендотелію, індукувати експресію факторів росту в гладком’язових клітинах, інгібувати експресію NO-синтази та викликати дисфункцію ендотелію, що може лежати в основі розвитку атеросклеротичного процесу і запалення [8, 25].
Наша робота — це перше дослідження, що описує можливість позитивного впливу на ланки запальної реакції у крові при експериментальному артрозі після введення PRP. Вимірювання величин досліджуваних в роботі біохімічних показників може служити корисним додатковим діагностичним маркером в оцінці ефективності лікування артрозу, а також профілактики судинних ускладнень.
Висновки
За даними гістологічних та біохімічних досліджень, жодних ознак погіршення стану тварин з експериментальним артрозом колінного суглоба після введення PRP не виявлено, що свідчить про біологічну безпечність локального введення PRP у порожнину суглоба. Введення в суглобову порожнину PRP запобігало прогресуючим змінам хрящової поверхні великогомілкової кістки. Після введення у суглоб PRP встановлено зменшення активності лейкоцитарної еластази і мієлопероксидази, вмісту продуктів окисної модифікації ліпідів та протеїнів і зростання рівня відновленого глутатіону у крові, що вказує на зменшення інтенсивності запального процесу й активації процесів відновлення.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Дубровин Г.М., Лебедев А.Ю. Прогнозирование и профилактика развития посттравматического гонартроза при внутрисуставных переломах костей коленного сустава. Хирургия. Журнал им. Н.И. Пирогова. 2018. 12. 106-110.
2. Chaves H.V., Ribeiro R., de Souza A.M. et al. Experimental model of zymosan-induced arthritis in the rat temporomandibular joint: role of nitric oxide and neutrophils. J. Biomed. Biotechnol. 2011. 2011. 707985.
3. Troeberg L., Nagase H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et biophysicaacta. 2011. 1824 (1). 133-145.
4. Muley M.M., Reid A.R., Botz B., Bölcskei K., Helyes Z., McDougall J.J. Neutrophil elastase induces inflammation and pain in mouse knee joints via activation of proteinase-activated receptor-2. BJP. 2015. 173 (4). 766-777.
5. Breedveld F.C. Osteoarthritis — the impact of a serious disease. Rheumatology (Oxford). 2004. 43 (Suppl. 1). i4-8.
6. DeLong J.M., Russell R.P., Mazzocca A.D. Platelet-rich plasma: the PAW classification system. Arthroscopy. 2012. 28 (7). 998-1009.
7. Shahid M., Kundra R. Platelet-rich plasma (PRP) for knee disorders. EFORT Open Rev. 2017. 2 (1). 28-34.
8. Sánchez M., Anitua E., Delgado D. et al. Platelet-rich plasma, a source of autologous growth factors and biomimetic scaffold for peripheral nerve regeneration. Expert Opin. Biol. Ther. 2017. 17 (2). 197-212.
9. Marx R.E. Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant. Dent. 2001. 10 (4). 225-228.
10. Чернишенко В., Штайнберг К., Луговська Н. та ін. Приготування висококонцентрованої аутологічної плазми крові, збагаченої тромбоцитами, для біомедичного використання. Укр. біохім. журн. 2019. 91 (2). 19-27.
11. Dhurat R., Sukesh M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. JCAS. 2014. 7 (4). 189-97.
12. Wasterlain A.S., Braun H.J., Harris A.H., Kim H.J., Dragoo J.L. The systemic effects of platelet-rich plasma injection. Am. J. Sports Med. 2013. 41 (1). 186-193.
13. Anitua E., Andia I., Ardanza B., Nurden P., Nurden A.T. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb. Haemost. 2004. 91 (1). 4-15.
14. Abegão K.G., Bracale B.N., Delfim I.G. et al. Effects of heterologous platelet-rich plasma gel on standardized dermal wound healing in rabbits. Acta Cir. Bras. 2015. 30 (3). 209-215.
15. Barrionuevo D.V., Laposy C.B., Abegão K.G. et al. Comparison of experimentally-induced wounds in rabbits treated with different sources of platelet-rich plasma. Lab. Anim. 2015. 49 (3). 209-214.
16. Manolescu B.N., Berteanu M., Cinteza D. Effect of the nutritional supplement ALA nerv on the serum PON1 activity in postacute stroke patients. Pharmacol. Rep. 2013. 65 (3). 743-750.
17. Горудко И.В., Костевич В.А., Соколов А.В. и др. Повышенная активность миелопероксидазы — фактор риска ишемической болезни сердца у больных сахарным диабетом. Биомед. химия. 2012. 58 (4). 475-484.
18. Спосіб визначення активності макрофагальної еластази: пат. 28914 UA. МПК G 01 N 33/50 / Кубишкін А.В., Пальона Ю.В., Фомочкіна І.І. Опубл. 25.12.2007, Бюл. № 21.
19. Королюк M.А., Иванова M.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. Лаб. дело. 1988. 1. 16-19.
20. Стальная И.Д., Гаришвили Т.Г. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты. Современные методы в биохимии. Под ред. В.Н. Ореховича. М.: Медицина, 1977. 66-68.
21. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике: В 2 т. Т. 2. Мн.: Беларусь, 2000. 74-75.
22. Кузьминская У.А. Биохимические, иммунологические и биофизические методы в токсикологическом эксперименте. Методическое руководство. К.: Здоровье, 1989. 23-25.
23. Stoppiello L.A., Mapp P.I., Wilson D. et al. Structural associations of symptomatic knee osteoarthritis. Arthritis & rheumatology (Hoboken, N.J.). 2014. 66 (11). 3018-3027.
24. Glynn L.G., Mustafa A., Casey M. et al. Platelet-rich plasma (PRP) therapy for knee arthritis: a feasibility study in primary care. Pilot and feasibility studies. 2018. 4. 93.
25. Ubilla D., Ananías J., Ortiz-Muñoz L., Irarrázaval S. Is platelet-rich plasma effective for osteoarthritis? Medwave. 2018. 8 (3). e7215.
26. Muley M.M., Krustev E., Reid A.R., McDougall J.J. Prophylactic inhibition of neutrophil elastase prevents the development of chronic neuropathic pain in osteoarthritic mice. Journal of neuroinflammation. 2017. 14 (1). 168.
27. Platelet-rich plasma compositions: рat. US 9,233,126 B2. Sanchez J.A., Navarro C.F., Trullas J.C., Safont L.O., Corominas E.G. Publ. 12.01.2016.
28. Страфун С.С., Вовченко А.Я., Гайович І.В. Застосування факторів росту у хворих із застарілими пошкодженнями ротаторної манжети плеча. Травма. 2011. 12 (1). 65-68.
29. Steinbeck M.J., Nesti L.J., Sharkey P.F., Parvizi J. Myeloperoxidase and chlorinated peptides in osteoarthritis: potential biomarkers of the disease. J. Orthop. Res. 2007. 25 (9). 1128-1135.
30. De Vries M.A., Alipour A., Birnie E. et al. Coronary leukocyte activation in relation to progression of coronary artery disease. Front. Med. 2016. 10 (1). 85-90.
31. Stamp L.K., Khalilova I., Tarr J.M. et al. Myeloperoxidase and oxidative stress in rheumatoid arthritis. Rheumatology (Oxford). 2012. 51 (10). 1796-1803.
32. Chapman A.L., Mocatta T.J., Shiva S. et al. Ceruloplasmin is an endogenous inhibitor of myeloperoxidase. J. Biol. Chem. 2013. 288 (9). 6465-6477.
33. Segelmark M., Persson B., Hellmark T., Wieslander J. Binding and inhibition of myeloperoxidase (MPO): a majorfunction of ceruloplasmin? Clin. Exp. Immunol. 1997. 108. 167-174
34. Conforti A., Franco L., Menegale G. et al. Serum copper and ceruloplasmin levels in rheumatoid arthritis and degenerative joint disease and their pharmacological implications. Pharmacol. Res. Commun. 1983. 15 (9). 859-867.
35. Strecker D., Mierzecki A., Radomska K. Copper levels in patients with rheumatoid arthritis. Ann. Agric. Environ. Med. 2013. 20 (2). 312-316.
36. Scott J.L., Gabrielides C., Davidson R.K. et al. Superoxide dismutase downregulation in osteoarthritis progression and end-stage disease. Ann. Rheum. Dis. 2010. 69 (8). 1502-1510.
37. Tikhova Y., Dvorshchenko K., Dranitsina A. et al. Prooxidant — antioxidant status and Ptgs2, Nos2 genes expression in rat cartilage with osteoarthritis and after the treatment of chondroitin sulfate. RJPBCS. 2017. 8 (4). 994-1001.
38. Kajanachumpol S., Vanichapuntu M., Verasertniyom O., Totemchokchyakarn K., Vatanasuk M. Levels of plasma lipid peroxide products and antioxidant status in rheumatoid arthritis. Southeast. Asian J. Trop. Med. Public. Health. 2000. 31 (2). 335-338.

/49.jpg)
/48.jpg)