Резюме
Незважаючи на велику кількість досліджень, присвячених проблемі постопераційних когнітивних розладів у пацієнтів, які перенесли загальну анестезію, питання патогенетично обґрунтованого вибору методів корекції когнітивних порушень у доопераційному періоді залишається суперечливим. Метою дослідження було вивчення особливостей вільнорадикальних процесів в отоларингологічних пацієнтів, яким проводились оперативні втручання під загальною анестезією з використанням керованої гіпотензії, та аналіз їх значення в патогенезі післяопераційних когнітивних порушень. Матеріали та методи. Проспективне дослідження за участю 33 хворих (19 чоловіків, 14 жінок), яким були проведені отоларингологічні втручання під загальною анестезією із контрольованою гіпотензією. Середній вік становив 45,24 ± 15,46 року. Клінічне дослідження проводили з використанням низки нейрофізіологічних тестів (тест П’єрона — Рузера, коректурна проба Бурдона, тест Лурія, тест Равена). Динаміку окислювального процесу оцінювали за сироватковими рівнями протеїнів карбонільних груп, дієнових кон’югат, малондіальдегіду, протеїнів SH-групи, даними активності супероксиддисмутази. Рівень інтерлейкіну-18 і вміст нейронспецифічної єнолази в сироватці визначали імуноферментним методом. Статистичний аналіз було проведено з використанням статистичного пакета SPSS 20 (SPSS Inc.). Результати. Загальна анестезія в поєднанні з фармакологічно контрольованою гіпотензією сприяє розвитку постопераційних когнітивних розладів, що проявляються зниженою концентрацією й увагою (за даними тесту П’єрона — Рузера та коректурної проби), зменшенням рівня й обсягу короткої пам’яті за даними тесту Лурія в ранній постопераційний період, а також суттєвим збільшенням сироваткового рівня нейронспецифічної єнолази після операції (p < 0,05). Отримані дані вказують, що в пацієнтів після загальної анестезії в умовах керованої гіпотензії має місце порушення оксидантної рівноваги, що характеризується збільшенням синтезу вільних радикалів із вірогідним зростанням рівнів карбонільних груп протеїнів, дієнових кон’югат і малонового діальдегіду в крові (р < 0,001), а також порушеннями антиоксидантного потенціалу зі зниженням активності супероксиддисмутази та рівнів SH-груп протеїнів. У пацієнтів із постопераційними когнітивними розладами відзначені найбільш несприятливі відмінності в оксидантному статусі: рівні карбонільних груп протеїнів, дієнових кон’югат і малонового діальдегіду в крові були більшими на 20,7; 16,2 і 30,2 % відповідно, у той же час рівень антиоксидантного захисту знизився на 33,2 %, а вміст протеїнів SH-групи на 6,7 % порівняно з пацієнтами без ознак постопераційних когнітивних розладів. Висновки. Зміни в оксидантному статусі являють собою одну з патогенетичних ланок розвитку постопераційних когнітивних розладів у хворих отоларингологічного профілю, яким була проведена загальна анестезія з контрольованою гіпотензією.
Несмотря на большое количество исследований, посвященных проблеме постоперационных когнитивных расстройств у пациентов, перенесших общую анестезию, вопрос патогенетически обоснованного выбора методов коррекции когнитивных нарушений в дооперационном периоде остается противоречивым. Целью исследования было изучение особенностей свободнорадикальных процессов у отоларингологических пациентов, которым проводились оперативные вмешательства под общей анестезией с использованием управляемой гипотензии, и анализ их значения в патогенезе послеоперационных когнитивных нарушений. Материалы и методы. Проспективное исследование с участием 33 больных (19 мужчин, 14 женщин), которым были проведены отоларингологические вмешательства под общей анестезией с контролируемой гипотензии. Средний возраст составил 45,24 ± 15,46 года. Клиническое исследование проводили с использованием ряда нейрофизиологических тестов (тест Пьерона — Рузера, корректурная проба Бурдона, тест Лурия, тест Равена). Динамику окислительного процесса оценивали по сывороточным уровням протеинов карбонильных групп, диеновых конъюгат, малондиальдегида, протеинов SH-группы, данным активности супероксиддисмутазы. Уровень интерлейкина-18 и содержание нейронспецифической енолазы в сыворотке определяли иммуноферментным методом. Статистический анализ был проведен с использованием статистического пакета SPSS 20 (SPSS Inc.). Результаты. Общая анестезия в сочетании с фармакологически контролируемой гипотензией способствует развитию постоперационных когнитивных расстройств, проявляющихся пониженной концентрацией и вниманием (по данным теста Пьерона — Рузера и корректурной пробы), уменьшением уровня и объема короткой памяти по данным теста Лурия в раннем постоперационном периоде, а также существенным увеличением сывороточного уровня нейронспецифической енолазы после операции (p < 0,05). Полученные данные указывают, что у пациентов после общей анестезии в условиях управляемой гипотензии имеет место нарушение оксидантного равновесия, характеризующегося увеличением синтеза свободных радикалов с вероятным ростом уровней карбонильных групп протеинов, диеновых конъюгат и малонового диальдегида в крови (р < 0,001), а также нарушениями антиоксидантного потенциала со снижением активности супероксиддисмутазы и уровней SH-групп белков. У пациентов с постоперационными когнитивными расстройствами отмечены наиболее неблагоприятные различия в оксидантном статусе: уровни карбонильных групп протеинов, диеновых конъюгат и малонового диальдегида в крови были больше на 20,7; 16,2 и 30,2 % соответственно, в то же время уровень антиоксидантной защиты снизился на 33,2 %, а содержание протеинов SH-группы на 6,7 % по сравнению с пациентами без признаков постоперационных когнитивных расстройств. Выводы. Изменения в оксидантном статусе представляют собой одно из патогенетических звеньев развития постоперационных когнитивных расстройств у больных отоларингологического профиля, которым была проведена общая анестезия с контролируемой гипотензией.
Background. Despite a large number of studies devoted to the problem of postoperative cognitive dysfunction that occurs in patients after general anaesthesia, the question of the pathogenetically based choice of methods for correction of cognitive dysfunctions in the perioperative period remains controversial. The purpose of the study was to investigate the peculiarities of free radical processes in otolaryngologic patients undergoing surgical intervention under conditions of general anaesthesia with controlled hypotension and to analyse their significance in the pathogenesis of postoperative cognitive dysfunction. Materials and methods. A prospective study was conducted on 33 otolaryngologic patients (19 men and 14 women) undergoing surgical intervention under general anaesthesia using controlled hypotension. The mean age of the patients was 45.24 ± 15.46 years old. A clinical study was conducted using a battery of neurophysiological tests (Pieron-Ruzer technique, Bourdon proof-reading test, Luriy test, Raven test). The progress of oxidation was evaluated by determining serum levels of protein carbonyl groups, diene conjugates, malondialdehyde, protein SH-groups and superoxide dismutase activity. The serum level of interleukin-18 and the content of neuron-specific enolase were determined by the enzyme immunoassay. Statistical analysis of the received data was performed in the statistical package SPSS 20 (SPSS Inc.). Results. General anaesthesia in combination with medication hypotension promotes the development of postoperative cognitive dysfunction, manifested with decreased concentrations and performance of attention (according to the results of the Pierron-Ruzer technique and proof-reading test), by decreased rate and volume of short-term memory with a decrease in the Luriy test in the early postoperative period as well as by a significant increase of the serum level of the neuron-specific enolase in the postoperative period (p < 0.05). There is a disturbance of oxidative balance in patients that undergo general anaesthesia under conditions of controlled hypotension, which is characterized by an increase in the synthesis of free radicals, in particular, carbonyl groups of proteins, diene conjugates, malonic dialdehyde (p < 0.001) and violations of the antioxidant potential with a decreased activity of superoxide dismutase and levels of SH-protein groups. The patients with postoperative cognitive dysfunction presented with the most negative differences in the oxidative status: the level of carbonyl groups of proteins, diene conjugates and malonic dialdehyde in the blood was higher by 20.7, 16.2 and 30.2 %, respectively, while antioxidant protection levels were significantly lower by 33.2 % and by 6.7% for SH-protein groups compared to patients without postoperative cognitive dysfunction. Conclusions. Changes in oxidative status are one of the pathogenetic links in the development of postoperative cognitive dysfunction in otolaryngologic patients undergoing general anaesthesia with controlled hypotension.
Вступ
Протягом останніх років проблема когнітивних розладів — актуальне питання сучасної медицини. Одним із таких порушень є післяопераційна когнітивна дисфункція (ПОКД) — синдром, що клінічно характеризується порушенням когнітивних функцій (однієї або декількох), підтвердженим даними нейропсихологічного тестування, що проведене до та після операції [2, 8, 10, 11]. Згідно із статистичними даними, частота виникнення ПОКД варіює від 7 до 83 % залежно від виду хірургічного втручання [2, 4, 5].
На сьогодні при отоларингологічних оперативних втручаннях в умовах загальної анестезії широко використовується метод керованої гіпотензії, що дозволяє істотно зменшити кровоточивість тканин під час операції. Водночас застосування керованої гіпотензії під час проведення загальної анестезії спричиняє ішемічно-гіпоксичні зміни в головному мозку, які включають декілька механізмів: ураження клітин, викликане вільними радикалами — оксидантний стрес, ексайтотоксичність, запалення, секвестрація молекул та ін. Ці зміни, ймовірно, є важливою ланкою патогенезу різного роду порушень, в тому числі ПОКД [6, 8–11]. Актуальність оксидантного стресу для головного мозку полягає в тому, що нейрони є надзвичайно вразливими для вільних радикалів. Це пов’язано з тим, що мозок споживає до 50 % наявного в організмі кисню; з 10 млрд мітохондрій, які перебувають в тканинах нашого організму, половина припадає на головний мозок; для нього характерно тотальне домінування аеробного механізму енергопродукції; мозок багатий поліненасиченими жирними кислотами, тому виникає потужна активація перекисного окислення у відповідь на будь-яке ушкодження [1]. Це пояснює той факт, що приблизно у третини пацієнтів, яким проводилась загальна анестезія з використанням керованої гіпотонії, відмічаються когнітивні порушення у вигляді зниження пам’яті, тяжкості концентрації уваги, швидкої втомлюваності. Такого роду дисфункції переважно тривають від 3 до 7 днів.
Безперечно, природа формування ПОКД є мультифакторіальною та являє собою сукупність різних патофізіологічних процесів. При цьому оксидантний стрес відіграє важливу роль у розвитку нейродегенеративних процесів: перекисне окислення ліпідів провокує окисне пошкодження нейронів, що призводить до їх загибелі і супроводжується продукцією високореактивних біомолекул, які мають нейротоксичні властивості [7].
Наявність ПОКД в ранньому післяопераційному періоді є фактором ризику виникнення стійких когнітивних порушень, тому запорука профілактики останніх — обізнаність лікарів щодо діагностики та максимально ранньої корекції ПОКД [12], а також інтенсифікація вивчення основних потенційних механізмів розвитку когнітивних розладів та їх корекції.
Метою даної роботи було вивчення особливостей вільнорадикальних процесів в отоларингологічних пацієнтів, яким проводились оперативні втручання під загальною анестезією з використанням керованої гіпотензії, та аналіз їх значення в патогенезі післяопераційних когнітивних порушень.
Матеріали та методи
На базі отоларингологічного відділення Вінницької обласної клінічної лікарні імені М.І. Пирогова проведене проспективне контрольоване дослідження, в якому брали участь 33 хворі (19 чоловіків, 14 жінок), яким були проведені оперативні втручання під загальною анестезією з використанням керованої гіпотензії. Вік хворих — від 18 до 77 років (у середньому — 45,24 ± 15,46 року; медіана віку — 47,0, інтерквартильний розмах — 25-й та 75-й процентилі — 37–56 років). У групу порівняння ввійшли 20 практично здорових пацієнтів.
Критеріями включення пацієнтів в дослідження були: вік старше 18 років; заплановане отоларингологічне оперативне втручання під загальною анестезією тривалістю 1 година або більше із застосуванням керованої гіпотензії; анестезіологічний ризик за ASA ІІ/ІІІ; відсутність у пацієнтів супутніх вад слуху та зору, захворювань нервової системи (деменція, гостре порушення мозкового кровообігу і т.п.), деменції різного генезу (вихідна оцінка за шкалою MMSE — менше 23 балів), психічних захворювань; згода хворого на участь у дослідженні.
Отоларингологічні оперативні втручання проводилися з приводу викривлення перегородки носа та хронічного гіпертрофічного/вазомоторного риніту, гострого пансинуситу/гемісинуситу, хронічного поліпозного пансинуситу, хронічного декомпенсованого тонзиліту, гострого гнійного середнього отиту, ускладненого мастоїдитом, хронічного мезотимпаніту, хронічного епітимпаніту, сторонніх предметів та остеом приносових порожнин.
Усі оперативні втручання були проведені під інгаляційним ендотрахеальним севофлурановим наркозом, комбінованим із тотальною міорелаксацією. Згідно з даними наркозних карт прооперованих пацієнтів, для анестезіологічної допомоги використовувалися однакові препарати для анестезії. Для досягнення керованої артеріальної гіпотензії під час операції використовували інфузійний розчин 20 мл 0,5% розчину урапідилу на 200 мл 0,9% розчину натрію хлориду.
Для визначення стану вищої нервової дiяльностi використовували батарею нейрофiзiологiчних тестів, а саме тест П’єрона — Рузера для вивчення рівня концентрацiї уваги, коректурну пробу (тест Бурдона) для дослідження розумової працездатності та обсягу уваги, тест Лурія для оцінки стану короткострокової механічної пам’яті та тест Равена для дослідження логічності мислення. Оцінка когнітивних функцій проводилася до операції та в кінці 1-го тижня після операції. Діагноз ПОКД встановлювали згідно із рекомендаціями Міжнародної робочої групи з номенклатури періопераційних когнітивних розладів (International Working Party for Nomenclature of Perioperative Cognitive Disorders), якщо когнітивне зниження виявлялося нижче порогового значення на –1,96 стандартного відхилення [3].
Стан ферментної антиоксидантної системи вивчали за активністю супероксиддисмутази та рівнем протеїнових сульфгідрильних груп (SH-груп). Активність супероксиддисмутази визначали за ступенем гальмування окиснення кверцитину. Рівень SH-груп в сироватці крові визначали за реакцією з реактивом Елмана — 5,5’-дитіобіс(2-нітробензоатом).
Активність вільнорадикального окиснення ліпідів оцінювали за вмістом первинних і вторинних продуктів ліпопероксидації, відповідно дієнових кон’югат та малонового діальдегіду в крові, а активність процесів окисної модифікації протеїнів оцінювали на основі визначення вмісту карбонільних груп протеїнів у сироватці крові. Вміст дієнових кон’югат оцінювали за світлопоглинанням ліпідного екстракту крові в ультрафіолетовій області спектра. Рівень малонового діальдегіду визначали за реакцією з тіобарбітуровою кислотою за набором ТБК-Агат («Биоконт», РФ), а рівень карбонільних груп окисно-модифікованих протеїнів — за реакцією з 2,4-динітрофенілгідразином.
Рівень інтерлейкіну-18 (ІЛ-18) у сироватці крові визначали імуноферментним методом згідно з інструкцією до готового комерційного набору «Интерлейкин-18-ИФА-БЕСТ» («Вектор-Бест», РФ), а вміст нейронспецифічної єнолази в сироватці крові — імуноферментним методом за набором «НСЕ-ІФА» («Хема», Україна) відповідно до інструкції фірми-виробника.
Статистична обробка отриманих даних виконувалася у статистичному пакеті SPSS 20 (SPSS Inc.) з використанням параметричних і непараметричних методів оцінки отриманих результатів. Кількісні параметри наведені у вигляді M ± σ (середнє значення ± середнє квадратичне відхилення). Вірогідність різниці значень між незалежними кількісними величинами визначали за допомогою U-критерію Манна — Уїтні та Вілкоксона.
Результати та обговорення
Дослідження стану когнітивної функції після оперативного втручання на 7-му добу порівняно з показниками доопераційного періоду виявило зниження показників тесту П’єрона — Рузера на 4,3 % (з 74,07 ± 20,59 в доопераційному періоді до 71,02 ± 16,76 після операції); коректурної проби — на 5,8 % (з 14,91 ± 2,19 до 14,09 ± 1,71); тесту Лурія — на 7,4 % (6,95 ± 1,14 до 6,47 ± 0,97), що вказує на вірогідне погіршення концентрації, продуктивності уваги та вербальної пам’яті після оперативного втручання під загальною анестезією в умовах медикаментозної гіпотензії (р = 0,2; р = 0,004 та р = 0,001 відповідно). Також встановлена вірогідна різниця в швидкості та характері відновлення вищих психічних функції під час якісного аналізу помилок, допущених хворими до та після операції при виконанні завдань за тестом Равена (38,60 ± 6,25 % проти 34,97 ± 5,13 % відповідно). Зниження показника однієї/декількох аналізованих когнітивних функцій мали 13 з 33 пацієнтів, що становило 39,4 %.
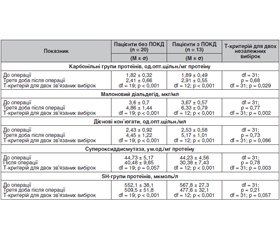
Аналіз даних, наведений у табл. 1, вказує на те, що в доопераційному періоді показники інтенсивності вільнорадикальних процесів у досліджуваних пацієнтів без ПОКД та з такими вірогідно не відрізнялися. Однак у післяопераційному періоді після загальної анестезії в умовах керованої гіпотензії у них мала місце статистично вірогідна активація генерації вільних радикалів та активних форм кисню, про що свідчить вірогідне збільшення рівнів карбонільних груп протеїнів, дієнових кон’югат та малонового діальдегіду порівняно з вихідними показниками до операції (р < 0,001). При цьому у пацієнтів із ПОКД рівень карбонільних груп протеїнів був на 20,7 % більшим порівняно з отоларингологічними пацієнтами, які не мали ПОКД (2,91 ± 0,55 одиниці оптимальної щільності (од.опт.щільн.)/мг проти 2,41 ± 0,66 од.опт.щільн./мг протеїну; р = 0,029). Також про прооксидантний дисбаланс свідчить підвищення дієнових кон’югат у разі розвитку ПОКД, хоча останнє й не було статистично вірогідним. Так, аналогічні показники для дієнових кон’югат становили 16,2 % (5,17 ± 1,01 од.опт.щільн./мл проти 4,45 ± 1,22 од.опт.щільн./мл; р = 0,086). Універсальний маркер перекисного окислення ліпідів — малоновий діальдегід — також виявився статистично вірогідно підвищеним у пацієнтів із ПОКД на 30,2 % порівняно з пацієнтами без ПОКД (6,33 ± 0,79 мкг/мл проти 4,86 ± 1,44 мкг/мл; р = 0,002) (табл. 1).
/100.jpg)
Як видно з табл. 1, процеси інтенсифікації генерації активних форм кисню після оперативного втручання в умовах загальної анестезії з використанням керованої гіпотензії супроводжувалися паралельним зниженням активності антиоксидантної системи із розвитком проантиоксидантного дисбалансу. Так, активність супероксиддисмутази та рівні SH-груп протеїнів продемонстрували вірогідне зниження у післяопераційному періоді, найбільш виражене у пацієнтів із ПОКД. Зокрема, показники антиоксидантного захисту у пацієнтів із ПОКД виявилися вірогідно нижчими: на 33,2 % — для супероксиддисмутази (30,38 ± 7,43 ум.од./мг протеїну у пацієнтів з ПОКД проти 40,48 ± 9,65 ум.од./мг протеїну у пацієнтів без ПОКД; р = 0,003) та на 6,7 % — для SH-груп протеїнів (477,6 ± 32,1 мкмоль/л проти 509,5 ± 51,8 мкмоль/л; р = 0,057) (табл. 1).
Результати нашого дослідження продемонстрували, що в отоларингологічних хворих з ПОКД після оперативного втручання в умовах загальної анестезії з використанням керованої гіпотензії спостерігається дисбаланс у системі «прооксиданти — антиоксиданти» з переважанням вільнорадикальних процесів, при цьому збільшується рівень прозапального ІЛ-18 на 30,2 % порівняно з аналогічним показником пацієнтів без ПОКД (76,22 ± 16,36 пг/мл проти 58,55 ± 22,82 пг/мл; р = 0,022) та в 3,8 раза порівняно з даними здорових осіб (20,01 ± 7,43 пг/мл; р < 0,001) (рис. 1А). Ті ж тенденції, що й ІЛ-18, мають і зміни рівнів нейронспецифічної єнолази, яка є маркером пошкодження нервової тканини. За наявності ПОКД рівень нейронспецифічної єнолази в крові був у 4,4 раза вищим, ніж у пацієнтів без ПОКД (25,19 ± 24,7 мкг/л проти 5,71 ± 4,25 мкг/л; р = 0,002) та в 5,1 раза порівняно з показником здорових осіб (4,97 ± 2,12 мкг/л; р = 0,001). Статистично вірогідної різниці між концентраціями нейронспецифічної єнолази в крові за відсутності ПОКД у прооперованих пацієнтів і здорових осіб не виявлено (р = 0,49) (рис. 1Б).
Таким чином, отримані нами дані дозволяють стверджувати, що в отоларингологічних хворих загальна анестезія в поєднанні з медикаментозною гіпотензією сприяє розвитку післяопераційної когнітивної дисфункції, в патогенезі якої значне місце належить активації вільнорадикального окислення білків і ліпідів клітинних мембран в умовах ймовірної неспроможності або неповної спроможності антиоксидантного захисту.
Висновки
1. Загальна анестезія в поєднанні з медикаментозною гіпотензією сприяє розвитку післяопераційної когнітивної дисфункції, що проявлялась зниженням концентрацiї та продуктивності уваги (за результатами тесту П’єрона — Рузера та коректурної проби), темпів та обсягу короткострокової пам’яті із зменшенням показника тесту Лурія та підтверджується вірогідним збільшенням у ранньому післяопераційному періоді рівня нейронспецифічної єнолази в сироватці крові, яка є маркером пошкодження нервової тканини (р < 0,05).
2. У пацієнтів після загальної анестезії в умовах керованої гіпотензії має місце порушення оксидантної рівноваги, що характеризується як збільшенням синтезу вільних радикалів (вірогідно збільшуються рівні карбонільних груп протеїнів, дієнових кон’югат та малонового діальдегіду (р < 0,001)), так і порушеннями з боку антиоксидантного потенціалу із зниженням активності супероксиддисмутази та рівнів SH-груп протеїнів.
3. Встановлено, що найбільш негативні зміни в оксидантному статусі спостерігаються у пацієнтів із ПОКД (рівень карбонільних груп протеїнів, дієнових кон’югат та малонового діальдегіду в крові є вірогідно вищим на 20,7; 16,2 та 30,2 % відповідно, а показників антиоксидантного захисту — вірогідно нижчим на 33,2 % для суперосиддисмутази та на 6,7 % для SH-груп протеїнів порівняно з пацієнтами без ПОКД. Це вказує на вагому патогенетичну роль оксидантного статусу в генезі ПОКД в отоларингологічних хворих після загальної анестезії з використанням керованої гіпотензії, що створює підґрунтя для вивчення можливостей корекції виявлених порушень та реалізації нейропротекторного ефекту з потенційним зменшенням ризику розвитку ПОКД.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Дума С.Н., Рагино Ю.И. Роль антиоксидантов в коррекции психовегетативных, астенических и когнитивных нарушений. Трудный пациент. 2011. 4. 28-36.
2. Новицкая-Усенко Л.В. Послеоперационная когнитивная дисфункция в практике врача-анестезиолога. Медицина неотложных состояний. 2017. 4(83). 9-15.
3. Овезов А.М., Пантелеева М.В., Князев А.В., Луговой А.В., Брагина С.В. Когнитивная дисфункция и общая анестезия: от патогенеза к профилактике и коррекции. Неврология, психиатрия, психосоматика. 2016. 3. 101-5.
4. Стаднік С.М. Когнітивна дисфункція в практиці терапевта і кардіолога. Острые и неотложные состояния в практике врача. 2016. 1. 35-40.
5. Усенко Л.В., Криштафор А.А., Тютюнник А.Г. Дифференцированный подход к профилактике и ранней коррекции нарушений когнитивных функций в послеоперационном периоде в зависимости от их исходного состояния. Медицина неотложных состояний. 2016. 4(75). 237-8.
6. Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме. Международный неврологический журнал. 2011. 2. 40.
7. Шнайдер Н.А., Салмина А.Б. Биохимические и молекулярные механизмы патогенеза послеоперационной когнитивной дисфункции. Неврологический журнал. 2007. 12(2). 41-7.
8. Шнайдер Н.А., Шпрах В.В., Салмина А.Б. Послеоперационная когнитивная дисфункция: профилактика, диагностика, лечение. Методическое пособие для врачей. Красноярск: Оперативная полиграфия, 2005. 95 с.
9. Abildstrom H., Rasmussen L.S., Rentowl P., Hanning C.D., Rasmussen H., Kristensen P.A., Moller J.T. Cognitive dysfunction 1-2 years after non-cardiac surgery in the elderly. Acta Anaesthesiol. Scand. 2000. 44(10). 1246-51.
10. Ancelin M.L., De Roquefeuil G., Ritchie K. Anesthesia and postoperative cognitive dysfunction in the elderly: a review of clinical and epidemiological observations. Rev. Epidemiol. Sante Publique. 2000. 48(5). 459-72.
11. Bhutta A.T. Ketamine: a controversial drug for neonates. Semin. Perinatol. 2007. 31(5). 303-8.
12. Fodale V., Santaria L.B., Schifilliti D., Mandel P.K. Anesthetics and postoperative cognitive dysfunction: a pathological mechanism mimicking Alzheimer’s disease. Anesthesia. 2010. 65(4). 388-95.

/100.jpg)
/101.jpg)